左心收缩功能不全合并肺动脉高压患者的临床特点及相关因素
2011-05-23刘杨清李庆雪王国干张建黄杰毛懿倪新海
刘杨清,李庆雪,王国干,张建,黄杰,毛懿,倪新海
慢性心力衰竭(心衰)是各种器质性心脏病的共同终末阶段。左心收缩功能不全的患者并发肺动脉高压,会导致病情进一步恶化。本研究连续选取慢性心衰的住院患者(行漂浮导管检查),分为正常肺动脉压组和肺动脉高压组,比较两组患者的特征,以更好地指导临床实践。
1 资料与方法
研究人群和入选标准:连续入选2009-09至2010-07我院收治的心力衰竭住院患者60例(扩张型心肌病56例,缺血性心肌病4例),男性40例(67.7%),女性20例(22.3%)。入选标准:左心收缩功能不全(左心室射血分数小于0.40)并行漂浮导管检查的住院患者,且均填写知情同意书。排除标准:慢性阻塞性肺病,先天性心脏病,瓣膜性心脏病,栓塞性疾病,结缔组织性疾病,特发性肺动脉高压,门静脉疾病,急性冠状动脉脉综合症和感染患者。
评估方法及分组:入院后患者的一般病例特征,吸烟,饮酒,高血脂,糖尿病和高血压等相关病史。病程不满一个月的,按照一个月统计。高血压病为既往有高血压病史或入院后测量血压大于140/90mmHg(1mmHg=0.133 Pka)。糖尿病为既往有糖尿病病史或入院后发现糖尿病。心房颤动为既往有心房颤动病史或入院后发现心房颤动。收集N末端B型利钠肽原(NT-proBNP)、大内皮素、高敏C反应蛋白等生化检查指标,超声心动图及漂浮导管的检查结果。肺动脉高压[1](pulmonary hypertension)定义为:导管测得肺动脉平均压大于25mmHg。根据平均肺动脉压将患者分为正常肺动脉压组(n=20)和肺动脉高压组(n=40)。
数据分析及统计学处理:所有数据分析采用SPSS 16.0软件包统计。计量资料用均数±标准差表示,组间比较采用成组t检验。计数资料用百分比表示,组间比较采用Pearson卡方检验及多元回归分析。双侧P<0.05有统计学意义。
2 结果
一般资料:两组患者在年龄、性别、身高、体重、收缩压、舒张压、入院时心率、吸烟史、饮酒史、病程、是否合并高血压病等因素差异均无统计学意义(P均>0.05)。表1
表1 两组患者一般资料[%(例),]

表1 两组患者一般资料[%(例),]
注:1mmHg=0.133 kPa
=40年龄(岁)正常肺动脉压组n=20肺动脉高压组n 53.25±12.24 43.90±13.45男性 65.00(13) 85.00(34)身高(cm) 159.40±35.40 169.80±6.30体重(kg) 69.40±12.00 66.60±13.20收缩压(mmHg) 112.20±15.80 107.30±19.50舒张压(mmHg) 69.50±11.00 73.50±15.20心率(次/分钟) 76.20±15.50 87.90±18.20吸烟史 40.00(8) 52.50(21)饮酒史 30.00(6) 47.50(19)病程(年) 59.55±72.10 51.50±62.65并发症糖尿病 10.00(2) 15.00(6)高血压 35.00(7) 20.00(8)高血脂 15.00(3) 7.50(3)心房颤动 15.00(3) 30.00(12)扩张型心肌病 90.00(18) 95.00(38)缺血性心肌病 10.00(2) 5.00(2)
两组患者生化检查结果:肺动脉高压组比正常肺动脉压组 N-proBNP[(2946.50±1434.50)fmol/ml vs(1328.60±811.90)fmol/ml]水平升高,血浆大内皮素[(1.42±0.88)fmol/ml vs(0.83±0.45)fmol/ml]的水平也升高,差异有统计学意义(P<0.05)。余见表2。
表2 两组患者生化检查结果()
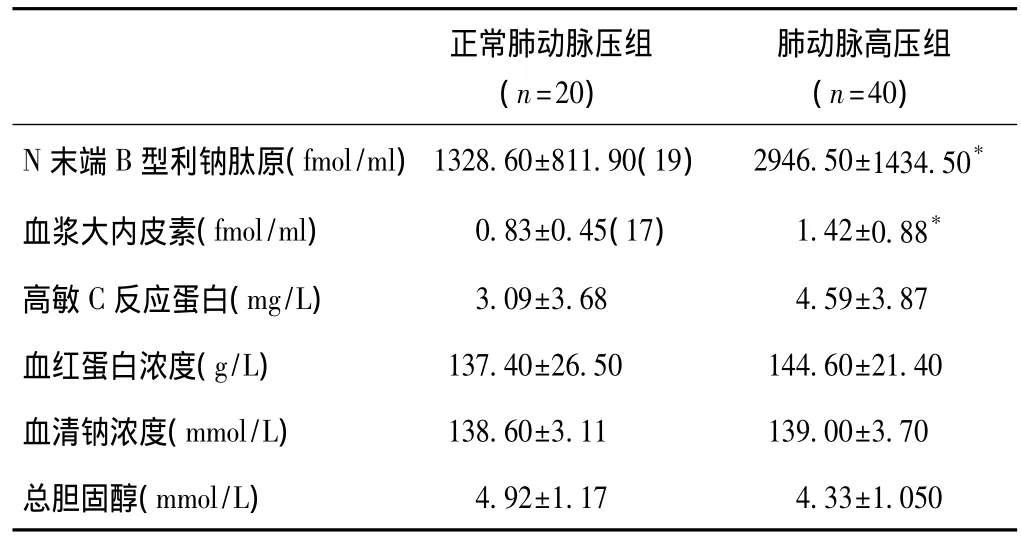
表2 两组患者生化检查结果()
注:与正常肺动脉压组比较*P<0.05 括号内的数字为实施检查的病例数
正常肺动脉压组(n=20)肺动脉高压组(n=40)N末端B型利钠肽原(fmol/ml)1328.60±811.90(19) 2946.50±1434.50*4.92±1.17 4.33±1.050血浆大内皮素(fmol/ml) 0.83±0.45(17) 1.42±0.88*高敏C反应蛋白(mg/L) 3.09±3.68 4.59±3.87血红蛋白浓度(g/L) 137.40±26.50 144.60±21.40血清钠浓度(mmol/L) 138.60±3.11 139.00±3.70总胆固醇(mmol/L)
超声心动图检查结果:肺动脉高压组比正常肺动脉压组左心房前后径[(50.20±9.30)mm vs(42.20±7.10)mm]增大、右心室前后径[(28.30±7.00)mm vs(21.80±4.40)mm]也增大,差异有统计学意义(P<0.05)。表3
表3 两组患者超声心动图检查结果()

表3 两组患者超声心动图检查结果()
注:与正常肺动脉压组比较 *P<0.05 余注见表2
正常肺动脉压组(n=20)肺动脉高压组(n=40)67.90±13.20 69.20±9.60左心室射血分数(%) 32.40±12.80 31.60±11.40左心房前后径(mm) 42.20±7.10 50.20±9.30*(37)右心室前后径(mm) 21.80±4.40(19) 28.30±7.00*(36)左心室舒张末期前后直径(mm)
漂浮导管检查结果:肺动脉高压组比正常肺动脉压组右心房平均压、右心室平均压、肺动脉平均压、肺动脉收缩压、肺动脉舒张压、毛细血管楔压均升高,心指数降低,差异有统计学意义(P<0.05)。余表4
表4 两组患者漂浮导管检查结果()

表4 两组患者漂浮导管检查结果()
注:与正常肺动脉压组比较 *P<0.05 余注见表1、2
正常肺动脉压组(n=20)肺动脉高压组(n=40)右心房平均压(mmHg) 4.60±5.50 11.00±7.30(35)*右心室平均压(mmHg) 10.30±10.10(17) 22.30±10.70(33)*肺动脉平均压(mmHg) 16.40±4.10 40.20±9.50*肺动脉收缩压(mmHg) 27.30±7.20 58.40±15.10*肺动脉舒张压(mmHg) 11.20±5.30 29.90±8.00*毛细血管楔压(mmHg) 11.00±8.10 24.00±8.80*肺循环阻力(DS/cm5) 268.30±358.30 329.60±276.40心输出量(L/min) 4.70±1.20(18) 4.30±4.90(36)心指数(L/(min·m2)) 2.80±0.80(16) 2.00±0.60(34)*
多元回归分析:以是否合并肺动脉高压为应变量,以是否吸烟、饮酒,是否合并糖尿病、高血脂、心房颤动,N-proBNP,大内皮素和高敏C反应蛋白为自变量进行多元线性回归分析,F值为1.279,显著性概率是0.2760。因为显著性概率<0.5,表明回归不显著,以上因素与肺动脉高压无明显线性相关性。
3 讨论
肺循环是个低压循环系统,当导管测得肺动脉平均压大于25mmHg即定义为肺动脉高压。本研究排除肺血管阻塞性疾病、肺实质性疾病及缺氧性疾病,仅入选左心疾病相关的病例。
有关左心疾病相关肺动脉高压的有创检查资料,国内少见报道。本文讨论的是左心收缩功能不全为主的心力衰竭合并肺动脉高压差异及特点,其中共有40例并发肺动脉高压,高于非肺动脉高压组20例。
本研究通过比较肺动脉高压组和正常肺动脉压组的一般资料、临床并发症、生化数据、超声心动图数据和漂浮导管数据,探讨左心收缩功能不全合并肺动脉高压患者的差异及其特点。研究发现一般资料(年龄、性别、吸烟史、饮酒史)、临床并发症(糖尿病、高脂血症、心房颤动等)等无明显差别。多元回归分析不显著,进一步提示以上资料上无明显差别。
在60例患者中,有40例并发肺动脉高压,比例为0.67,而 Khush 等[2]的研究比例为 0.47。而 2009 年Lam等[3]研究发现左心室射血分数正常的心力衰竭患者中0.80合并肺动脉高压。本研究患病率明显和以上研究的不同,考虑研究误差为:本研究人群为住院心力衰竭患者并有条件行漂浮导管检查的患者,且以扩张型心肌病为主,难免存在统计学误差。
脑利尿钠肽(Brain natriuretic peptide,BNP)是1988年发现的,主要由左心室心肌细胞分泌。N-proBNP和BNP等比例存在。研究表明血浆BNP可作为心力衰竭的诊断、治疗及预后评估的依据[4]。也可评估、预测特发性肺动脉高压及动脉型肺动脉高压的病情[5,6]。该研究发现肺动脉高压组的 N-proBNP是升高的,高于正常肺动脉压组,并且有统计学意义。与Andreassen等[7]研究一致,N-proBNP可作为病情的一个预测因子。但是,应该知道BNP是心衰的结果,本身不参与肺动脉高压的形成。
内皮素(endothelin,ET)不仅存在于血管内皮,也广泛存在于各种组织和细胞中,是调节心血管功能的重要因子,对维持基础血管张力与心血管系统稳态起重要作用[8~10]。大内皮素水解产生内皮素。现有研究发现大内皮素和特发性肺动脉高压具有相关性,可作为特发性肺动脉高压的预后因子[11]。同时,也发现大内皮素浓度和慢性心衰的心功能呈正相关,可作为病情的评价因素[12]。本研究发现肺动脉高压组的大内皮素是升高的,P值为0.002,具有统计学意义。与Barton等[13]总结的结果是一致的,内皮素也可预测病情。
本研究发现肺动脉高压组肺毛细血管楔压是升高的,右心室平均压,右心房压也是升高的,并且有统计学意义。另外,我们研究发现肺动脉高压组的右心室是增大的,左心房内径也是增大的,且有统计学意义。左心收缩功能不全是否会导致肺动脉压升高呢?美国心脏病学会基金会(ACCF)/美国心脏病协会(AHA)2009年专家共识[14]:毛细血管楔压反映左心房压,左心室舒张期末压。毛细血管楔压增高,表示左心室舒张末期压力升高。各种病因所致的左心室充盈压升高会导致肺动脉压力升高。Chemla等[15]报道左心疾病导致左心室射血分数降低(心指数下降),左心室内压力增大,肺静脉压被动升高,跨肺压升高,毛细血管楔压随之升高,从而导致肺动脉压升高。因此,左心功能收缩功能不全为主的心力衰竭会导致肺动脉压升高。肺动脉高压可改变右心室结构和功能[16]。右心室首先出现肥厚性改变,随后出现扩张性改变,心室增大[17]。其主要机制是后负荷的不匹配,也包括缺血性改变[18]。与本研究也发现右心室增大。
总结:左心收缩功能不全的心力衰竭常常合并肺动脉高压,男性比例较高,患病率为66.7%,因慢性心衰合并肺动脉高压后可导致心脏结构进一步改变,包括右心室、心衰恶化等心血管事件,而N-proBNP和大内皮素可作为慢性收缩性心衰随后发生肺动脉高压的预测因子,在临床上应重视对该类患者的筛查,做到及早干预,以更好地减少心血管事件的发生。
本研究病例主要来自扩张性心肌病患者,且受病例所限,研究数据只能表现一部分特征,有待前瞻性,随机性的大规模临床研究。
[1]Barst RJ,McGoon M,Torbicki A,et al.Diagnosis and differential assessment of pulmonary arterial hypertension.J Am Coll Cardiol,2004,43:40S-47S.
[2]Khush KK,Tasissa G,Butler J,et al.Effect of pulmonary hypertension on clinical outcomes in advanced heart failure:analysis of the Evaluation Study of Congestive Heart Failure and Pulmonary Artery Catheterization Effectiveness(ESCAPE)database.Am Heart J,2009,157(6):1026-1034.
[3]Lam CS,Roger VL,Rodeheffer RJ,et al.Pulmonary hypertension in heart failure with preserved ejection fraction:a community-based study.J Am Coll Cardiol,2009,53:1119-1126.
[4]Cowie MR,Struthers AD,Wood DA,et al.Value of natriuretic peptides in assessment of patients with possible new heart failure in primary care.Lancet,1997,350:1349-1353.
[5]Souza R,Bogossian HB,Humbert M,et al.N-terminal-pro-brain natriuretic peptide as a haemodynamic marker in idiopathic pulmonary arterial hypertension.Eur Respir J,2005,25(3):509-513.
[6]Cracowski JL,Yaici A,Sitbon O,et al.Biomarkers as prognostic factors in pulmonary arterial hypertension.Rationale and study design.Rev Mal Respir,2004,21(6 Pt 1):1137-1143.
[7]Andreassen AK,Wergeland R,Simonsen S,et al.N-terminal pro-B-type natriuretic peptide as an indicator of disease severity in a heterogeneous group of patients with chronic precapillary pulmonary hypertension.Am J Cardiol,2006,98(4):525-529.
[8]Kiely DG,Cargill RI,Struthers AD,et al.Cardiopulmonary effects of endothelin-1 in man.Cardiovasc Res,1998,39(3):563-570.
[9]Seo B,Oemar BS,Siebenmann R,et al.Both ETA and ETB receptors mediate contraction to endothelin-1 in human blood vessels.Circulation,1994,89(3):1203-1208.
[10]Schmitz-Spanke S,Schipke JD.Potential role of endothelin-1 and endothelin antagonists in cardiovascular diseases.Basic Res Cardiol,2000,95(4):290-298.
[11]陶新曹,倪新海,柳志红,等.大内皮素-1评价特发性肺动脉高压严重程度和预后的研究.中国分子心脏病学杂志,2009,9(1):31-33.
[12]张丽,张春玲,张健,等.血浆大内皮素-1浓度在慢性心力衰竭诊断中的应用.中国分子心脏病学杂志,2007,7(4):228-231.
[13]Barton M,Yanagisawa M.Endothelin:20 years from discovery to therapy.Can J Physiol Pharmacol,2008,86(8):485-498.
[14]McLaughlin VV,Archer SL,Badesch DB,et al.ACCF/AHA 2009 expert consensus document on pulmonary hypertension a report of the American College of Cardiology Foundation Task Force on Expert Consensus Documents and the American Heart Association developed in collaboration with the American College of Chest Physicians;American Thoracic Society,Inc.;and the Pulmonary Hypertension Association.J Am Coll Cardiol,2009,53:1573-1619.
[15]Chemla D,Castelain V,Hervé P,et al.Haemodynamic evaluation of pulmonary hypertension.Eur Respir J,2002,20(5):1314-1331.
[16]Galie N,Manes A,Palazzini,M et al.Pharmacological impact on right ventricular remodelling in pulmonary arterial hypertension.Eur Heart J,2007,9:H68-74.
[17]Dias CA,Assad RS,Caneo LF,et al.Reversible pulmonary trunk banding.Ⅱ:an experimental model for rapid pulmonary ventricular hypertrophy.J Thorac Cardiovasc Surg,2002,124:999-1006.
[18]Abraham WT,Raynolds MV,Gottschall B,et al.Importance of angiotensin-converting enzyme in pulmonary hypertension.Cardiology,1995,86:9-15.
