鸡MyD88、TRIF和TIRAP基因荧光定量PCR检测方法的建立
2011-05-21周作勇王芝英郭智莉周雪梅
周作勇,聂 奎,王芝英,秦 波,郭智莉,周雪梅
(1.西南大学荣昌校区动物医学系,重庆 402460;2.西南大学动物科技学院,重庆 400715;3.西南大学蚕学与系统生物研究所,重庆 400715)
机体天然免疫反应的介导主要通过能够识别病原相关分子模式(PAMPs)的模式识别受体(PRR)来完成,其中Toll样受体(TLRs)为最受人们关注的模式识别受体之一[1]。目前公认的TLR信号转导通路分为MyD88依赖和TRIF依赖(或称为MyD88非依赖)两条不同的信号转导途径,其中My88、包含TIR结构域的IFN诱导连接蛋白(TRIF)和包含Toll/IL-1的接头蛋白(TIRAP)为信号转导途径重要的信号传导蛋白[2]。在信号传导中,大部分的TLR通过MyD88依赖转导信号,然而TLR3和TLR4还存在另外一种TRIF依赖信号途经。此外,TLR2和TLR4不能像其他TLR分子一样直接与MyD88接头,而需要TIRAP共接头分子的参与[1]。MyD88主要通过其死亡结构域(DD)与白介素受体相关激酶(IRAK)家族蛋白分子结合成为信号转导复合物,该复合物继续募集并活化下游肿瘤坏死因子受体相关因子6(TRAF6),然后激活IκB激酶复合物,最终导致NF-κB活化,激活相关促炎因子和I型干扰素的基因表达。而TRIF主要通过募集TRAF3和TRAF6分别通过 TBK1和 TAK1来引起 NF-κB的活化及IRF3和IRF7的核转位,调控炎性因子和I型干扰素的表达[1,3-5]。
与哺乳动物相比,鸡TLR的鉴定较晚,鸡TLR受体信号传导蛋白的研究较少,仅见有部分关于鸡MyD88在雏鸡免疫和感染沙门氏菌TLR信号传导作用的研究报道[6-7]。本实验建立了检测鸡MyD88、TRIF和TIRAP基因表达的实时荧光定量PCR方法,为研究鸡MyD88、TRIF和TIRAP在TLR识别病原后的信号传导机制奠定基础。
1 材料和方法
1.1 试验动物、主要试剂及仪器 1日龄罗曼雏鸡购自内江市种鸡场,饲喂于经严格消毒的鸡笼中,饮水经煮沸消毒,饲喂雏鸡全价饲料。SYBR®Prime Script RT-PCT KitⅡ购自TakaRa公司。Mini Opticon Real Time PCR仪为Bio-Rad公司产品。
1.2 引物设计 参考GenBank登录的鸡MyD88、TRIF、TIRAP和β-actin基因序列,用Primier 5.0和Oligo软件进行分析,进行引物设计(表1)。引物由英潍捷基(上海)贸易有限公司合成。
1.3 RNA的提取和cDNA的合成 无菌采集10日龄雏鸡脾脏,迅速置于液氮冻存。按照RNAisoTMPlus试剂盒说明书进行总RNA提取,反转录合成cDNA。反转录体系如下:5×PrimeScript®Buffer 2 μL,PrimeScript®RT Enzyme MixⅠ0.5 μL,Oligo dT Primer(50 μM)0.5 μL,Random 6 mers(100 μM)0.5 μL,Total RNA 2 μL,RNase Free dH2O 4.5 μL。反转录程序为:37℃15 min,85℃ 5 s,反转录产物置于-20℃保存。

表1 用于扩增鸡MYD88、TRIF和TIRAP基因及内参基因β-actin基因片段的实时荧光定量PCR引物Table 1 Primers used for amplification of chicken MYD88,TRIF,TIRAP and β-actin gene by real-time quantitative PCR
1.4 鸡 MyD88、TRIF、TIRAP和 β-actin基因PCR扩增、克隆及序列测定 25 μL反应体系程序为: 94℃ 5 min;94℃ 30 s、60℃ 30 s(TRIF基因为64℃)、72℃50 s,循环30次;72℃ 5 min。PCR产物经4%琼脂糖凝胶电泳检测,按胶回收试剂盒操作说明回收目的DNA片段。将目的片段DNA与pMD19-T载体连接,转化DH5α感受态细胞,涂布于含Amp+、X-gal和IPTG的LB琼脂平板中,37℃培养14 h~16 h。挑选白色菌落,进行培养,经抽提质粒和PCR鉴定为阳性克隆,由英潍捷基(上海)贸易有限公司测序,用BLASTn软件分析同源性。
1.5 鸡MyD88、TRIF、TIRAP和β-actin基因实时荧光定量PCR扩增 紫外分光光度计检测鸡MyD88、TRIF、TIRAP和β-actin基因PCR产物的浓度,进行10倍梯度稀释作为模板,进行实时荧光定量PCR扩增,建立标准曲线。反应体系为:SYBR®Premix ExTaqTMII(2×)10 μL,上游引物SF(20 μmol/L)0.4 μL,下游引物 SR(20 μmol/L)0.4 μL,ddH2O 7.2 μL,DNA 模板 2 μL。实时荧光定量PCR反应程序为:95℃30 s,95℃ 5 s,60℃(TRIF基因为64℃)30 s,40个循环,最后从65℃至95℃,按0.5℃增值进行溶解曲线分析,判定PCR反应的特异性。根据MyD88、TRIF、TIRAP和β-actin基因扩增标准曲线,分析E values、R2 values和斜率(Slope),判定所建立的实时荧光定量PCR方法的稳定性和可靠性。进一步对PCR产物进行10倍梯度稀释,进行实时荧光定量PCR反应,判定其敏感性。同时,每个基因选择3个稀释度,分别进行3次荧光定量PCR扩增,参考Hellemans等的方法,根据每次PCR反应的Ct值,计算变异系数(CV),判定该方法的重复性[8]。
2 结果与讨论
2.1 鸡MyD88、TRIF、TIRAP和β-actin基因实时荧光定量PCR扩增的特异性 以所提取的鸡脾脏组织总RNA进行反转录和PCR扩增,经4%琼脂糖凝胶电泳检测,MyD88、TRIF、TIRAP和β-actin 4个基因分别在大小约为80 bp、140 bp、170 bp和140 bp处得到单一的扩增条带(图1)。将所扩增的4个基因片段进行克隆测序,结果所克隆的鸡MyD88、TRIF、TIRAP和β-actin基因长度分别为76 bp、139 bp、170 bp和140 bp,核苷酸序列BLAST检索证实为鸡 MyD88、TRIF、TIRAP和β-actin基因。实时荧光定量PCR扩增溶解曲线分析,发现MyD88、TRIF、TIRAP和β-actin的溶解温度分别为75.5℃、86.5℃、89.0℃和83.5℃,4个基因片段的溶解曲线均呈单峰,无其他杂峰。参考Metwally等的方法以不含反转录产物的双蒸水为模板作为阴性对照,分别进行PCR扩增和实时荧光PCR反应,未见任何扩增条带和扩增曲线[9]。目前,用于实时荧光定量PCR检测常见方法有TaqMan荧光探针和SYBR GreenⅠ荧光嵌合法,其中SYBR GreenⅠ荧光嵌合法因避免了设计、标记荧光探针困难和价格昂贵等问题,被许多研究者采用。由于SYBR GreenⅠ可与任何一种双链DNA结合发出荧光,其特异性完全由扩增引物决定[10]。本试验显示,4个基因PCR扩增产物经4%琼脂糖电泳只有相应大小的单一扩增条带,溶解曲线分析发现扩增产物呈特异性较好的单峰,无其他杂峰,测序结果证实为鸡MyD88、TRIF、TIRAP和β-actin基因,表明引物特异性好。
2.2 鸡MyD88、TRIF、TIRAP和β-actin基因扩增效率及相关系数 试验结果显示,鸡MyD88、TRIF、TIRAP和β-actin基因扩增效率、R2values和斜率分别为:MyD88(E=100.4%,R2=0.997,Slope=-3.312),TRIF(E=102%,R2=0.997,Slope=-3.275),TIRAP(E=96.7%,R2=0.998,Slope=-3.404),β-actin(E=98.0%,R2=1.000,Slope=-3.371)。Nolan等认为用于构建实时荧光定量PCR的目标样品可以是线性质粒、PCR扩增产物或者cDNA,一般认为稀释的样本至少应该有6个梯度以上,所建立的DNA模板浓度对数与循环数量之间的标准曲线才可靠[11]。本实验中,建立标准曲线的4个基因PCR产物浓度均在7个稀释梯度以上,其中MyD88基因为5.8×10-4g/mL~5.8×10-10g/mL,TRIF基因为1.7×10-4g/mL~1.7×10-11g/mL,TIRAP基因为 5.3×10-4g/mL~5.3×10-11g/mL,β-actin基因为 4.6×10-4g/mL~4.6×10-10g/mL,符合要求。此外,进行荧光定量PCR检测时,其扩增效率尽可能接近100%[12],基因扩增效率可用公式E=10(-1/slope)-1计算,按照Nolan等的标准,优化的实时荧光定量PCR标准曲线斜率应为-3.2和-3.5之间[11]。根据上述公式,可以计算出实时荧光定量PCR反应的扩增效率在93.1%~105.4%的扩增结果均可靠,且在运用荧光定量PCR方法检测基因表达进行相对定量分析时要求目标基因和内参基因之间的扩增效率相似[13]。本试验结果表明4个基因的扩增效率相似,在96.7%和102%之间,因此,可以用所建立的荧光定量PCR方法进行目标基因表达相对定量研究。此外,R2为荧光定量PCR反应的重现性指标,一般认为R2>0.98,则所建立的荧光定量反应更可靠和更稳定[10],本实验的4个基因荧光定量PCR反应相关系数均在0.99以上,说明所建立的检测,鸡MyD88、TRIF和TIRAP基因的荧光定量PCR方法稳定可靠。

2.3 鸡MyD88、TRIF、TIRAP和β-actin基因扩增的敏感性和重复性 本试验对鸡MyD88、TRIF、TIRAP和β-actin基因PCR产物分别稀释至5.8×10-13g/mL、1.7×10-13g/mL、5.3×10-13g/mL和 4.6×10-13g/mL,利用所建立的荧光定量PCR方法检测,仍然获得较好的扩增曲线,表明建立的检测鸡MyD88、TRIF、TIRAP实时荧光定量PCR方法敏感性高。分别对每个基因PCR产物选择3个稀释度,每个稀释度进行3次荧光定量PCR扩增。结果在PCR产物浓度为5.8×10-10g/mL时,MyD88基因实时荧光定量PCR扩增Ct值变异系数最高,为1.46,而β-actin基因在PCR产物浓度为4.6×10-8g/mL时,其Ct值变异系数最低,仅为0.61(表2)。据Pfaffl等报道,当荧光定量PCR扩增Ct值变异系数小于2.5%时,则实时荧光定量PCR反应的重复性高[12],而本试验所建立的鸡MyD88、TRIF、TIRAP和β-actin基因荧光定量PCR反应Ct值变异系数小于1.5%,表明所建立的检测鸡MyD88、TRIF和TIRAP基因的荧光定量PCR方法重复性高。
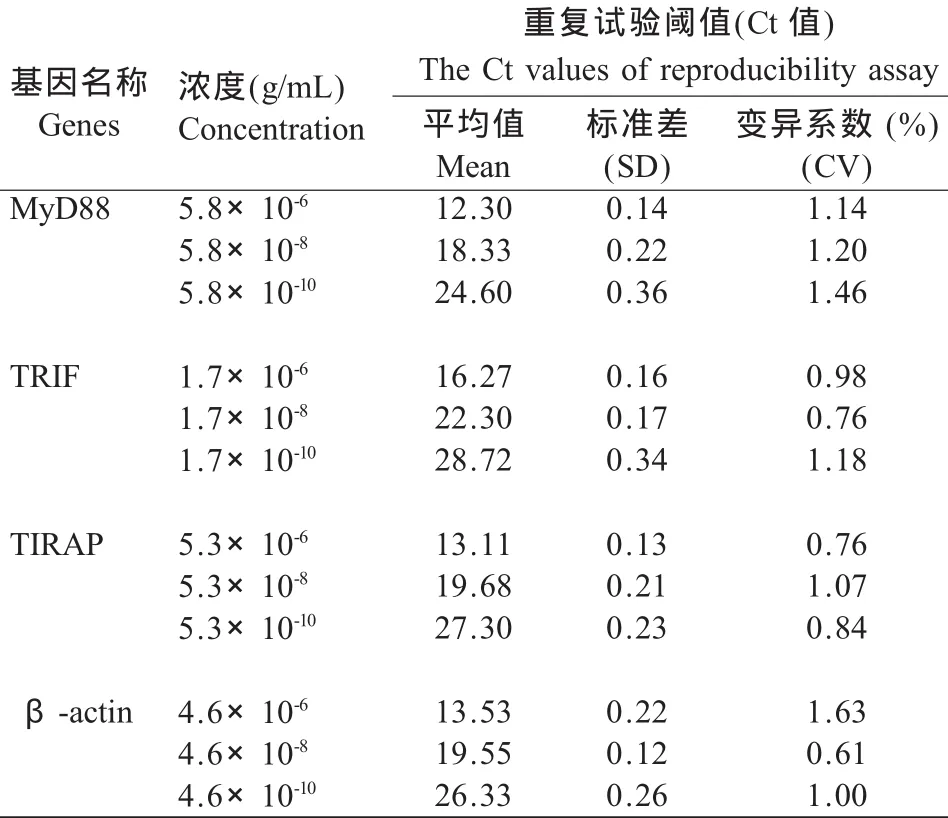
表2 鸡MyD88、TRIF、TIRAP和β-actin基因实时荧光定量PCR扩增的重复性分析Table 2 Reproducibility assay of chicken MYD88,TRIF,TIRAP and β-actin gene amplification by real-time quantitative PCR
综上分析,本实验建立的以β-actin基因为内参,检测鸡MyD88、TRIF和TIRAP基因的实时荧光定量PCR方法,特异性强、敏感性和重复性高,为研究鸡MyD88、TRIF和TIRAP在TLR识别病原后的信号传导机制奠定了基础。
[1]Chang M,Jin W,Sun S C.Peli1 facilitates TRIF-dependent Toll-like receptor signaling and proinflammatory cytokine production[J].Nat Immunol,2009,10(10):1089-1095.
[2]O'Neill L A,Fitzgerald K A,Bowie A G.The Toll-IL-1 receptor adaptor family grows to five members[J].Trends in immunol,2003,24(6):286-289.
[3]Yamamoto M,Akira S.Mechanisms of innate immune response mediated by Toll-like receptors[J].Applied Immunol Rev,2005,5:167-183.
[4]Kawai T,Akira S.TLR signaling[J].Semin Immunol,2007,19(1):24-32.
[5]Kumar H,Kawai T,Akira S.Toll-like receptors and innate immunity[J].Biochem Biophys Res Commun,2009,388(4):621-625.
[6]Qiu Y,Shen Y,Li X,et al.Molecular cloning and functional characterization of a novel isoform of chicken myeloid differentiation factor 88(MyD88)[J].Dev Comp Immunol,2008,32(12):1522-1530.
[7]Li P,Xia P,Wen J,et al.Up-regulation of the MyD88-dependent pathway of TLR signaling in spleen and caecum of young chickens infected withSalmonellaserovar Pullorum[J].Vet Microbiol,2010,143:346-351.
[8]Hellemans J,Mortier G,De Paepe A,et al.qBase relative quantification framework and software for management and automated analysis of real-time quantitative PCR data[J].Genome Biol,2007,8(2):19-24.
[9]Metwally L,Fairley D J,Coyle P V,et al.Improving molecular detection of Candida DNA in whole blood:comparison of seven fungal DNA extraction protocols using real-time PCR[J].J Med Microbio,2008,57:296-303.
[10]Wong M L,Medrano J F.Real-time PCR for mRNA quantitation[J].Biological Techniques,2005,39:75-85.
[11]Nolan T,Hands R E,Bustin S A.Quantification of mRNA using real-time RT-PCR[J].Nat Protoc,2006,1(3):1559-1582.
[12]Pfaffl M W.A new mathematical model for relative quantification in real-time RT-PCR[J].Nucleic Acid Res,2001,29(9):2002-2007.
