靶向pol基因siRNA抑制J亚型禽白血病病毒复制的研究
2011-05-21张在平马学恩杨海彦孟庆文
张在平,马学恩,杨海彦,田 进,孟庆文*
(1.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江 哈尔滨 150001;2.内蒙古农业大学动物科学与医学学院,内蒙古 呼和浩特 010018)
J亚群禽白血病病毒(Avian leukosis virus subgroup J,ALV-J)是引起禽类以免疫抑制、生长抑制和髓细胞癌变为特征的传染性、致骨髓细胞瘤疾病或成髓性白血病[1]。目前,ALV-J在我国鸡群中已广泛存在。ALV-J除可以导致禽骨髓细胞瘤(ML)、引起感染鸡群死亡外,还引起免疫抑制,这也是绝大数感染鸡群的主要表现形式。ALV-J的感染造成鸡群的生产性能降低,对疫苗的免疫应答水平降低,导致继发感染其它疾病,造成更严重的经济损失。本研究设计并合成靶向ALVpol基因的RNA干扰(RNAi)序列,构建siRNA真核表达重组质粒,为应用靶向pol基因RNAi抵抗ALV复制的研究奠定基础。
1 材料和方法
1.1 病毒株与细胞系 ALV-J山东分离株(SD株)由哈尔滨兽医研究所国家重点实验室保存;DF-1细胞系由哈尔滨兽医研究所步志高研究员提供[2]。
1.2 主要试剂 线性化pcDNA6.2-GW/EmGFP-miR真核表达载体、E.coliTop10、Lipofectamine 2000购自Invitrogen公司;连接酶、反转录酶购自TaKaRa公司;荧光定量PCR试剂盒购自杭州博日公司;质粒提取试剂盒、病毒RNA提取剂盒均购自上海华舜生物技术有限公司;抗ALV-J单克隆抗体(MAb)JE9由扬州大学秦爱建教授惠赠[3];鼠抗鸡GAPDH MAb、FITC标记的山羊抗小鼠IgG、罗丹明标记的山羊抗小鼠IgG/TRITC和辣根过氧化物酶(HRP)标记的山羊抗小鼠IgG均购自中杉金桥公司。
1.3 靶向pol基因siRNA重组质粒的构建与鉴定根据pol基因高度保守序列设计5对shRNA(表1),由上海生工生物工程技术服务有限公司合成。将互补单链95℃变性5 min,室温退火后,连接于线性化pcDNA6.2-GW/EmGFP-miR载体中,并转化至E.coliTop 10中,在壮观霉素(50 μg/mL)抗性的LB平板上37℃培养过夜,挑取单菌落,根据试剂盒提供的载体测序引物进行菌落PCR鉴定,鉴定正确的重组质粒由北京华大基因公司测序。将重组质粒分别命名为pcDNA-sh-pol711、pcDNA-sh-pol814、pcDNA-sh-pol1016、pcDNA-sh-pol1915和 pcDNA-shpol2516。
1.4 间接免疫荧光法(IFA)对ALV-J滴度的测定将ALV-J SD株接种于DF-1单层细胞,利用IFA方法检测病毒滴度,在荧光显微镜下计数荧光细胞孔数,采用Reed-Muench法计算TCID50值。
1.5 重组质粒的转染及ALV-J接种试验 将5种重组质粒分别转染DF-1单层细胞,12 h后根据绿色荧光蛋白表达情况判断转染效率。转染的DF-1细胞按100 TCID50病毒滴度接种ALV-J。病毒感染72 h后采用IFA、western blot和real-time PCR方法分别检测病毒抑制效果。

表1 shRNA寡核苷酸序列Table 1 shRNA oligonucleotide sequence
1.6 IFA检测囊膜蛋白的表达水平 将5种重组质粒分别转染DF-1细胞后接种SD株,72 h后以ALV-J MAb为一抗,以罗丹明标记的山羊抗小鼠IgG/TRITC进行IFA检测,荧光显微镜观察并拍照。
1.7 Western blot检测病毒囊膜蛋白表达水平 收集转染72 h的细胞,提取总蛋白并定量。分别以抗ALV-J MAb和鼠抗鸡GAPDH MAb为一抗,以HRP标记的山羊抗小鼠IgG为二抗,进行western blot检测。凝胶成像系统Alphalmager HP扫描。
1.8 Real-time PCR检测polmRNA表达水平 根据GenBank中登录的ALVpol基因序列(AB178529.1),在其保守区域设计并合成引物,P1:5'-CTAACGA GGCGAGGGAATG-3'、P2: 5'-TTGGTGGGTTGGGT GGAGA-3',预期扩增片段为 214 bp。根据已知β-actin基因序列(NM-205518.1)设计合成引物:5'-CAGAGCAAGAGGGGCATC-3'和5'-AGGTAGTC GGTCAGGTCC-3',扩增长度为392 bp。采用 realtime PCR检测各组β-actin与目的基因的表达水平,通过两者的比值计算目的基因相对表达量。
1.9 统计学分析 结果以平均数和标准差(X±SD)表示,采用SPSS 13.0统计学软件进行t检验,p<0.05为有统计学意义,差异显著。
2 结果
2.1 shRNA重组质粒的鉴定 将合成的5种shRNA与载体连接,经特异性引物鉴定,得到约300 bp的条带,与预期大小相符(图1),测序结果也表明碱基序列完全正确。
2.2 IFA对ALV-J病毒滴度测定结果 将SD株接种DF-1细胞,利用IFA方法检测病毒滴度,通过Reed-Muench法计算病毒毒价为106.2TCID50/mL。
2.3 IFA对ALV-J囊膜蛋白表达水平的检测 将重组质粒分别转染DF-1细胞后接种SD株,应用IFA检测囊膜蛋白的表达,结果显示:重组质粒pcDNA-sh-pol711、pcDNA-sh-pol814和 pcDNA-sh-pol2516组能够使荧光强度明显减弱,而其余组与阴性对照和空白对照相比无明显差异(图2)。


2.4 Western blot检测 应用western blot方法分析ALV-J囊膜糖蛋白的表达情况,结果表明:pcDNA-sh-pol711、pcDNA-sh-pol814和 pcDNA-sh-pol2516转染组的囊膜糖蛋白表达水平均明显下降,而pcDNA-sh-pol1016、pcDNA-sh-pol1915、阴性及空载体对照转染组之间囊膜糖蛋白表达水平无明显变化(图3)。
2.5 Real-time PCR检测 pol基因的real-time PCR结果显示:pcDNA-sh-pol2516与pcDNA-sh-pol814重组表达质粒polmRNA表达水平和阴性对照组、空载体对照组之间相比差异显著(p<0.05),而pcDNA-sh-pol1016、pcDNA-sh-pol1915和 pcDNA-sh-pol711组polmRNA表达水平与阴性对照组、空载体对照组之间相比无明显差异。其中pcDNA-sh-pol 2516组的polmRNA表达水平最低(表2)。
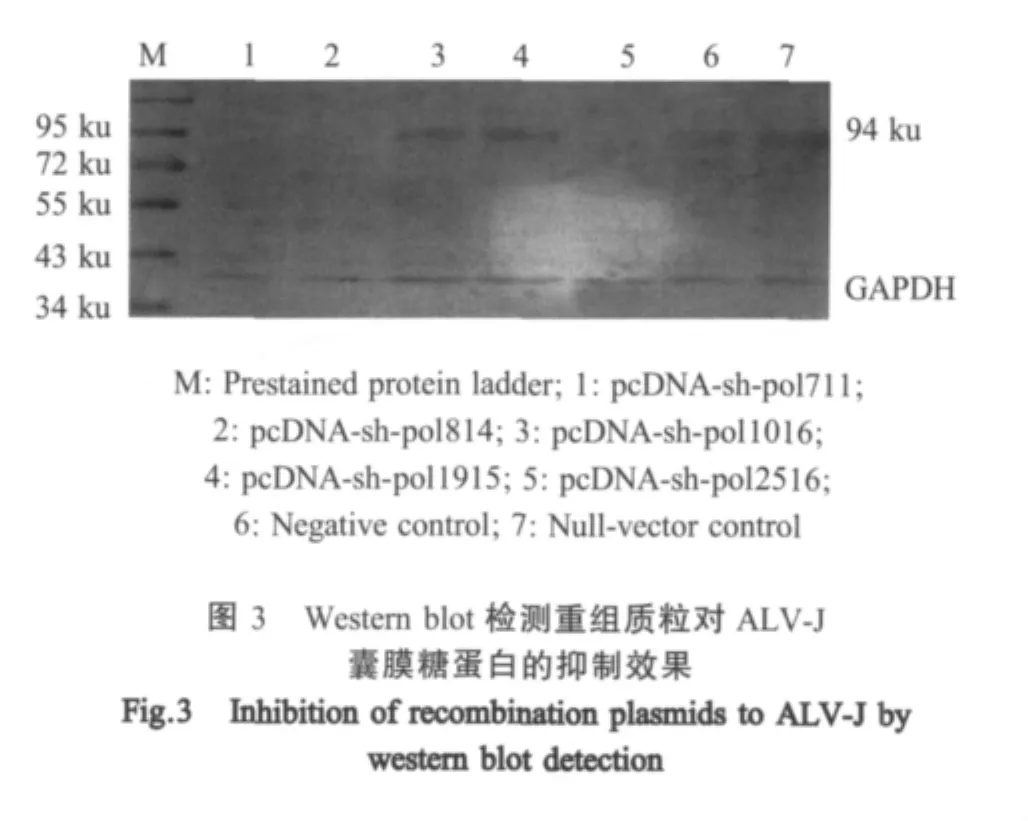

表2 试验组pol基因mRNA的表达量Table 2 Detection ofpolmRNA expression in each group by Real-time PCR
3 讨 论
目前,RNAi技术的研究热点是抗病毒治疗,获得对病毒具有高效抑制能力和特异性好的siRNA是进行相关治疗方法研究的基础。以RNAi抑制病毒复制的方法已获得应用,例如人类免疫缺陷性病毒、丙型肝炎病毒、乙型肝炎病毒、疱疹病毒、脊髓灰质炎病毒、流感病毒以及冠状病毒呼吸综合征等[4-10]。
国内外已有利用RNAi抑制ALV-J复制的报道,Mo等利用逆转录病毒载体介导的靶向B亚群ALV-Jenv基因及其受体tvb基因的siRNA成功的抑制ALV(B)的复制[11];孟祥凯构建了靶向 ALV-J gp37基因的siRNA表达重组质粒,转染48 h后观察到报告基因GFP荧光减弱,初步证实构建的表达重组质粒有抑制ALV-J复制的作用[12]。
本研究以ALV-Jpol基因为靶向基因,利用RNAi方法抑制其表达,筛选出有效抑制ALV-J复制的靶位点。本研究首次构建了靶向ALV-Jpol基因的siRNA重组表达重组质粒,在细胞水平上评价其对ALV-J复制的抑制效果,其中3个重组质粒能够使pol基因的mRNA及囊膜糖蛋白表达水平降低,表明本研究构建的重组质粒在细胞水平上有干扰ALV-J复制的作用,为筛选抗禽白血病的抗病基因以及抗病育种奠定基础。
[1]Lin Maw-yeong,Liu Hang-jen.Serological survey on the prevalence of avian leukosis in chickens in Taiwan by enzymelinked immunosorbent assay[J].Chi Sci Vet Sci,2000,26:161-166.
[2]Himly M,Foster D N,Bottoli I,et al.The DF1 chicken fibroblast cell liner:transformation induced by diverse oncogene and cell death resulting from infection by avian leukosis viruses[J].Virology,1998,248(2):295-304.
[3]Qin Ai-jian,Lee L F,Fadly A M.Development and characterization of monoclonal antibodies to subgroup J avian leukosis virus[J].Avian Dis,2001,45:938-945.
[4]Jacque J M,Triques K.Modulation of HIV-1 replication by RNA interference[J].Nature,2002,418(6896):435-438.
[5]Yokota T,Sakamoto N,Enomoto N,et al.Inhibition of intracellular hepatitis C virus replication by synthetic and vector-derived small interfering RNAs[J].EMBO Rep,2003,4(6):602-608.
[6]Chen Ying,Du Dan,Wu Jun,et al.Inhibition of hepatitis B virus replication by stably expressed shRNA[J].Biochem Biophys Res Commun,2003,311(2):398-404.
[7]Bhuyar P K,Kariko K,Capodici J,et al.Short interfering RNA-mediated inhibition of herpes simplex virus type 1 gene expression and function during infection of human keratinocytes[J].J Virol,2004,78(19):10276-10281.
[8]Gitlin L,Karelsky S,Andino R.Short interfering RNA confers intracellular antiviral immunity in human cell[J].Nature,2002418(6896):430-434.
[9]刘丹,亓文宝,孟庆文,等.靶向PB2基因的特异性siRNA抑制禽流感病毒(AIV)复制[J].中国预防兽医学报,2008,04(30):245-249.
[10]Wang Zhi,Ren Li-li,Zhao Xing-gang,et al.Inhibition of severe acute respiratory syndrome virus replication by small interfering RNAs in mammalian cells[J].J Virol,2004,78(14):7523-7527.
[11]Mo Chen,Adam J G,Matthew W,et al.Inhibition of avian leukosis virus replication by vector-based RNA interference[J].Virology,2007,365:464-472.
[12]孟祥凯.J亚群禽白血病病毒gp37基因siRNA表达载体的构建及体外干扰效应的初步研究[D].2008,山东农业大学,硕士学位论文.
