丹参酮ⅡA对乳腺癌细胞株MDA-MB-231体外血管生成拟态的抑制作用
2011-05-17徐长亮何赟绵
高 丽,徐长亮,何赟绵,奚 涛
中国药科大学生命科学与技术学院,江苏省肿瘤发生与干预重点实验室,南京 210009
血管生成拟态 (vasculogenic mimicry,VM)是1999年由Maniotis AJ等发现的一种存在于恶性肿瘤中的独特的血液供应方式,即由侵袭性肿瘤细胞相互连接、以细胞外基质分隔而成,可输送血液的管道结构[1]。肿瘤的这种生物学特性有利于肿瘤细胞的快速生长和转移。近几年研究发现丹参酮ⅡA(Tan IIA)对多种肿瘤细胞具有杀伤、诱导分化和凋亡等作用。为进一步研究丹参酮ⅡA的抗癌作用,我们研究了其对MDA-MB-231细胞增殖及体外VM的影响,并分析了可能的作用机制。
1 材 料
丹参酮ⅡA(南京泽朗医药科技有限公司,纯度>99%);人乳腺癌细胞株MDA-MB-231由中国药科大学郭青龙教授惠赠;胎牛血清、Leibovitz L-15培养液(Gibico 公司);胰蛋白酶(Sigma 公司);人工基质Matrigel(BD公司);鼠抗人血管内皮细胞生长因子(VEGF)抗体(美国 Santa cruz抗体公司);HRP 标记山羊抗鼠IgG(北京中杉金桥生物技术有限公司)。
2 方法与结果
2.1 细胞培养
肿瘤细胞用含10%胎牛血清及100 kU·L-1青霉素和100 mg·L-1链霉素的L-15培养液,在无CO2、37℃培养箱中培养。
2.2 MTT法测定Tan IIA对MDA-MB-231细胞增殖能力的影响
将细胞以每孔7.5×103个细胞接种于96孔培养板,待细胞培养24 h证实贴壁后去掉培养基,加入不同浓度的 Tan IIA (0、4、8、12、16、20、40、80、120 μmol·L-1),阴性孔加入含0.3%DMSO的无血清培养基作为溶剂对照,每孔200μL,细胞培养48h后吸去培养基,每孔加入 5mg·mL-1MTT20μL,孵育 4 h。 弃上清液,每孔加入DMSO 150 μL,酶标仪测定570 nm处的吸收值(A值,以630 nm为参比波长),计算细胞生长抑制率。每个剂量浓度设3个平行孔,重复试验3次。
MDA-MB-231作用48 h时,各剂量组A值均小于细胞对照组,抑制率分别为3.79%、15.9%、22.4%、40.6%、54.6% 、84.2%、92%、94.4%,均有显著差异(P<0.01),且其效应呈质量浓度依赖性(见图1)。表明丹参酮ⅡA对MDA-MB-231细胞增殖具有较强的抑制作用。

图1 丹参酮ⅡA对MDA-MB-231细胞增殖的抑制作用
2.3 管道形成实验
于96孔板中每孔加50 μL预先于4℃过夜的Matrigel,在 37℃条件下温育 30 min使 Matrigel凝固,分别将含不同浓度的 Tan IIA(0、2.5、5、10 μmol·L-1)的无血清培养基和无血清饥饿12 h的MDAMB-231细胞(2.5×104cell/孔)混匀后加入培养板,每组3孔,每孔200 μL。培养7 h后,拍照并观察小管形成情况。
在Matrigel上,MDA-MB-231能模拟血管内皮细胞样的特性,细胞之间互相连接,约12h后呈单个环状或多个环相连的网格状。对照组、丹参酮ⅡA组细胞于体外均可以形成管道状结构,但对照组所形成的管道结构排列较丹参酮ⅡA组整齐,且较多而完整(见图2)。于显微镜下观察,对照组平均每视野管状结构数量显著高于丹参酮ⅡA组。

图2 丹参酮ⅡA对MDA-MB-231拟血管形成的作用
2.4 半定量RT-PCR检测血管生成拟态相关基因mRNA的表达及灰度分析
各组细胞用TRIzol一步法提取细胞总RNA,按RNA逆转录试剂盒行逆转录合成cDNA。VEGF上游引物 5′-ACCCATGGCAGAAGGAGG-3′,下游引物 5′-CTTACCGCCTCGGCTT-3′,该对引物能扩增出VEGF121、VEGF165两个产物。内参GAPDH:上游引物 5′-AAGGTCGGAGTCACCGGATT-3′, 下游引物 5′-CTGGAAGATGGTGATGGGATT-3′。PCR 程序为:94℃ 5 min→(94℃ 30 s→60℃ 40 s→72℃ 40 s)×28 cycles→72℃ 10 min→4℃。扩增结束后取PCR产物上样,1%琼脂糖凝胶电泳,EB染色,凝胶成像系统摄片。Quantity One软件对凝胶电泳条带和感光胶片条带进行灰度值分析,以目的条带与内参照条带的比值代表目的基因mRNA和蛋白的表达水平。
GAPDH作为内参以保证在相等的mRNA含量下进行比较。灰度相对值=(VEGF121灰度值+VEGF165灰度值)/GAPDH灰度值。如图3所示,灰度相对值分别为 0.502±0.022、0.414±0.015(P<0.01)、0.361±0.020(P<0.01)。 与对照组相比,丹参酮ⅡA 组细胞VEGF mRNA表达量降低,且具有显著性差异。
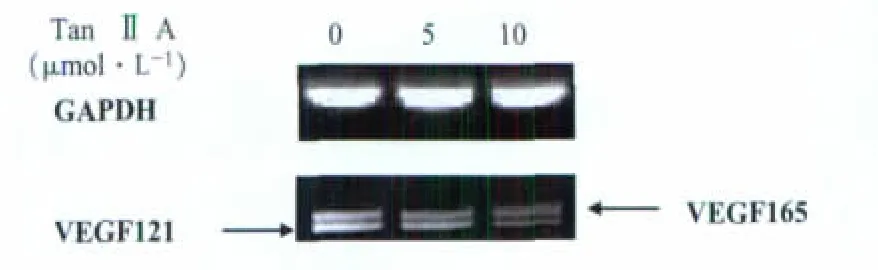
图3 丹参酮ⅡA对MDA-MB-231细胞内VEGF121、VEGF165 mRNA表达的影响
2.5 Western blot检测VEGF蛋白的表达
冷PBS洗细胞2次,加蛋白裂解液制备总蛋白,超声破碎后 12000 r·min-1,离心 10 min,取上清,采用BCA法定量蛋白浓度。取总蛋白100 μg于100℃加热变性5 min后上样,行稳压SDS-PAGE电泳,稳流半干电转至PVDF膜,50 g·L-1脱脂奶粉室温封闭1 h后 TBST漂洗 5×10 min,加入适当浓度一抗(VEGF 1∶400、β-action 1∶500)4℃孵 育 过 夜 。 次 日TBST漂洗5×10 min后再加HRP标记的二抗(羊抗鼠1∶5000)室温孵育 1h,TBST 漂洗 5×10min。 ECL 化学发光法显影。所有数据均在SAS 9.1.3软件下分析,以±s表示,分别采用单因素及多因素方差分析,P<0.05认为有统计学意义。
Western blot结果如表1所示,丹参酮ⅡA对MDA-MB-231细胞内VEGF蛋白表达的影响与对mRNA表达的影响一致。当丹参酮ⅡA的浓度达到5 μmol·L-1,与对照组的差异具有显著性(P< 0.01)。
3 讨 论
肿瘤的生长和转移与新生血管形成密切相关,在恶性度较高的肿瘤中,为了满足肿瘤细胞快速生长的需要,肿瘤细胞通过自身的变形与细胞外基质相互作用模仿血管壁结构(血管生成拟态),形成可输送血液的管道系统,并与宿主血管相连,使肿瘤获得足够的血液供应[2]。故VM可能是多种恶性肿瘤为适应环境而产生的一种新的血液供应模式。肿瘤组织内早期血供主要来自VM,随着体积增大,在VM和以内皮细胞构成的血管之间出现马赛克血管,前两者逐渐被内皮细胞构成的血管替代,并成为肿瘤血供的主要方式[3]。因此,在肿瘤早期最大限度地抑制VM,可以更好地为抑制肿瘤血供创造条件。
研究认为肿瘤细胞形成血管拟态的机制与内皮 相 关 基 因 Tie-1、 Tie-2、VE-cadherin、EphA2、Laminin5-T2、MMPs、VEGF-C、LYVEl、TF、NOTCH[4]和Mig-7[5]等蛋白的生物活性有关。其中VEGF及其受体是刺激肿瘤血管生成的最强的细胞因子。大量临床研究显示VEGF的高表达与肿瘤微血管密度、恶性程度、患者预后不良密切相关[6]。朱芳等[7]通过观察多种肿瘤细胞形成血管生成拟态现象的能力,发现VEGF表达量低的细胞不能形成血管拟态,VEGF表达量高的细胞虽不一定能形成血管拟态,而能形成血管拟态的细胞内VEGF表达都较高。因此,只有VEGF表达高的细胞才有形成血管拟态的潜能。MDA-MB-231细胞为内腔间质细胞样恶性癌细胞,生长速度较快,具有很高的侵袭性,为VEGF高表达细胞。它们在Matrigel的体外培养中,能形成大的星状突出结构[8-9]。

表1 Western-blot结果分析
丹参酮ⅡA是丹参发挥药效的重要活性成分。研究发现,丹参酮ⅡA对乳腺癌细胞的生长抑制作用与其调控细胞周期和细胞凋亡相关基因表达及其信号转导途径相关[10]。我们发现MDA-MB-231细胞在体外能够形成管状结构,丹参酮ⅡA对该细胞的增殖有明显抑制作用,且抑制其体外管状结构的形成。随后为初步探讨其作用机制,我们检测了丹参酮ⅡA对该细胞内VEGF mRNA和蛋白表达的影响。结果显示,丹参酮ⅡA能显著抑制MDA-MB-231细胞中VEGF的表达,推测丹参酮ⅡA可能通过抑制VEGF信号通路来抑制VM形成。该研究对丹参酮ⅡA应用于抗肿瘤治疗提供了新的理论依据。
[1] Maniotis AJ,Folberg R,Hess A, et al.Vascular channel formation by human melanoma cells in vivo and in vitro:vasculogenic mimicry[J].Am J Pathol,1999,155(3):739-52.
[2] Folberg R,Maniotis AJ.Vasculogenic mimicry[J].APMIS,2004,112(7-8):508-25.
[3] Zhang S,Guo H,Zhang D,et al.Microcirculation patterns in different stages of melanoma growth[J].Oncol Rep,2006,15(1):15-20.
[4] 雷志敏,赵怡芳,尚政军.肿瘤血管形成方式及其分子机制[J]. 国际口腔医学杂志,2006,33(6):466-8.
[5] Petty AP,Garman KL,Winn VD.Over expression of carcinonla and embryonic eytotrophoblast cell specific Mig-7 induces invasion and vessel-like structure formation[J].Am J Pathol,2007,170(5):1763-80.
[6] Manders P,Beex LV,Tjan-Heijnen VC.Vascular endothelial growth factor is associated with the efficacy of endocrine therapy in patientswith advanced breast carcinoma[J].Cancer,2003,98(10):2125-32.
[7] 朱 芳,李振宇,任精华.VEGF与肿瘤血管生成拟态关系的研究[J]. 临床肿瘤学杂志,2009,14(1):20-4.
[8] Basu GD,Pathangey LB,Tinder TL et al.Mechanisms underlying the growth inhibitory effects of the cyclooxygenase-2 inhibitor celecoxib in human breast cancer cells[J].Breast Cancer Res,2005,7(4):422-35.
[9] Lacroix M,Leclercq G.Relevance of breast cancer cell lines as models for breast tumours:an update[J].Breast Cancer Res Treat,2004,83(3):249-89.
[10] Wang XJ,Wei UQ,Yu SL.Potential anticancer activity of tanshinoneⅡA against human breast cancer[J].Int J Cancer,2005,116(5):799-807.
