氯丙嗪协同榄香烯对Hep-2细胞增殖的抑制作用
2011-04-01夏轶男于广池吉林大学第二医院吉林长春3004
夏轶男 刘 敩 蔡 郁 于广池 (吉林大学第二医院,吉林 长春 3004)
化疗增敏剂通过逆转肿瘤组织耐药,干扰肿瘤细胞与组织微环境间耐药信号传导等提高化疗效果。近年来,国内外学者应用辛可宁、瑞米酚、酚塞嗪等药物作为化疗增敏剂,联合化疗药物应用,提高临床治疗效果〔1,2〕。本研究观察盐酸氯丙嗪联合榄香烯制剂对人喉癌细胞株Hep-2细胞的增殖抑制率、细胞周期进程和凋亡率的影响,为喉癌化疗增敏剂的应用提供理论依据。
1 材料与方法
1.1 细胞株与试剂 Hep-2细胞株由吉林省肿瘤研究所惠赠,榄香烯乳注射液(大连金港制药有限公司生产);噻唑蓝(MTT)试剂,RPMⅠ1640培养基(Sigma公司);胎牛血清(长春生物制品研究所)。
1.2 方法
1.2.1 MTT比色法 单纯榄香烯组取对数生长期的Hep-2细胞,调细胞数为2×105/ml,接种于96孔塑料培养板内,每孔100 μl,静止培养 12 h后每孔内分别加入25、50、100 μg/ml榄香烯制剂,每个浓度10复孔,静止培养24 h,于结束前6 h,每孔内分别加入MTT试剂20μl/孔,终浓度为50 mg/L,继续培养6 h后,吸弃上清,加入二甲基亚砜150μl/孔,振荡10 min,使MTT还原产物完全溶解,于酶标仪570 nm处测量各孔吸光度A值,按下列公式计算不同浓度榄香烯制剂对Hep-2细胞增殖抑制率的影响。
Hep-2细胞抑制率=(1-加药孔细胞A值÷对照孔细胞A值)×100%
1.2.2 联合组 根据预实验结果,取榄香烯50μg/ml加入盐酸氯丙嗪4 mg/ml,实验条件同1.2.1。
1.2.3 流式细胞仪检测细胞周期进程及凋亡率 细胞培养及分组同1.2.1,不同之处是将96孔塑料培养板改为25 ml培养瓶,培养结束后,分别收集经不同条件作用后的Hep-2细胞,磷酸盐缓冲液(PBS)洗2次,离心弃上清,细胞经70%冷乙醇固定,4℃保存,上机前过40目网,调细胞数为1×106/ml,碘化丙啶(PⅠ)染色,流式细胞仪检测。
1.3 统计学方法 应用SPSS11.0软件,计量数据以±s表示,细胞增殖抑制率组间比较采用t检验,细胞周期组间比较采用F检验。
2 结果
2.1 Hep-2细胞增殖抑制率 MTT结果显示单纯榄香烯组(25 μg/ml、50 μg/ml、100 μg/ml)Hep-2 细胞增殖抑制率分别为14.0%、23.9%和28.6%,与对照组相比差异显著;而联合组,即50μg/ml榄香烯与4 mg/ml氯丙嗪组对Hep-2细胞增殖抑制率为39.2%,抑制效果优于100μl/ml榄香烯组,具有良好的增敏作用。
2.2 Hep-2细胞周期进程及凋亡率 流式细胞仪结果显示单纯榄香烯组随着榄香烯浓度的增加,G0/G1期细胞增多,S期细胞减少,而G2/M期细胞相对增多,细胞凋亡率升高;而联合组即50μg/ml榄香烯与4 mg/ml氯丙嗪组效果更为明显。见表1,表 2。
表1 不同浓度榄香烯制剂对Hep-2细胞周期进程及凋亡的影响(±s,%/24 h)
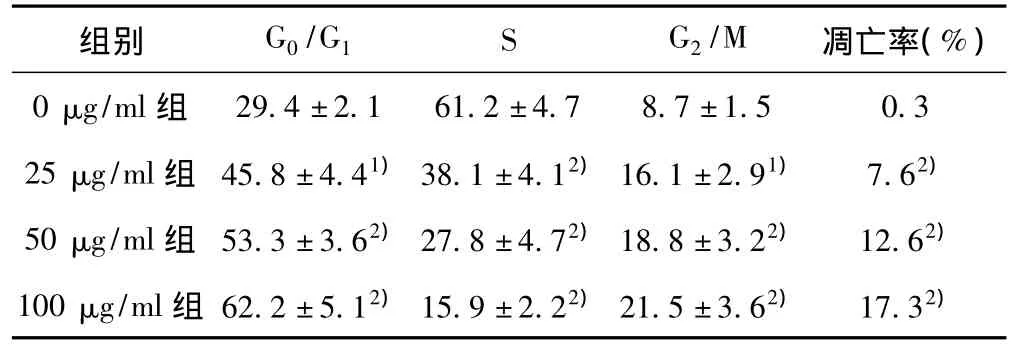
表1 不同浓度榄香烯制剂对Hep-2细胞周期进程及凋亡的影响(±s,%/24 h)
与0μg/ml组比较:1)P<0.05,2)P<0.01
组别 G0/G1 S G2/M 凋亡率(%)0 μg/ml组29.4±2.1 61.2±4.7 8.7±1.5 0.3 25μg/ml组 45.8±4.41)38.1±4.12)16.1±2.91) 7.62)50μg/ml组 53.3±3.62)27.8±4.72)18.8±3.22) 12.62)100μg/ml组 62.2±5.12)15.9±2.22)21.5±3.62) 17.32)
表2 单纯榄香烯组与联合组对Hep-2细胞周期进程及细胞凋亡率的影响(±s,%/24 h)

表2 单纯榄香烯组与联合组对Hep-2细胞周期进程及细胞凋亡率的影响(±s,%/24 h)
与榄香烯组比较:1)P<0.05,2)P<0.01
组别 G0/G1 S G2/M 凋亡率(%)榄香烯组53.3±3.6 27.8±4.7 18.8±3.2 12.6联合组 68.6±5.41) 9.5±2.12) 21.5±2.61) 17.32)
3 讨论
化疗增敏剂是指没有抗肿瘤作用,但能提高已知有抗肿瘤作用药物的化疗效果,增强抗肿瘤药物对肿瘤细胞的杀伤或降低其对正常组织细胞毒性的一类药物〔3〕。本研究应用MTT比色法观察榄香烯联合氯丙嗪对Hep-2细胞的增殖抑制作用。榄香烯是国家二类非细胞毒性抗肿瘤新药,动物实验及临床证明对多种肿瘤细胞有明显的抑制作用〔4〕;且毒副作用小,抗肿瘤谱广,价格低廉,具有广阔应用前景。氯丙嗪属于酚噻嗪类化合物,是钙调蛋白抑制剂,与化疗药物合用后显著改变化疗药物的药代动力学机制〔5〕。MTT结果显示,不同浓度的榄香烯制剂对Hep-2细胞增殖抑制率均有影响,与对照组相比差异显著,尤其在50μg/ml榄香烯组增加4 mg/ml盐酸氯丙嗪后,极大提高了对Hep-2细胞的增殖抑制效果,抑制率由23.9%升高至39.2%。因为MTT试剂可被哺乳动物活细胞线粒体中的脱氢酶还原成蓝色的甲臜颗粒,且甲臜生成的量与活细胞数目及细胞活化状态呈线性关系。所以,该方法被广泛用于抗肿瘤药物的筛选和细胞毒性实验研究的客观指标。
本研究还应用流式细胞仪检测不同浓度的榄香烯对Hep-2细胞周期进程的影响,结果表明,榄香烯能够抑制Hep-2细胞G1期向S期细胞转化进程,从而使G1期细胞增多,S期细胞减少,造成G2/M期细胞相对增多,而G2/M期细胞增多是细胞损伤的普遍反应,这一点从细胞凋亡率上得到体现。G1期细胞是指细胞从有丝分裂到DNA复制之前,G1期是制造和产生mRNA、rRNA、tRNA及核蛋白体的阶段,而且G1期也是药物作用的敏感点〔6〕。因此,抑制G1期的RNA合成,可间接地使肿瘤细胞合成减少。本实验结果显示,榄香烯联合氯丙嗪能显著抑制G1期向S期转化,造成G1期细胞堆积,不能进入S期,从而使细胞增殖变缓,达到抑制肿瘤增殖的目的。
1 王 涛,徐 军,钟南山.肺癌多药耐药生物逆转策略〔J〕.国外医学:肿瘤学分册,2002;29(5):378-80.
2 Sehn LZ,Hua YB,Yu XM,et al.Tamoxifen can reverse multidrug resistance of colorectal carcinoma in vivo〔J〕.World J Gastroenterol,2005;11(7):1060-4.
3 张志红,宋朝晖.肿瘤化疗增敏剂研究进展〔J〕.国际肿瘤学杂志,2006;33(7):506-8.
4 周洪语,侯菊生,王 勇,等.榄香烯诱导神经胶质瘤细胞凋亡的剂量和时间依赖性研究〔J〕.中华肿瘤杂志,2006;28(4):270-1.
5 Okumieff P,Meyn RE,Teicher B,et al.Report from the radiation oncology committee of the southwest oncology group(SWOG):Research objectives workshop,2003〔J〕.Am JClin Oncol,2003;26(5):522-5.
6 Shao J,Lee SB,Guo H,et al.Prostaglandin E2 stimulates the growth of colon cancer cells via induction of amphiregulin〔J〕.Cancer Res,2003;63(17):5218-23.
