牵拉对兔耳软骨愈合和再生影响的实验研究
2011-03-27苏薇洁章一新
苏薇洁 章一新
牵拉对兔耳软骨愈合和再生影响的实验研究
苏薇洁 章一新
目的建立可靠的兔耳软骨牵引模型,对牵引后软骨的生长方式、愈合方式进行研究。方法20只新西兰大白兔随机分组,每只兔随机选取一侧兔耳制作模型,实验组10只,对照组10只。实验组横向截断兔耳软骨,安装软骨牵引器,预固定2周,持续牵引2周,再固定1周;对照组术后不作牵引。于手术后即刻、预固定后、牵引后及再固定后分别取材,行HE、Masson染色,观察软骨组织生长愈合情况。对照组术后不作牵引。结果依靠外加牵引器进行持续牵引可促进兔耳软骨横向截断后产生新生的软骨细胞并修复组织缺损,基本恢复解剖形态。结论软骨截断后,通过外固定组织牵引技术能够促进软骨细胞再生和组织愈合,有望为软骨移植修复缺损提供更多的组织量。
软骨牵引技术愈合新生
先天性和创伤性机体组织缺损的修复中,软骨缺损的修复是目前难以攻克的问题,因为软骨缺损后再生能力较差,自体可提供的软骨供区少,组织量有限,软骨移植势必造成供区功能和外观的损伤[1]。
目前,常用的软骨来源除自体软骨[2]外,还有软骨替代产品,如羟基磷灰石等人工材料,但是它们存在塑形困难和不同程度的组织排异、感染、断裂等并发症。组织工程化软骨广泛应用于临床尚需时日[3]。
如何获得额外的足量的软骨组织,又能将对供区的损伤减少到最低呢?我们尝试设计和使用软骨牵引器,对兔耳软骨横向截断后,每日持续牵引,探索研究软骨组织愈合的机理和再生情况。
1 材料与方法
1.1 材料
成年新西兰大白兔20只(成年兔,3.5 Kg左右,雌雄不限),随机选取一侧制作模型,随机分组,实验组10只,对照组10只。
下颌骨内置牵引器1个,牵引片2片(牵引器型号:CBX0504,宁波慈北医疗器械有限公司)。
1.2 手术方法
氯胺酮、冬眠灵肌注麻醉,常规消毒铺巾。术前设计截断位置位于兔耳近1/3水平面。在兔耳两侧作侧切口,注意保护两侧耳缘动静脉。在皮下、软骨膜浅面潜行分离,直至耳软骨完全游离,以组织剪横行剪断软骨(包括软骨膜),在断端两侧安装牵引器牵引片,牵引器安装于耳腹侧,牵引片安装于耳背侧,螺帽螺丝固定。游标卡尺测量软骨牵引片之间距离,记录数据。
1.3 牵引方法
实验组术后牵引器固定于兔耳14 d(即不作牵引,无牵引力),第15天开始定时牵引(每天0.4 mm),持续定时牵引14 d后,牵引器保持牵引后距离不变,固定于兔耳(即不作牵引,无牵引力)。对照组则在术后保持牵引片距离,不作牵引。
1.4 大体观察和组织学检查
于手术后即刻、预固定后、牵引后及再固定后,测量牵引片之间的距离以得到牵引新生的组织长度。切取断端两侧兔耳全层组织,观察大体标本愈合情况,标本石蜡包埋、切片,HE、Masson染色,行组织学检查。
2 结果
2.1 牵引距离
实验组兔耳软骨牵引新生距离(7.40±0.33)mm,对照组未牵引。
2.2 大体观察
兔耳软骨在截骨术后即刻透光观察可见一连续的线性阴影(图1),而牵引后1周同样条件灯光下观察线性影消失(图2)。术后即刻切取兔耳断端两侧全层组织(约1 cm长组织块),见软骨断端清晰可见;术后固定2周(无牵引力)取材,见软骨断端有白色纤维组织填充,断端未见明显连续性愈合;牵引2周后取材,见软骨断端有致密组织连接,断端有明显连续性愈合;继续固定1周后取材,软骨断端肉眼下难以分辨,软骨连续性良好。
2.3 组织学检查
术后即刻软骨断端组织不平整,软骨细胞形状结构相似、排列规则,周围软组织及皮下组织缺损明显,有炎性细胞浸润(图3)。牵引器固定(无牵引力)2周后,断端出现体积较大的陷窝样软骨细胞,两断面呈现轻微水平方向错位,无软骨新生迹象。牵引2周后,软骨两断端较前增厚,软骨两侧出现体积较小的软骨细胞,胞外基质染色淡,增生活跃。牵引2周后继续固定1周,软骨两断端出现软骨样细胞新生,同源细胞呈多边形,染色较淡,有向对侧断端趋向性生长的趋势,软骨细胞形状大小差异明显,细胞较稀疏(图4)。

图1 实验组术后即刻Fig.1Right after operation of experimental group
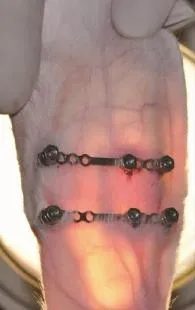
图2 术后5周(牵引2周后固定1周)Fig.2Five weeks after operation of experimental group

图3 术后即刻断端HE染色(40×)Fig.3The cut end right after surgery by HE staining(40×)
对照组术后5周时(图5),无明显软骨细胞生长,断端较为锐利,毛糙不整,细胞大小较为均匀,未见明显软骨细胞新生和同源软骨细胞群,并且两断端有明显错位,失去正常的解剖结构。Masson染色显示,两断端之间有较为致密的纤维结缔组织生成。
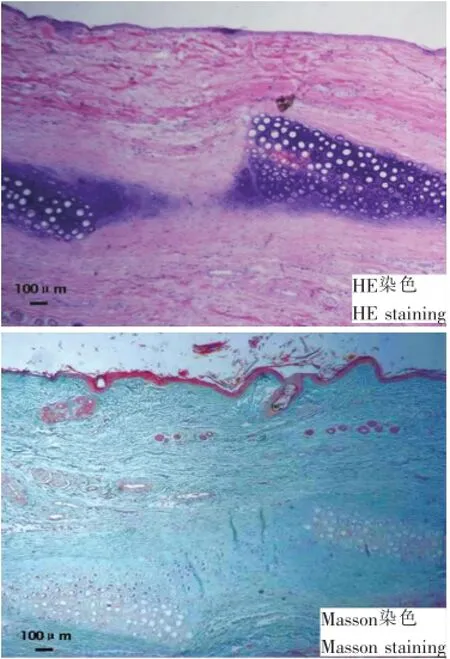
图4 实验组术后5周组织学检查(40×)Fig.4The histological observation of experimental group at 5 weeks after operation(40×)

图4 对照组术后5周组织学检查(40×)Fig.4The histological observation of control group at 5 weeks after operation(40×)
3 讨论
组织缺损的修复要求兼顾功能和外观,各种原因造成的软骨组织缺损的修复是目前难以攻克的问题。目前,临床上常用的软骨来源有:自体软骨移植,但是同源的供区较少、可提供的软骨组织量有限,并且自体移植影响供区的外观和功能,同时导致较多的并发症[1,4];软骨替代产品,如羟基磷灰石等人工材料,但存在不同程度的断裂、破溃、组织排异等现象,感染时有发生。另外,组织工程化软骨尚有待于研究的继续进行,临床应用尚需时日[5]。如何获得足量的可供移植的软骨组织,又能将对供区的损伤减少到最低,是目前临床修复软骨组织缺损所面临的难题[6]。
组织牵引技术已相当成熟,不同的人体组织可以通过牵引获得额外的同源组织,例如皮肤扩张器技术[7-8],截骨牵引技术[9-10]等,已广泛应用于临床。已有大量文献报道了持续牵引下关节软骨和软骨成骨的研究[11]。而关于软骨牵引以获取更多的组织量,进而修复软骨缺损的研究尚无相关报道。
本实验中,我们尝试将下颌骨截骨牵引器应用于兔耳软骨,横向截断软骨后,给予适当的持续牵引,建立截软骨牵引后软骨愈合和新生模型,同时对截软骨牵引后的新生组织进行组织学检查,从而对牵引后兔耳软骨的生长方式、愈合方式进行研究。
软骨组织有两种并存的生长方式:①间质生长,即通过软骨细胞的长大和分裂,不断地产生基质和纤维,使软骨从内部生长增大,当年轻机体处于生长发育时,软骨的生长以间质生长为主;②外加生长,是通过软骨膜内层的骨原细胞向软骨表面不断添加新的软骨细胞,产生基质和纤维,使软骨从表面向外扩大,当人体生长成熟,软骨的生长与修复以外加生长为主。
本实验中,截软骨后行持续牵引治疗,软骨组织出现了软骨细胞新生,同时伴随纤维结缔组织增生愈合。软骨截骨牵引后经持续固定,能够促使软骨断端产生软骨细胞并呈趋向性生长,更有通过软骨愈合实现软骨解剖连续性的趋势。而对照组未出现软骨细胞的新生愈合,并且发现存在明显的断端错位,失去原有的解剖外形和连续性。我们认为,软骨牵引模型和技术具有以下优点:①有望提供额外的足量的软骨组织用于移植修复软骨组织缺损;②可增加软骨移植供区的选择;③减少传统组织移植对供区的损伤;④外加牵引器能够帮助组织断端建立良好的对位。
软骨牵引器安装时应注意保护兔耳皮肤及皮下血供,避免兔耳缘静脉回流障碍,而出现组织坏死、血肿。牵引器的牵引操作为人工手动,可能出现牵引距离的细微差异。
在牵引过程中,新生软骨细胞的出现和软骨细胞的趋向性生长,可能和断端周围的软骨膜、软骨细胞自身分泌的一些促进软骨生成的细胞因子[12-14],以及牵引器的外加力等因素有关。对于截软骨牵引后软骨愈合和新生的具体方式尚无定论,需要进一步的实验研究。在后续研究中,我们将进一步延长实验的观察时间,对比不同牵引频率的牵引结果,从而更深层次地证实软骨牵引新生愈合的相关机制和影响因素。
[1]Uppal RS,Sabbagh W,Chana J,et al.Donor-site morbidity after autologous costal cartilage harvest in ear reconstruction and approaches to reducing donor-site contour deformity[J].Plast Reconstr Surg, 2008,121(6):1949-1955.
[2]Murrell GL.Auricular Cartilage Grafts And Nasal Surgery[J]. Laryngoscope,2004,114(12):2092-2102.
[3]杨肖杰,夏长所.关节软骨的损伤与修复:自体移植,基质诱导,内置支架及组织工程化培养[J].中国组织工程研究与临床康复, 2010,14(7):1282-1285.
[4]Naumann A.Porous polyethylene implants for ear reconstruction of middle to high-grade ear defects[J].Hals,Nasen und Ohrenheilkunde, 2011,59(2):197-214.
[5]Hildner F,Albrecht C,Gabriel C,et al.State of the art and future perspectives of articular cartilage regeneration:a focus on adiposederived stem cells and platelet-derived products[J].Tissue Eng Regen Med,2011,5(4):e36-51.
[6]Saw KY,Anz A,Merican S,et al.Articular cartilage regeneration with autologous peripheral blood progenitor cells and hyaluronic acid after arthroscopic subchondral drilling:a report of 5 cases with histology[J].Arthroscopy,2011,27(4):493-506.
[7]Weng R,Li Q,Gu B,et al.Extended forehead skin expansion and single-stage nasal subunit plasty for nasal reconstruction[J].Plast Reconstr Surg,2010,125(4):1119-1128.
[8]Obdeijn MC,Nicolai JP,Werker PM,et al.The osmotic tissue expander:a three-year clinical experience[J].Plast Reconstr Aesthet Surg,2009,62(9):1219-1222.
[9]Pereira MA,Luiz de Freitas PH,da Rosa TF,et al.Understanding distraction osteogenesis on the maxillofacial complex:a literature review[J].Oral Maxillofac Surg,2007,65(12):2518-2523.
[10]Eley KA,Witherow H,Hayward R,et al.The evaluation of bony union after frontofacial distraction[J].Craniofac Surg,2009,20(2): 275-278
[11]Furuta N,Yoshioka I,Fukuizumi T,et al.Morphological features of cartilage observed during mandibular distraction in rabbits[J]. Oral Maxillofac Surg,2007,36(3):243-249.
[12]Ronzière MC,Perrier E,Mallein-Gerin F,et al.Chondrogenic potential of bone marrow-and adipose tissue-derived adult human mesenchymal stem cells[J].Biomed Mater Eng,2010,20(3):145-158.
[13]Aoyama T,Okamoto T,Fukiage K,et al.Histone modifiers,YY1 and p300,regulate the expression of cartilage-specific gene, chondromodulin-I,in mesenchymal stem cells[J].Biol Chem, 2010,285(39):29842-29850.
[14]Zhao R,Ren Y,Sun B,et al.Experimental study on chitosan mediated insulin-like growth factor gene transfection repairing injured articular cartilage in rabbits[J].Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi,2010,24(11):1372-1375.
Effect of Distraction Osteogenesis on Healing and Regeneration of Auricular Cartilage in Rabbits
SU Weijie, ZHANG Yixin.Department of Plastic and Reconstructive Surgery,Shanghai Ninth People′s Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200011,China.Corresponding author:ZHANG Yixin(E-mail:zhangyixin6688@163.com)
ObjectiveTo establish the new distraction model of the rabbit ear and to evaluate the growth pattern and healing of cartilage after distraction.MethodsA total of 20 New Zealand rabbits were randomly divided into 2 groups(10 in the experimental group and 10 in the control group).In the experimental group,the rabbit ears were incised transversally, then the external distraction fixators were placed.After surgery,2 weeks of pre-fixation,2 weeks of distraction,and 1 week of re-fixation were given.The cartilage tissue and the chondrocytes was observed by morphological observation and HE, Masson staining.In the control group,no distraction was made after surgery.ResultsThe method of continuous distraction could promote neogenesis of chondrocytes and re-formation of cartilage to re-establish the anatomic form.ConclusionAfter rabbit ears were incised transversally,tissue distraction could promote the regeneration of the chondrocytes and the extracellular matrix so as to provide more cartilage and reform the ear cartilage.
Cartilage;Distraction;Healing;Regeneration
R687.3+4
A
1673-0364(2011)02-0093-04
2011年1月12日;
2011年3月3日)
10.3969/j.issn.1673-0364.2011.02.008
200011上海市上海交通大学医学院附属第九人民医院整复外科。
章一新(E-mail:zhangyixin6688@163.com)。
