DNA聚合酶β靶向siRNA对PC3细胞生物学行为的影响*
2011-03-19王明臣蒋薇薇张善锋王好东董子明
王明臣,蒋薇薇,张善锋,王好东,宋 宇,赵 勤,董子明
1)郑州大学基础医学院生物化学与分子生物学教研室郑州 450001 2)郑州大学基础医学院病理生理学教研室郑州 450001△男,1963年3月生,博士,教授,研究方向:肿瘤发生的分子机制及干预防治,E-mail:Wangm c@zzu.edu.cn
研究[1]表明,前列腺癌组织和前列腺癌细胞系存在DNA聚合酶(DNA polymerase,DNA pol)β的高表达。DNA polβ高表达介导过多的DNA低保真复制合成并由此导致基因组的不稳定性增加和细胞的自发突变率升高可能是介导肿瘤发生及肿瘤化疗中一些抗癌药物耐受产生的重要分子机制[2-4]。因此,寻求有效干预 DNA polβ过表达并使其呈现适宜水平表达的线索和途径,对于肿瘤的有效干预防治具有重要理论和实用意义。作者所在的课题组前期利用RNA干扰这一基因阻断技术,以pSUPERneoGFP载体中的H1为启动子, DNA polβ为靶基因,成功构建了2个DNA polβ靶向siRNA表达载体(pSUPERneoGFP-PS1和pSUPERneoGFP-PS2)[5]。该研究将其转染人前列腺癌PC3细胞,观察对DNA polβ高表达的沉默效应及不同程度抑制的DNA polβ功能状态对PC3细胞生物学行为的影响,旨在揭示DNA polβ基因在细胞内的适宜表达和功能状态,为前列腺癌的干预防治提供新的思路及治疗靶点。
1 材料与方法
1.1 细胞和重组载体 人前列腺癌PC3细胞系购自中国科学院上海细胞生物学研究所细胞库。靶向DNA polβmRNA的siRNA表达载体1(pSUPER-neoGFP-PS1)和表达载体2(pSUPERneoGFP-PS2)以及对照siRNA表达载体pSUPERneoGFP-SC,由作者所在课题组构建保存[5]。
1.2 细胞分组 常规细胞培养。细胞转染按 Invitrogen公司转染试剂LipofectamineTM操作说明书进行,转染后首先用 600 mg/L的 G418筛选,1~2 d后细胞大量死亡,仅余少量细胞,G418改为维持浓度 200mg/L,经过 2~3周逐渐形成抗性克隆,扩大培养得到稳定转染pSUPERneoGFP-PS1、pSUPERneoGFP-PS2、pSUPERneoGFP-CS和转染空pSUPERneoGFP的细胞。各转染细胞分别成组,并设未转染 PC3细胞组,每组接种 6个复孔培养24 h。
1.3 各组PC 3细胞DNA polβm RNA检测 采用RT-PCR法。DNA polβ上游引物5'-GAGAAG AACGTGAGCCAAGC-3'(189~208),下游引物5'-CATCCATGTCACCACTGGAC-3'(690~671),扩增片段大小 206 bp。内参 β-actin上游引物 5'-ACACTGTGCCCATCACGAGG-3'(555~575),下游引物5'-CTTTGCGGATGTCCACGTC-3'(929~947),扩增片段大小520 bp。用Qiagen公司试剂盒提取细胞总RNA并经逆转录得cDNA。扩增反应体系30μL:cDNA 5μL,Mix(含人DNA polβ引物及内参引物各0.5μL,10×Buffer 3μL,5mmol/L 4× dTNP 1μL)6μL,Taq酶(1×106U/L)0.5μL,去离子水18.5μL。94℃预变性5m in;94℃变性50 s, 55℃复性 50 s,72℃延伸 60 s,三温循环 35次;72℃末端延伸5 min。使用Syngene凝胶成像分析系统,对扩增产物的电泳条带进行灰度扫描,测定积分吸光度值(IA)。DNA polβmRNA的相对表达量以其IA与内参IA的比值表示。
1.4 各组PC3细胞DNA polβ蛋白的表达 采用Western b lot法。收集各组细胞,超声破碎细胞, Bradford法测定蛋白含量,取50μg样品,进行120 g/L SDS聚丙烯酰胺凝胶电泳;电转到PVDF膜上,用含质量分数5%脱脂奶粉4℃封闭6 h;TTBS洗膜5 min×3次。加入山羊抗人(DNA polβ一抗工作浓度1∶200)室温孵育1 h。TTBS洗膜5min×3次,室温。加入碱性磷酸酶标记的相应的二抗(1∶500)平缓摇动孵育1 h,室温。TTBS洗膜5min×3次。加入BCIP/NBT显色液,避光30 min后,蒸馏水终止。
1.5 各组PC3细胞周期的测定 采用流式细胞仪检测。取汇合度达 80%~90%的细胞,常规消化,PBS洗2遍。20 g/L多聚甲醛1 m L固定5 min,离心,PBS再洗 1遍。加胰蛋白酶液 250 μL,轻混,室温放置10 min。加中和液200μL,轻混,室温放置 10 m in。加 PI染料200μL,轻混, 2~8℃避光放置 10 min。用 300目尼龙网过滤样品后上机,采用Cell Quest软件分析图像。资料用Madfit LT for Mac 3.0软件分析处理,计算G0和G1期、S期、G2和M期PC3细胞百分率。
1.6 各组PC3细胞自发突变率的测定 采用体外哺乳类细胞次黄嘌呤-鸟嘌呤磷酸核糖转移酶(hypoxanthine-guanine,HGPRT)基因突变试验检测。将5×105个待测细胞(转染和未转染的 PC3细胞)接种于培养瓶中,于37℃、体积分数5%CO2条件下培养 24 h。进入对数生长期后,胰蛋白酶消化,加入含体积分数 10%胎牛血清培养液,混匀,放入离心管以1 000 r/min离心5 min,弃去上清液,制成细胞悬液并计数。以 6×106个细胞接种于直径为100 mm的平皿中,培养基中含有0.5 g/L的6-硫代鸟嘌呤(6-TG),37℃、体积分数5% CO2条件下培养 7 d,平行做 10个平皿。将上述首次消化计数后的细胞每平皿接种 200个,培养基中不含 6-TG,平行做 10个平皿,37℃、体积分数5%CO2条件下同样培养 7 d。培养结束后,用乙醇-冰醋酸(体积比3∶1)固定,Giemsa染色,计数每皿集落数。集落形成率 =实际存活的细胞集落数/接种细胞数。自发突变率 =突变集落数 ×集落形成率/接种细胞数 ×100%。
1.7 统计学处理 应用SPSS 12.0分析。各组PC3细胞DNA polβmRNA和蛋白表达、细胞周期以及自发突变率的比较采用单因素方差分析,组间两两比较采用SNK-q检验。检验水准α=0.05。
2 结果
2.1 各组PC3细胞DNA po lβ的mRNA及蛋白表达的变化及细胞周期 见图1和表 1。
2.2 各组PC3细胞自发突变率的变化 见表2。

图1 各组PC 3细胞中DNA polβ蛋白的表达1:转染pSUPERneoGFP-PS1组;2:转染pSUPERneoGFP-PS2组;3:转染pSUPERneoGFP-CS组;4:转染空pSUPERneoGFP组;5:未转染组。
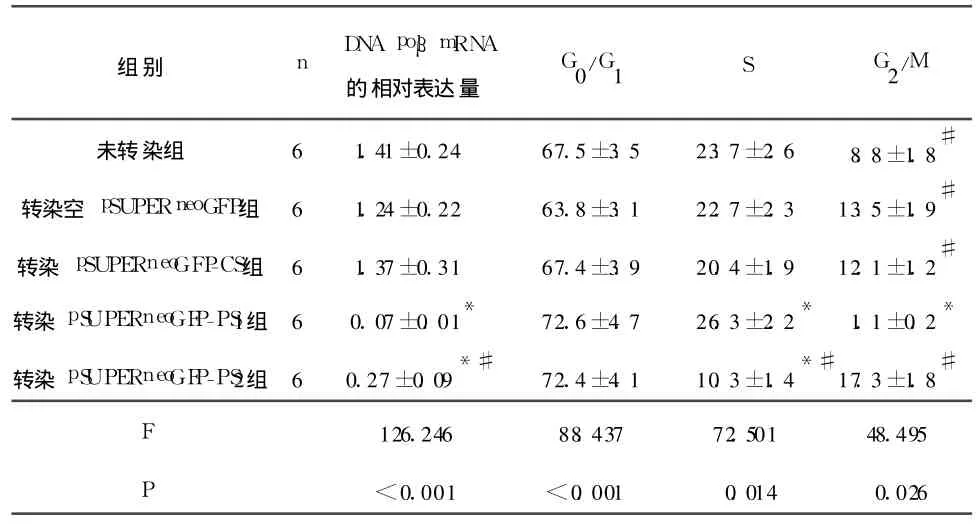
表1 各组PC 3细胞po lβm RNA的表达水平比较

表2 各组PC 3细胞自发突变率比较
3 讨论
研究[6]显示,前列腺癌组织及人前列腺癌 PC3细胞系存在DNA polβ的高表达。DNA polβ过表达可导致复制的错配率增加并由此引发基因组的不稳定性升高,可能是除 polβ基因突变以外,介导肿瘤发生的另一重要分子机制。该结果显示:与转染siRNA对照(pSUPERneoGFP-CS)、转染空siRNA载体及未转染的PC3细胞相比,转染polβ靶向siRNA载体的PC3细胞,DNA polβ无论mRNA水平抑或蛋白水平的表达均受到显著抑制,且pSUPERneoGFP-PS1的沉默抑制作用强于pSUPERneoGFP-PS2,几近完全抑制。表明短发卡状polβ靶向siRNA能快速有效、特异性地封闭DNA polβ的表达。其机制在于polβ靶向siRNA载体导入前列腺癌PC3细胞后,在体内迅速转录产生短发卡RNA结构,并在dsRNA特异性核酸内切酶的作用下加工成为19 bp大小的siRNA,引发转录后基因沉默。表现为与未转染的PC3细胞、转染空载体和转染对照pSUPER-neoGFP-CS的PC3细胞相比,呈现部分抑制的转染pSUPERneoGFP-PS2细胞的S期比例明显降低,对应的细胞自发突变率亦显著降低。而 polβ表达几乎完全抑制的转染pSUPERneoGFP-PS1细胞的S期比例反而显著增加,自发突变率亦显著升高。提示DNA polβ的过表达或表达完全“敲除”均有利于细胞的恶性转化,即细胞正常的分裂增殖及细胞基因组稳定性的维持依赖适宜的低浓度的DNA polβ的存在。
总之,作者利用RNA干扰技术对polβ基因的功能状态研究揭示,细胞内维持polβ所呈现的DNA损伤修复酶和聚合酶两种酶活性的适宜比例可能是非常重要的。寻求一些能够有效调控细胞该酶两种活性时相和消长关系的线索和手段可能是有效干预细胞恶性转化的新途径。
[1]王明臣,唐琳,赵国强,等.前列腺癌及良性前列腺增生组织中DNA聚合酶β、PTEN及Ha-ras基因mRNA检测[J].郑州大学学报:医学版,2005,40(4):613
[2]Canitrot Y,Cazaux C,Frechet M,et al.Overexp ression of DNA polymerasebeta in cell results in amutator phenotype and a decreased sensitivity to anticancer drugs[J].Proc Natl Acad Sic USA,1998,95(21):12586
[3]Bergolio V,Pillaire MJ,Lacroix-Trikim M,et al.Deregulated DNA polymerase beta induces chromosome instability and tumorigenesis[J].Cancer Res,2002,62(12):3511
[4]Servant L,Bieth A,Hayakawa H,et al.Involvement of DNA polymerase beta in DNA rep lication and mutagenic consequences[J].JMol Biol,2002,315(5):1039
[5]王明臣,唐琳,赵国强,等.前列腺癌及良性增生组织中DNA聚合酶β基因突变检测[J].郑州大学学报:医学版,2006,40(4):611
[6]王明臣,宋宇,张善锋,等.前列腺癌特异突变 DNA聚合酶 β真核表达载体构建及鉴定[J].中国老年学杂志2009,29(14):1758
