荧光原位杂交技术在膀胱癌诊断中的应用*
2011-03-19陈瑞廷杨锦建贾占奎胡宝利
陈瑞廷,杨锦建,贾占奎,胡宝利
郑州大学第一附属医院泌尿外科郑州 450052
#通讯作者,男,1962年 2月生,博士,主任医师,研究方向:泌尿外科疾病的基础与临床,E-mail:yangjinjian66@ 126.com
膀胱肿瘤是泌尿系统最常见的肿瘤。膀胱癌主要依靠膀胱镜检查并取活组织检查确诊,但膀胱镜检查为有创检查,且与膀胱炎症不易区别。荧光原位杂交(fluorescence in situ hybridization, FISH)是一种分子细胞遗传学技术,近年来广泛应用于基因定位、染色体进化和遗传毒理学等基础研究。作者以膀胱镜活检结果为金标准,采用FISH技术检测尿脱落细胞用以诊断膀胱癌,并与尿脱落细胞学检查结果相比较,评价其对膀胱癌的诊断价值,同时分析不同分期、不同分化程度膀胱癌的染色体畸变情况。
1 临床资料
1.1 一般资料 选取2009年 7月至 2010年10月因肉眼血尿症状在郑州大学第一附属医院泌尿外科住院的患者 100例,排除泌尿系结石、尿道息肉及上尿路肿瘤病变,其中男 62例,女 38例,年龄 31~82 (57.9±15.6)岁。膀胱镜活检确诊为膀胱移行细胞癌 75例,腺性膀胱炎病变 25例。75例膀胱癌患者中,术后病理分期:Tis期7例,Ta期24例,T1期20例,T2期 14例,T3期 8例,T4期 2例;高分化 48例,低分化 27例;65例行经尿道膀胱肿瘤电切术, 10例行膀胱全切术。
1.2 标本采集 患者均在膀胱镜检查前行尿脱落细胞FISH检测和细胞学检查。留取250 mL以上的新鲜晨尿,1 h内送检。每例尿样分为 2份,分别行尿脱落细胞学检查和FISH检测。容器为一次性使用,清洁、干燥,开口大,有明显标记,尿液要防止异物混入。
1.3 FISH检测 应用北京金菩嘉公司提供的染色体探针试剂盒,包括CSP3/CSP7和GLP P16/CSP17两组探针。实验步骤:取200 mL以上晨尿离心去上清,依次加入胶原酶B、KCl低渗溶液及固定液处理后,制备细胞滴片 2张,烤片机老化。将玻片放入37℃HCl与胃蛋白酶混合液中孵育10 min。2× SSC溶液漂洗玻片 2次,甲醛固定,梯度乙醇脱水,自然干燥。室温避光,取7μL杂交缓冲液、1μL去离子水和 2μL染色体着丝粒探针混合物滴于玻片杂交区域,立即加盖玻片,橡皮胶封边,78℃杂交仪变性5min。玻片置于湿盒中42℃过夜杂交,洗涤、复染后于荧光显微镜下分析观察,摄片保存。GLP P16和CSP7探针为红色信号,CSP17和CSP3探针为绿色信号。按金菩嘉公司提供的正常阈值标准进行阳性结果判定。4个探针至少 2种探针信号异常判定为阳性。
1.4 尿脱落细胞学检查 取约50mL的新鲜尿液离心,取沉淀制成细胞涂片,常规 HE染色后镜下观察。每例患者连续检测 3 d,发现 1次癌细胞即判为阳性。
1.5 统计学处理 应用SPSS 10.0进行数据处理,计算尿脱落细胞学和FISH检查的灵敏度、特异度和约登指数,评价其诊断价值;采用配对 χ2检验对不同分化程度和不同分期的膀胱癌患者的两种检测结果进行比较;采用 χ2检验对不同分化程度和不同分期膀胱癌患者FISH各探针阳性率进行比较,检验水准α=0.05。
2 结果
FISH阳性表现见图 1。以 4种探针联合的FISH检测和尿脱落细胞学检查的灵敏度、特异度和约登指数计算结果见表 1,不同分化程度和不同分期膀胱癌患者 2种检查结果的比较见表 2,不同分化程度、不同分期膀胱癌患者FISH各探针检测结果的比较见表 3。
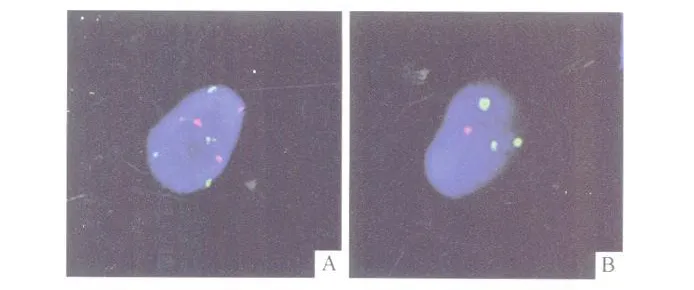
图1 肿瘤细胞的FISH阳性表现

表1 2种检测方法的灵敏度、特异度和约登指数比较

表2 2种检查结果的比较 例(%)

表3 FISH检测结果分析 阳性例数(%)
3 讨论
FISH是在原有的放射性原位杂交技术的基础上发展起来的一种非放射性原位杂交技术,近年来泌尿外科工作者将其应用于膀胱癌的诊断和复发监测。Marin-Aguilera等[1]的研究结果显示FISH用于诊断浅表性膀胱癌的灵敏度高于尿脱落细胞学检查;而两者的诊断特异度差异无统计学意义。国内相关文献[2-3]也报道 FISH检测比尿脱落细胞学具有更高的灵敏度,但两者的特异度相似。Constantinou等[4]研究发现膀胱癌 T1期患者FISH检测阳性率为80%,T2、T3期患者的阳性率为 100%。该研究结果显示:FISH检测诊断膀胱癌的总灵敏度为0.827,明显高于尿脱落细胞学检查的 0.387;而两者特异度相似;此外,FISH检测的约登指数较高,提示其真实性强,对于高分化或Tis、Ta及T1期膀胱癌,FISH的阳性率亦显著高于尿脱落细胞学,提示FISH检测在诊断低级别及低分期膀胱癌时比尿脱落细胞学具有优势。
CSP3、CSP7、GLP P16及CSP17探针分别用于脱落细胞的3、7、9p21(p16)和17号染色体数目畸变的检测。Veeramachaneni等[5]进行的FISH研究发现膀胱癌 3号染色体多倍体高达 76%。在对非浸润性膀胱癌病理切片的FISH研究中,Krǜger等[6]发现 3号染色体多倍体占 27%,7号染色体多倍体占13.0%~76.2%,17号染色体多倍体仅占12%,9p21的纯合性缺失率为28.6%~83.0%。多项研究[7-9]表明 3号染色体中的基因过表达与膀胱癌的病理分级相关,7号染色体多倍体与病理分期、分化程度相关,17号染色体的异常可能促进了膀胱癌的发生和进展。另有研究[10-11]认为 9p21缺失是膀胱癌早期最常见的改变之一,其可能作为膀胱癌早期诊断和监测复发的重要分子标志。但多数研究[11-13]认为 9号染色体的畸变与分期、分化程度无关,但在低分化、低分期癌中常见。该研究发现,膀胱癌中CSP3、CSP7、GLP P16和CSP17探针的阳性率分别为57.3%、57.3%、70.7%和54.7%;3号和7号染色体异常与膀胱癌病理分期有关,随着病理分期的升高,CSP3、CSP7探针阳性率增加,但与分化程度无关;而 9号和 17号染色体异常与病理分化程度有关,随着肿瘤细胞恶性程度的增高,GLP P16、CSP17阳性率增加,但与病理分期无关。该研究亦发现在Tis期膀胱癌中P16异常达5/7,提示9p21异常可能在膀胱癌的早期诊断中起重要作用。
总之,FISH技术作为诊断和监测膀胱癌的一种简单、无创性诊断方法,具有较高的灵敏度和特异度,其对提高人群膀胱癌的早期诊断率具有重要的临床应用价值。
[1]Marin-Aguilera M,Mengual L,Ribal MJ,etal.Utility of amultiprobe fluorescence in situ hybridization assay in the detection of superficial urothelial bladder cancer[J]. Cancer GenetCytogenet,2007,173(2):131
[2]宋希双,王相平,张小雷,等.荧光原位杂交技术在膀胱癌诊断中的临床应用研究[J].现代泌尿生殖肿瘤杂志,2010,2(1):34
[3]李清,徐涛,郝宜昌,等.应用荧光原位杂交技术检测膀胱癌的研究[J].中国肿瘤临床与康复,2008,15 (6):481
[4]Constantinou M,Binka-Kowalska A,Borkowske E,et al. Application of mu ltiplex FISH,CGH and MSSCP techniques for cytogenetic andmolecular analysis of transitional cell carcinoma(TCC)cells in voided urine specimens[J]. JAppl Genet,2006,47(3):273
[5]Veeramachaneni R,Nordberg ML,Shi R,et al.Evaluation of fluorescence in situ hybridization as an ancillary tool to urine cytology in diagnosing urothelial carcinoma[J].Diagn Cytopathol,2003,28(6):301
[6]Krǜger S,Mess F,Böhle A,et al.Numerical aberrations of chromosome 17 and the 9p21 locus are independent predictors of tumor recurrence in non-invasive transitional cell carcinoma of the urinary bladder[J].Int JOncol,2003,23 (1):41
[7]Mhawech-Fauceglia P,Fischer G,Beck A,et al.Raf1, Aurora-A/STK 15and E-cadherin biomarkers expression in patientswith pTa/pT1urothelial bladder carcinoma;a retrospective TMA study of 246 patientswith long-term followup[J].Eur JSurg Oncol,2006,32(4):439
[8]Sauter G,Haley J,Chew K,et al.Epidermal-growth-factor recep tor expression is associated with rapid tumor proliferation in bladder cancer[J].Int JCancer,1994,57(4): 508
[9]Gallucci M,Guadagni F,Marzano R,et al.Status of the p53,p16,RB1,and HER-2 genes and chromosomes 3, 7,9,and 17 in advanced bladder cancer:correlation with adjacent mucosa and pathological parameters[J].J Clin Pathol,2005,58(4):367
[10]Placer J,Espinet B,Salido M,et al.Correlation between histologic findings and cytogenetic abnormalities in bladder carcinoma:a FISH study[J].Urology,2005,65(5):913
[11]EleuteriP,GrollinoMG,PomponiD,et al.Chromosome 9 aberrations by fluorescence in situ hybridization in bladder transitional cell carcinoma[J].Eur J Cancer,2001,37 (12):1496
[12]Laudadio J,Keane TE,Reeves HM,et al.Fluorescence in situ hybridization for detecting transitional cell carcinoma: implications for clinical practice[J].BJU Int,2005,96 (9):1280
[13]Jones JS.DNA-based molecular cytology for bladder cancer surveillance[J].Urology,2006,67(3 Supp l 1):35
