氯通道电流在离体大鼠海马缺血缺氧性神经元凋亡中的变化及SITS的拮抗作用*
2011-03-19钟志超范洪领尹金宝郑原印许黎娟常全忠
钟志超,范洪领,尹金宝,郑原印,许黎娟,常全忠
遵义医学院珠海校区生理学教研室珠海 519041
#通讯作者,男,1965年12月生,博士,教授,研究方向:神经生物学,E-mail:cqzchang@tom.com
在缺血性脑损伤和多种神经系统退行性疾病中,脑细胞的程序性死亡是脑功能退化和损伤的主要诱因[1]。目前对缺血性脑损伤后神经元程序性死亡的机制尚不完全清楚。研究[2]发现,脑缺血后海马CA1锥体细胞膜的兴奋性持续降低是触发迟发性神经元死亡的一个重要因素,这种兴奋性的改变可能与氯通道的活动增强有关。阴离子通道阻断剂DIDS对容积敏感性氯通道有明显的阻断效应并具有明显的抗凋亡作用,且具有剂量依赖性[3-4]。对氯通道在缺血缺氧性神经元凋亡中的作用目前报道较少。作者利用NO诱导大鼠海马神经元损伤,观察神经元膜氯通道电流的变化及氯通道抑制剂 4-乙酰氨基-4'-异氰酸芪-2,2'-二磺酸(SITS)对电流的影响,探讨氯通道与缺血缺氧性脑神经元凋亡之间的关系。
1 材料与方法
1.1 动物和试剂 新生1 d的SD大鼠由遵义医学院实验动物中心提供;DMEM/Ham's F12培养基以及多聚赖氨酸(PLL)、阿糖胞苷、SITS、3-吗啉斯德酮胺(SIN-1)等试剂购自美国Sigma公司;胎牛血清(杭州四季青公司)。
1.2 大鼠海马神经元的培养 参照文献[5]取出生1 d内的SD大鼠,雌雄不拘,无菌断头取脑,在冰冷D-Hank's液里分离双侧海马,剪成约1 mm3小块,2.5 g/L胰蛋白酶37℃消化15 min,加基础培养基终止消化,机械吹打分散细胞,500目筛网过滤,制成单细胞悬液,1 000 r/min室温离心10 min,去上清液,加完全培养基,吹打分散细胞后制成 4× 108L-1的单细胞悬液,接种在预先包被有 PLL的培养板内,于体积分数95%O2、5%CO2,37℃饱和湿度下培养,培养液中含有体积分数90%DMEM/ F12、体积分数10%胎牛血清、2mmol/L谷氨酰胺以及1×105U/L青、链霉素。接种 48 h后更换培养液,同时加入1×10-5mmol/L阿糖胞苷作用48 h,以抑制胶质细胞的过度增殖。以后每 3 d更换培养液 1次,每次更换原液体的 1/3。
1.3 实验分组及处理 取培养 12 d的海马神经元,随机分为正常对照组、SIN-1处理组和SIN-1处理后加SITS组(SITS组)。SIN-1的作用终浓度是1.0mmol/L,作用时间是18 h,SITS(0.5mmol/L)的作用时间是18 h。
1.4 细胞凋亡检测 采用Hoechst33258 DNA荧光染色法。取各组培养神经元,用0.1 mol/L pH 7.4的PBS冲洗1次,40 g/L多聚甲醛固定15 min,空气干燥5 min,DNA荧光素Hoechst33258染色15 min,用0.1mol/L pH 7.4的PBS冲洗2次,倒置荧光显微镜观察细胞核形态,每次数 3个高倍视野内200个细胞,计算细胞凋亡率。实验重复 6次。
1.5 氯通道电流的检测 采用全细胞膜片钳技术,所需的主要液体配制方法如下。标准电极外液(SES):NaCl 110 mmol/L,CdCl22.0 mmol/L, EGTA 0.1 mmol/L,TEA-Cl 5.0 mmol/L,D-glucose 10mmol/L,HEPES 10 mmol/L,TTX 0.1μmol/L。用NaOH调节pH至7.3~7.4。标准电极内液(SIS):TEA-Cl 115 mmol/L,Na2-ATP 2.0 mmol/L, EGTA 1.0 mmol/L,MgCl21.0 mmol/L,CaCl21.0 mmol/L,D-glucose 10 mmol/L,HEPES 10 mmol/L。调节pH至7.3~7.4。
1.6 统计学处理 采用SPSS 11.0进行分析,3组间神经元凋亡率的比较用单因素方差分析,两两比较采用SNK-q检验,检验水准α=0.05。
2 结果
2.1 3组神经元的形态学观察 见图1。对照组神经元胞核呈卵圆形,荧光显微镜下呈均匀的蓝色荧光。SIN-1组神经元大量凋亡,凋亡的神经元皱缩或变圆、染色质浓集或断裂或出现凋亡小体,呈强亮的蓝色荧光。SITS组凋亡神经元明显少于SIN-1组。凋亡率测定结果见表 1。

图1 3组离体培养海马神经元的形态学变化(DNA荧光染色,×400)

表1 各组神经元凋亡率比较 %
2.2 3组海马神经元氯通道电流检测结果 正常情况下氯通道电流随膜的逐渐去极化由负值向正值变化,从膜电压-100 mV的(-8.19±1.92)A/F升到膜电压+80 mV的(22.46±1.50)A/F,变化趋势呈外向整流特性,膜反转电位约为-70 mV,大致接近氯离子的膜平衡电位;膜电流的变化呈电压依赖性,与时间关系不大。浴槽液中加SIN-1(终浓度为1.0 mmol/L)作用10~15min可增加海马神经元氯通道电流密度,从-100 mV的(1.46±0.20) A/F增加到+80 mV时的(23.22±1.89)A/F。SITS(0.5mmol/L)在浴槽液中作用5min能部分阻断通道电流(图2)。
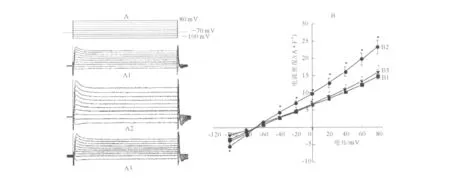
图2 3组海马神经元氯通道电流检测结果A:电压变化曲线;B:电压-电流密度曲线;1:对照组;2:SIN-1组;3:SITS组。
3 讨论
缺血性脑损伤会引起脑内 NO的过量产生而引起毒性损伤作用。为模拟缺血性脑损伤神经元凋亡,作者用NO供体SIN-1诱导神经元凋亡。用DNA荧光试剂对核染色,结果显示,正常离体培养12 d的海马神经元胞核光滑,呈卵圆形,荧光显微镜下呈淡蓝色荧光;SIN-1(1.0mmol/L)作用18 h,神经元胞核浓缩、变小,折射出强亮的蓝色荧光,凋亡率明显升高。提示使用SIN-1诱发缺血性脑神经元凋亡模型可靠。0.5mmol/L的SITS可明显减少凋亡率,提示氯通道的活动可能参与了这种类型的神经元凋亡的发生。
氯通道在缺血性神经元凋亡中的作用国内外报道甚少。有报道[6],是氯离子而不是钾离子参与了神经元凋亡的过程。在NMDA诱导神经元凋亡模型中,氯通道阻断剂SITS和DIDS均可明显减少神经元的凋亡率[7]。作者利用全细胞膜片钳记录模式观察了在SIN-1处理前后、氯通道阻断剂使用前后氯通道全细胞电流密度的变化。结果显示:SIN-1处理神经元后能明显增加氯通道的电流密度,这些电流的增加几乎被氯通道阻断剂SITS所阻断,证实氯通道可能参与了SIN-1诱导的缺血性海马神经元的凋亡。提示:在缺血性脑损伤中,脑内过量产生的NO可激活神经元上的氯通道,氯通道的活动增强可能参与了缺血性脑神经元的凋亡过程。氯通道是通过什么机制参与缺血性神经元的凋亡过程有待于进一步研究。
[1]Yuan J,Yankner BA.Apoptosis in the nervous system [J].Nature,2000,407(6805):802
[2]Gao TM,Pulsinelli WA,Xu ZC.Changes in membrane properties of CA 1 pyram idal neurons after transient forebrain ischemia in vivo[J].Neuroscience,1999,90(3): 771
[3]Inoue H,Ohtaki H,Nakamachi T.Anion channel blockers attenuate delayed neuronal cell death induced by transient forebrain ischemia[J].J Neurosci Res,2007,85 (7):1427
[4]Kawasaki M,Uchida S,Momkawa T,et al.Cloning and expression ofa p rotein kinase C-regulated chloride channel abundantly expressed in ratbrain neuronal cells[J].Neuron,1994,12(3):597
[5]Li YH,Gong PL.Neuroprotective effect of dauricine in cortical neuron culture exposed to hypoxia and hypoglycemia:involvement of correcting perturbed calcium homeostasis[J].Can JPhysiol Pharmacol,2007,85(6):621
[6]Small DL,Tauskela J,Xia ZL.Role for chloride but not potassium channels in apoptosis in p rimary rat cortical cu ltures[J].Neurosci Lett,2002,334(2):95
[7]常全忠,张淑玲.雌激素对NMDA诱导离体大鼠海马神经元凋亡中的作用[J].中国药理学通报,2006,22(4): 456
