复方中草药对仿刺参免疫力和抗病力的影响
2011-03-18吴亚楠柳鹏李强姜传俊李华
吴亚楠,柳鹏,李强,姜传俊,李华
(大连海洋大学农业部海洋水产增养殖学重点开放实验室,辽宁大连116023)
复方中草药对仿刺参免疫力和抗病力的影响
吴亚楠,柳鹏,李强,姜传俊,李华
(大连海洋大学农业部海洋水产增养殖学重点开放实验室,辽宁大连116023)
将以黄芪、党参为主药并加入另外5味中草药所配伍的复方中草药粉碎制剂,以质量分数分别为0%(对照组)、0.5%、1.5%和2.5%的剂量添加于基础饲料中,连续投喂仿刺参Apostichopus japonicus 37 d,在试验开始后第1、2、3、4周采样,测定仿刺参的肠、触手、体壁、肌肉和体腔液中的抗菌活力及体腔细胞的吞噬活性;于试验开始后第4周,用仿刺参“化皮病”病原菌黄海希瓦氏菌Shewanella marisflavi以3.7×108个/mL的浓度在每头仿刺参背部注射0.1 mL的菌悬液,每天观察记录死亡个体症状,统计死亡率,计算相对保护率(共观察记录7 d)。结果显示:各组的抗菌活力均随着用药时间的延长、用药浓度的加大而升高,总体趋势表现为2.5%添加组>1.5%添加组>0.5%添加组>对照组;各用药组仿刺参的体腔细胞吞噬能力均随着用药时间的延长呈现先升高后降低的趋势,第2、3周达峰值,总体趋势表现为1.5%添加组>2.5%添加组>0.5%添加组>对照组;攻毒试验结果显示,对照组仿刺参3 d后全部死亡,第7天各用药组相对保护率依次为1.5%添加组>0.5%添加组>2.5%添加组,分别为30.0%、20.0%和10.0%。由此表明,该复方中草药可以显著提高仿刺参的免疫力和抗病力,以1.5%添加剂量组的效果最佳。
复方中草药;仿刺参;吞噬作用;抗菌活力;相对保护率
海参不仅营养丰富,且具有较高的药用价值,是海洋中重要的食物和药物资源[1]。中国在20世纪90年代掀起了仿刺参养殖热潮,随着养参业集约化程度的不断加深,养殖环境的日益恶化,相继出现了仿刺参免疫力下降、幼参生长慢、成活率低等问题,严重制约了该产业的持续稳定发展[2]。近年来应用免疫增强剂来提高水产动物机体免疫力的研究应运而生,现已证明有200余种中草药含有多种免疫活性物质,这些免疫活性物质能调节动物机体的免疫功能[3],中草药已被广泛地应用于水产养殖中。目前有关海参免疫增强剂方面的研究已有一些报道,如向海参Holothuria glaberrima体腔中注射一定剂量的脂多糖能增强体腔细胞的吞噬活性[4];饲料中添加甘草酸可以提高仿刺参的非特异性免疫力和抗病力[5];穿心莲、大青叶、金银花等复方中草药可以有效抑制或杀灭仿刺参病原菌,增强仿刺参非特异性免疫功能[6]。本试验中,作者以黄芪和党参为主药并加入另外5味中草药制成复方中草药制剂,研究了本复方中草药制剂对仿刺参各组织的抗菌活力、体腔细胞吞噬力和机体抗病力的影响及作为仿刺参免疫增强剂的可行性,旨在将中草药用于仿刺参养殖中,为仿刺参的绿色健康养殖提供保障。
1 材料与方法
1.1 材料
试验用仿刺参Apostichopus japonicus购于大连湾海珍品养殖场,体质量为3~5 g。将仿刺参置于PVC水槽(50 cm×35 cm×20 cm)内暂养2周,每天投喂基础饲料(以海藻粉为主),以仿刺参出现有规律摄食为驯化完成指标。
复方中草药配方为:以黄芪Astragalus menbranaceus、党参Radix codonopsis pilosulae为主药,甘草Glycyrrhiza uralensis、当归Angelica sinensis等5味中草药为辅药。所用中草药购自大连奇运生大药房,粉碎后过100目筛。将粉碎后的中草药分别以质量分数为0.5%、1.5%、2.5%的比例添加到基础饲料中,再用80目筛绢在海水中过滤后投喂。
1.2 方法
1.2.1 试验分组 试验分为基础饵料组(对照组)和0.5%、1.5%、2.5%复方中草药添加组,每组设3个平行,每个平行组放养30头仿刺参。每天上午换水,下午投喂,所用海水为大连海洋大学爱尼养殖场的过滤海水,每次换水量约为总水量的1/3,连续充气。
1.2.2 抗菌活力的测定 试验开始后,每周取样1次,每次每组取仿刺参2头,冰盘刨取触手、体壁、肌肉和肠,收集体腔液。将所取的各组织称重,按1∶10加入冷PBS缓冲液(pH为7.4)进行匀浆,然后于4℃下以7 000 r/min离心20 min,取上清液测定。采用改进的Hultmark等[7-8]的方法进行测定。将样品加入96孔酶标板中,10 μL/孔,再往孔内移加90 μL 0.1 mol/L的磷酸钾缓冲液(pH 6.4),在490 nm下测定吸光值A1;然后加入100 μL磷酸钾缓冲液,在490 nm下测定其吸光值A2。系统误差(K)的计算公式为

将待测液(10 μL/孔)移入酶标板相应的孔后,向孔内加入90 μL 0.1 mol/L的磷酸钾缓冲液(pH为6.4),在630 nm下测定其吸光值AK;取出96孔板,向相应列的孔内分别移加100 μL大肠杆菌悬液,摇匀后在630 nm下测定其吸光值A0;在37℃下温育30 min后,在490 nm下测定吸光值A。抗菌活力(Ua)按下列公式计算:
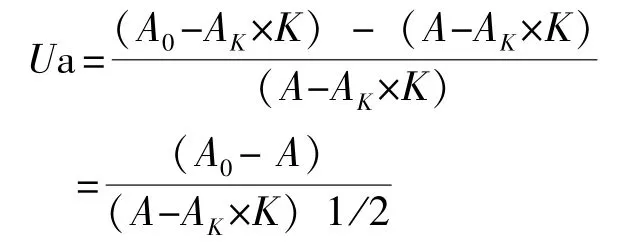
(如果A0≤A,Ua值均以0作为结果)。
1.2.3 吞噬活性的测定 试验开始后每周取样1次,每次每组取仿刺参2头,于背部注射0.1 mL用无菌海水配制的干酵母Saccharomyces siccum细胞悬液(0.1 mg/mL),4 h后用注射器抽取体腔液滴片并计数。按下式公式计算吞噬率(Phagocytic percentage)和吞噬指数(Phagocytic index):

1.2.4 攻毒感染试验 感染用黄海希瓦氏菌Shewanella marisflavi为仿刺参“化皮病”的病原菌[9],由本实验室分离保存。投喂中草药4周后,在仿刺参的背部注射黄海希瓦氏菌菌悬液(浓度为3.7×108个/mL,该浓度是依据本课题组前期的试验研究结果拟定的[9]),注射剂量为0.1 mL,每组注射10头;以注射等量的无菌生理盐水作为空白对照。观察并记录仿刺参死亡个体的症状,统计死亡率,依下式计算仿刺参的相对保护率(Relative percent survival)。

1.3 统计分析
应用SPSS 17.0统计软件对数据进行单因素方差分析,以P>0.05表示相关性不显著,以P<0.05表示相关性显著,并进行Duncan多重比较。
2 结果
2.1 复方中草药对仿刺参各组织抗菌活力的影响
2.1.1 肠 从图1可见:随着投喂时间的延长,不同浓度中草药组仿刺参肠组织的抗菌活力均表现出稳步增长的趋势。对4次采样结果进行方差分析,结果表明,中草药对仿刺参肠组织抗菌活力的影响均显著(P<0.05),1.5%和2.5%添加组均显著高于0.5%添加组和对照组(P<0.05), 1.5%添加组的抗菌活力后期增长迅速,2.5%添加组在整个投喂期间其肠组织抗菌活力最高。
2.1.2 触手 从图1可见:随着投喂时间的延长,不同浓度中草药组仿刺参触手的抗菌活力均有小幅增长,其中2.5%添加组呈先升高后降低的趋势,并于第3周达峰值。方差分析结果表明,中草药对仿刺参触手抗菌活力的影响均显著(P<0.05)。1.5%和2.5%添加组均显著高于0.5%添加组和对照组(P<0.05),其中2.5%添加组更为显著(P<0.05)。
2.1.3 体壁 从图1可见:随着投喂时间的延长,不同浓度中草药组仿刺参体壁抗菌活力逐渐呈小幅上升趋势。经方差分析,中草药对仿刺参体壁抗菌活力的影响均显著(P<0.05),2.5%添加组均显著高于其它试验组(P<0.05)。
2.1.4 肌肉 从图1可见:投喂期间,不同浓度中草药组仿刺参肌肉的抗菌活力均高于对照组。方差分析结果表明,中草药对仿刺参肌肉抗菌活力的影响均显著(P<0.05)。2.5%添加组显著高于其它各组(P<0.05),且随着投喂时间的延长无明显的波动。
2.1.5 体腔液 从图1可见:前三周采集的样品,各试验组仿刺参体腔液中的抗菌活力均随中草药添加量的升高而升高;第4周,各试验组体腔液中抗菌活力的大小依次为2.5%组>0.5%组>1.5%组>对照组。方差分析结果表明,中草药对仿刺参体腔液抗菌活力的影响均显著(P<0.05)。

图1 复方中草药对仿刺参肠、触手、体壁、肌肉和体腔液抗菌活力的影响Fig.1 Influence of compound Chinese herbal medicine on antibacterial activity in intestine,tentacle, body wall,muscle,and coelomic fluid of sea cucumber Apostichopus japonicus
2.2 复方中草药对仿刺参体腔细胞吞噬活性的影响
由图2可知,投喂复方中草药可明显提高仿刺参体腔细胞的吞噬率,且随着时间的延长,各浓度中草药添加组的仿刺参体腔细胞吞噬率均表现为先升高后降低的趋势,于第2周达到峰值。方差分析结果显示,各浓度组复方中草药对仿刺参体腔细胞吞噬率均有显著影响(P<0.05)。对照组始终保持较低水平。第1周和第2周,1.5%添加组显著高于其它各组(P<0.05);第3周,2.5%组最高;第4周,1.5%和2.5%组显著高于0.5%组和对照组(P<0.05)。
由图2可知,各试验组仿刺参体腔细胞的吞噬指数随时间延长,均表现出一定的波动趋势,但规律不明显,而对照组较平稳。方差分析结果表明,复方中草药对仿刺参体腔细胞吞噬指数的影响均显著(P<0.05)。除第3周,0.5%添加组的吞噬指数较高外,第1周、第2周和第4周1.5%添加组的吞噬指数都显著高于其它组(P<0.05)。
2.3 攻毒试验
用含中草药复方制剂的饲料投喂仿刺参4周后,再用黄海希瓦氏菌对各组仿刺参进行人工感染。结果表明:第1天,对照组仿刺参表现为附着能力差,蜷缩在槽底,而3个不同浓度中草药添加组的仿刺参仍有良好的活动性,几乎全附着在水槽侧壁;对照组仿刺参在感染3 d后全部死亡,而摄食添加中草药饲料的各组仿刺参死亡率较对照组均有所降低,复方中草药对仿刺参相对保护率的影响结果见图3。方差分析结果显示,复方中草药对仿刺参免疫保护率的影响显著(P<0.05)。感染第1天,0.5%添加组免疫保护率最低,为33.3%;第2天,2.5%添加组免疫保率小于其它2个添加组;第3天,1.5%添加组为30%并持续至最后,各组免疫保护率大小依次为0.5%添加组>2.5%添加组>1.5%添加组;第6天,各组免疫保护率均趋于平稳并持续至试验结束,1.5%添加组>0.5%添加组>2.5%添加组,分别为30%、20%和10%。
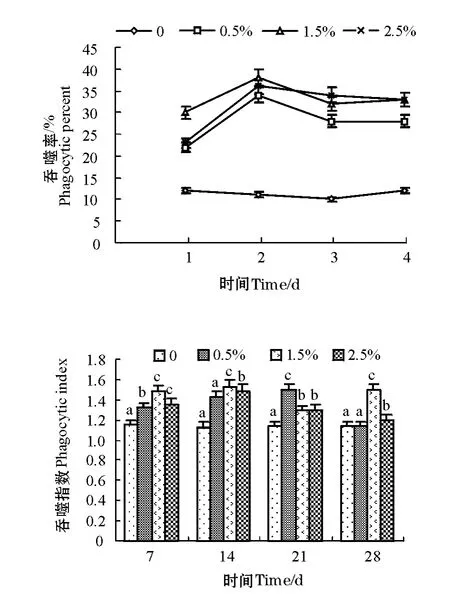
图2 复方中草药对仿刺参体腔细胞的吞噬率和吞噬指数的影响Fig.2 Influence of compound Chinese herbal medicine on phagocytic percentage,and phagocytic index of coelomocytes in the sea cucumber
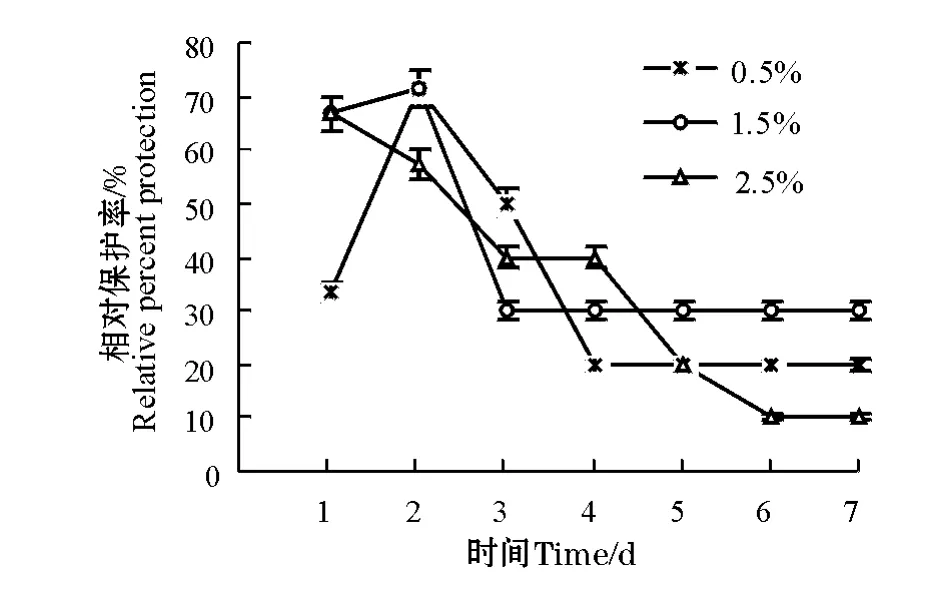
图3 复方中草药对仿刺参免疫保护率的影响Fig.3 Influence of compound Chinese herbal medicine on RPP of the sea cucumber
3 讨论
本试验中按照中医学的理论以黄芪、党参为主药,辅以甘草、当归,又以具抗菌、抗病毒等作用的3味药佐之。结果表明,该中草药复方制剂不仅可以提高仿刺参的非特异性免疫力,而且还可以提高仿刺参的抗病力,说明该中草药复方组方合理,效果显著,可以在仿刺参养殖中推广使用。
免疫促进剂是指具有促进或诱发宿主防御反应、增强生物机体抗病能力的一类物质。很多研究表明,多糖类[10-11]、外源凝集素[12]都可以作为海参的免疫增强剂,益生菌可以提高仿刺参幼参的消化酶活性和成活率,并有促生长作用[13]。中草药具有成本低、药效好、无残留的特点,可作为免疫增强剂添加在仿刺参饲料中,对于提高仿刺参的非特异性免疫力、减少疾病的发生有一定作用。如孟庆大等[14]针对仿刺参腐皮综合征筛选出由当归、川芎、刺五加、穿心莲、大蒜、甘草等8味中药组成的中草药免疫增强剂,其具有较好的免疫增强作用。经过前期筛选,本试验中设计了一组中药复方,其主药之一为黄芪。多糖是黄芪的主要活性成分之一,另外还含有黄酮、胆碱、氨基酸、蔗糖、微量叶酸及微量元素等物质[15]。刘红柏等[16]的研究证实,黄芪能够不同程度地增强史氏鲟的非特异性免疫力;而黄芪皂苷在抗氧化、抗衰老、抗肿瘤及增强免疫等方面也有显著活性[17]。郭文婷等[18]以黄芪为主药,配以霪羊藿、党参、大黄等中草药添加到饲料中投喂对虾,发现试验组虾酚氧化酶、过氧化氢酶和抗菌活力都显著高于对照组。
抗菌活力是水产动物非特异性免疫的一个重要指标,能够综合反映机体应对外来刺激时产生抗菌物质的活性,也是衡量免疫功能和机体状态的指标,反映了机体对外源微生物侵染的防御能力[19]。本试验中以黄芪、党参为主药投喂刺参,结果发现:该复方可显著提高仿刺参各组织的抗菌活力,其中肠组织中的抗菌活力提高幅度最为明显,且各组织的抗菌活力以2.5%添加组的最高,1.5%组次之,而对照组在试验过程中始终处于相对较低的水平。纵观整个试验过程,随着试验时间的延长,每组仿刺参各组织的抗菌活力均呈持续增长趋势,说明所用复方中草药添加剂可明显增强机体对外源微生物的防御能力,增进仿刺参的非特异性免疫功能。
体腔细胞在抵御外来异物的侵入过程中显得极为重要[20],体腔细胞的吞噬作用是机体免疫防御的主要手段[21]。中草药对细菌和病毒的作用机理表现在,一部分中草药是直接抵制作用于细菌和病毒,而其它大多数中草药是增强器官组织的屏障防御及细胞的吞噬功能,对机体的机能紊乱进行调整和增强机体对病害刺激的抵抗力[22]。Santiago等[4]向海参Holothuria glaberrima体腔中注射一定剂量的脂多糖,能增强体腔细胞的吞噬活性。Sun等[23]研究了黄芪多糖对仿刺参免疫的影响,结果表明,黄芪多糖能促进仿刺参体腔细胞的吞噬能力。本试验中所用复方中草药是以黄芪为主药,经过4周投喂,可明显提高仿刺参体腔细胞的吞噬能力,这与Sun等[23]的研究结果相一致。仿刺参体腔细胞吞噬率的显著增加是仿刺参免疫能力增强的重要标志。简纪常等[24]也证实,以黄芪为主药,当归为辅药配伍的中药方剂,能明显提高建鲤的吞噬细胞、中性粒细胞和巨噬细胞的数量及血清中溶菌酶的活力。本试验结果表明,1.5%添加组效果最为明显,投喂第2周中草药各浓度组的仿刺参体腔细胞吞噬率均达峰值,各组仿刺参的体腔细胞吞噬力随着时间的延长先升高、后降低至平稳。仿刺参体腔细胞的吞噬能力在第3周开始下降并保持平稳,其原因可能与长时间投喂免疫增强剂有关。Chang等[25]认为,在持续投喂免疫增强剂的情况下,机体免疫指标由上升至高峰再转为下降,是由于长期投喂免疫增强剂而导致的“免疫疲劳”。
动物机体免疫力的高低会直接影响其抗病力。已有文献报道,在饲料中添加复合中草药制剂能显著提高凡纳滨对虾的抗病力[26]。邹明泉等[27]应用大黄、海藻碘及莨菪碱等多种中草药防治鱼病,经室内及室外生产性防治试验证明,对草鱼出血病有疗效,可使养殖鱼类的成活率提高17.7%~30%。陈效儒等[5]通过注射仿刺参腐皮综合征致病菌灿烂弧菌Vibrio splendidus进行仿刺参的攻毒试验,攻毒后14 d内对照组累计发病率为38.3%,显著高于200 mg/kg添加组(26.7%)。本试验结果显示,对照组仿刺参在3 d内全部死亡,感染后第7天, 0.5%与2.5%添加组相对保护率分别为20%、10%;1.5%添加组抗病效果较显著,其相对保护率可达到30%,说明饲料中添加复方中草药制剂,可以明显提高仿刺参的抗病能力。
综上所述,所用复方中草药制剂可以显著提高仿刺参各组织的抗菌活力及仿刺参体腔细胞的吞噬能力。攻毒试验也进一步证明,该复方中草药制剂可明显增强仿刺参的抗病力。由此说明添加该复方中草药制剂不但能增强仿刺参的非特异性免疫力,而且也能提高仿刺参抵抗病原菌的抗病力。综合试验指标的变化趋势,建议在生产中采用1.5%的剂量添加、投喂3周较好。关于此复方中草药的具体作用机理以及各组分的确切作用还需进一步研究。
[1] 姜健,杨宝灵,邰阳.海参资源及其生物活性物质的研究[J].生物技术通讯,2004,15(5):537-540.
[2] 常亚青,丁君,宋坚,等.海参、海胆生物学研究与养殖[M].北京:海洋出版社,2004.
[3] 王海华,曹义虎,陈长水.中药免疫增强剂在水产养殖上的应用及免疫药理学研究进展[J].中国兽医杂志,2005,41(5):42 -44.
[4] Santiago-Cardona P G,Berrios C A,Ramirez F,et al.Lipopolysaccharides induce intestinal serum amyloid A expression in the sea cucumber Holothuria glaberrima[J].Developmental and Comparative Immunology,2003,27:105-110.
[5] 陈效儒,张文兵,麦康森,等.饲料中添加甘草酸对刺参生长、免疫及抗病力的影响[J].水生生物学报,2010,34(4):731-738.
[6] 王印庚,冷敏,陈霞,等.中草药对刺参腐皮综合征病原菌的体外抑菌试验[J].渔业科学进展,2009(2):1-7.
[7] Hultmark D.Insect immunity:Purification and properties of three inducible bactericidal proteins from hemolymph of immunized pupae of Hylophora ceropia[J].European Journal of Biochemistry, 1980,106(1):7-16.
[8] 雷质文,黄捷,杨冰,等.96孔酶标板法测定中国对虾血淋巴上清液抗菌活力和酚氧化酶活性的初步研究[J].海洋湖沼通报,2001(4):33-37.
[9] Li H,Qiao G,Li Q,et al.Biological characteristics and pathogenicity of a highly pathogenic Shewanella marisflavi infected sea cucumber(Apostichopus japonicus)[J].Journal of Fish Diseases, 2010,33:865-877.
[10] 马跃华,胡守义.免疫多糖投喂海参幼体试验[J].河北渔业, 2006(7):22-23.
[11] 刘云,孔伟丽,姜国良,等.2种免疫多糖对刺参组织主要免疫酶活性的影响[J].中国水产科学,2008,15(5):787-793.
[12] 熊川男,李伟,白雪芳,等.凝集素作为海参免疫增强剂在人工养殖海参中的应用[J].水产养殖,2005,26(18):30-32.
[13] 袁成玉,张洪,吴垠,等.微生态制剂对幼刺参生长及消化酶活性的影响[J].水产科学,2006,25(12):612-615.
[14] 孟庆大,杨海燕,付本懂,等.中草药免疫增强剂在刺参养殖中的应用研究[J].中兽医医药杂志,2008(2):38-40.
[15] 李鹏飞,杜海燕,赵盂春.黄芪多糖的化学和免疫学研究[J].上海畜牧兽医通讯,2005(5):4-6.
[16] 刘红柏,卢彤岩,张春燕,等.黄芪对史氏鲟抗氧化能力及免疫力的影响[J].大连水产学院学报,2006,21(3):231-235.
[17] 杨再,陈佳铭,黄顺捷,等.黄芪提取物的生物活性研究[J].新饲料,2007(8):27-29.
[18] 郭文婷,李健.中草药制剂对凡纳滨对虾生长及血淋巴中免疫因子的影响[J].饲料工业,2005,26(6):6-10.
[19] Boman H G.Immune Reaction to Parasites[M].New York: Gustray Fischverlag,1982.
[20] 宋志东,王际英,张利民.棘皮动物的免疫防御机制[J].齐鲁渔业,2009,26(7):24-26.
[21] 蔡美英.医学免疫学[M].北京:科学出版社,2002.
[22] Silva J R M C,Peck L.Induced in vitro phagocytosis of the Antarctic starfish Odontaster validus(Koehler 1906)at 0℃[J].Polar Biology,2000(4):225-230.
[23] Sun Y X,Jin L J,Wang T T,et al.Polysaccharides from Astragalus membranaceus promote phagocytosis and superoxide anion (O2)production by coelomocytes from sea cucumber Apostichopus japonicus in vitro[J].Comparative Biochemistry and Physiology Part C:Toxicology&Pharmacology,2008,147(3):293-298.
[24] 简纪常,吴灶和.中草药对建鲤非特异性免疫功能的影响[J].大连水产学院学报,2002,17(2):114-119.
[25] Chang C F,Chen H Y,Su M S.Immunomodulation by dietary β-1,3-glucan in the brooders of the black tiger shrimp Penaeus monodon[J].Fish&Shellfish Immunology,2000,10:505-514.
[26] 周歧存,罗从彦,韩兆红.复合中草药制剂对凡纳滨对虾生长及抗病力的影响[J].绿色饲料添加剂与饲料安全,2006(9): 53-56.
[27] 邹明泉,潘恒玑.中草药防治鱼病的理论与实践[J].鱼类病害研究,1992,14(3):5-13.
Effects of a compound Chinese herbal medicine on immunity and disease resistance in sea cucumber Apostichopus japonicus
WU Ya-nan,LIU Peng,LI Qiang,JIANG Chuan-jun,LI Hua
(Key Laboratory of Mariculture,Agriculture Ministry,PRC,Dalian Ocean University,Dalian 116023,China)
The sea cucumber Apostichopus japonicus was fed the diets containing a compound Chinese herbal medicine combined with Astragalus,and Codonopsis at a dose of 0%,0.5%,1.5%or 2.5%for 7,14,21 and 28 days,and were analysed for several immune parameters in different tissues.After acclimated for 28 days,the sea cucumber was injected 0.1 mL of bacterial suspension of Shewanella marisflavi in the back at concentration of 7×108cells/mL.The daily symptoms and mortality were recorded for 7 days to calculate the relative percent protection(RPP).The results showed that there were significant influence of Chinese herbal medicine on antibacterial activity(Ua)in different tissues and phagocytic function in coelomocytes(P<0.05).The Ua was shown to increase with time proceeded and increase in concentration of the compound Chinese herbal medicine.There was a tendency of first increase and then decrease in phagocytic function in the coelomocytes,with the peak value at 14 or 21 days. Both the peak activities of Ua and PP in the coelomocytes were observed at the drug concentration of 1.5%,followed by at 2.5%,0.5%and then at 0%.The challenge test showed that the sea cucumber in the control group was all death 3 days after the infection while the relative percent protection was 30%in the 1.5%group,20%in the 0.5%group and 10%in the 2.5%group 7 days after the infection.It is suggested that the Chinese herbal medicine can significantly improve the immunity and disease resistance in the sea cucumber at the optimum concentration of 1.5%.
Chinese herbal medicine;Apostichopus japonicus;phagocytosis;antibacterial activity;relative percent protection
S948
A
2095-1388(2011)04-0338-06
2010-09-23
国家“十二五”科技支撑计划项目(2011BAD13B03);海洋公益性行业科研专项(200905020);国家自然科学基金资助项目(30800853);大连市科技攻关项目(2004B1NC030,2006B11NC109)
吴亚楠(1985-),女,硕士研究生。E-mail:jzlwnwyn@163.com
李华(1958-),女,教授。E-mail:lihua@dlou.edu.cn
