恩诺沙星在杂交鲟体内的药物代谢动力学
2011-03-18郭娇娇潘红艳杨虎廖鑫宫智勇李谷
郭娇娇,潘红艳,杨虎,廖鑫,宫智勇,李谷
(1.武汉工业学院食品科学与工程学院,湖北武汉430023;2.中国水产科学研究院长江水产研究所,湖北荆州434000)
恩诺沙星在杂交鲟体内的药物代谢动力学
郭娇娇1,潘红艳1,杨虎1,廖鑫1,宫智勇1,李谷2
(1.武汉工业学院食品科学与工程学院,湖北武汉430023;2.中国水产科学研究院长江水产研究所,湖北荆州434000)
采用高效液相色谱法,研究在单次口灌给药途径下,恩诺沙星在杂交鲟(施氏鲟Acipenser schrenckii♂×达氏鳇Huso dauricus♀)体内的药代动力学。对杂交鲟单次口灌给药恩诺沙星10 mg/kg后,用3P97药代动力学分析软件对实验数据进行了分析。结果表明:恩诺沙星在杂交鲟血液、肌肉和肝脏中的药物时量曲线关系符合一级吸收的二室开放模型;该药在血液、肌肉和组织中的平均回收率分别为93.6%±1.14%、92.65%±1.5%、92.82%±1.39%,在杂交鲟不同组织中分布较广,其在血液、肌肉和肝脏的表观分布容积v/f分别为26.987、6.2298、2.1515 L/kg;恩诺沙星在杂交鲟体内消除较慢,在血液、肌肉和肝脏中的消除半衰期分别为290.139、114.9、901.835 h,总体清除率分别为0.2288、0.1047、0.02164 L/(kg·h)。鉴于恩诺沙星在杂交鲟体内消除较慢,建议养成阶段使用其它药物。
杂交鲟;恩诺沙星;药代动力学
恩诺沙星(Enrofloxacin)又名乙基环丙沙星、乙基环丙氟哌酸,是人工合成的第三代喹诺酮类化合物(Quinolone)——氟喹诺酮类药物(Ftuoroquinolones)的一种,是畜禽和水产专用抗菌药物,对大多数革兰氏阴性菌、部分革兰氏阳性菌及某些支原体、衣原体、立克次氏体等均有效[1]。因其高效广谱、耐药菌少、抗菌力强、作用迅速且与其它抗菌药无交叉耐药性而被广泛应用于畜禽和水产养殖中感染性疾病的防治[2]。该药的作用机理是:药物直接作用于细菌的细胞核,抑制细菌的DNA旋转酶,对染色体造成不可逆的损坏,通过阻止细菌细胞的分裂,从细胞核深处破坏细菌的代谢和增殖,能迅速杀死细菌,杀菌效果稳定[3]。
药物在生物体内的代谢过程和消除规律是制定给药方案和休药期的理论基础,目前关于恩诺沙星作用于水产养殖动物药代动力学方面的研究较多,如鲤Cyprinus carpio[4]、舌齿鲈Dicentrarchuslabrax[5]、眼斑拟石首鱼Sciaenops ocellatus[6]、欧洲鳗鲡Anguilla[7]、大黄鱼Pseudosciaena crocea[8]、中国对虾Penaeus chinensis[9]、中华绒螯蟹Eriocheir sinensis[10]等,但尚未见关于杂交鲟体内恩诺沙星药代动力学方面的报道。为此,本试验中作者建立了恩诺沙星在杂交鲟体内的检测方法,同时研究了恩诺沙星在杂交鲟体内的药代动力学规律,以期为检测恩诺沙星在水产动物体内的残留及在养殖中的合理使用提供参考资料。
1 材料与方法
1.1 材料
1.1.1 试验鱼 试验用杂交鲟(施氏鲟Acipenser schrenckii♂×达氏鳇Huso dauricus♀)购自中国水产科学研究院长江水产研究所窑湾试验场,体质量为(80±10)g。
1.1.2 药品与试剂 恩诺沙星标准品纯度≥99% (Sigma公司);体积分数为50%的HCl、柠檬酸、乙酸铵、无水硫酸钠、乙腈(HPLC)、正己烷和盐酸均为分析纯。酸化乙腈为φ(乙腈)∶φ(体积分数为50%盐酸)=2500∶20。将0.05 mol/L的柠檬酸与0.01 mol/L的醋酸铵混合,配制成柠檬酸-醋酸铵混合溶液,保存于冰箱(2~8℃)中[11]。
1.1.3 仪器 试验仪器包括:Varian 920-LC高效液相色谱仪配有荧光检测器;FA2104N电子天平(上海民桥精密科学仪器有限公司生产);涡旋混合器XH-C(金坛市医疗仪器厂生产);CQ250超声波(上海声源超声波仪器设备有限公司生产);高速冷冻离心机2-16k(Sigma公司);FJ-200高速分散均质机(上海标本模型厂生产);0.22 μm微孔滤膜。
1.2 方法
1.2.1 暂养 试验前将杂交鲟于室内玻璃水族箱(120 cm×60 cm×80 cm)中暂养1周,投喂不含任何药物的饲料。选择健康个体进行试验,试验前24 h停止喂食。试验期间,持续曝气并对水体进行循环过滤,水温为(20±1)℃。每日早晚投喂适量杂交鲟饲料,及时排除残饵和粪便,保持水质清洁。试验期间杂交鲟的成活率为100%。
1.2.2 药饵配制及给药方法 恩诺沙星口灌药液的配制:用生理盐水将恩诺沙星配成浓度为2 mg/mL的溶液。将医用静脉注射导管分切成15 cm左右长度的短管,接于1 mL注射器端口。定量抽取恩诺沙星溶液,按10 mg/kg鱼体重单次灌药。灌喂时将软管小心地插入鱼胃部,注意插入的深度,防止将胃部捅破。
1.2.3 样品采集 给药前先采一组空白样,然后于喂药后的0.5、1、2、3、4、6、8、10、12、24、36、48、72、96、120、240、360、480、720、960、1 200 h采集样品。每次采集3条杂交鲟,用一次性注射器于尾静脉采血,加入质量分数为1%的肝素钠,以8 000 r/min离心5 min,分离血浆。采血后将鱼处死,取肝脏、背部肌肉,于-20℃下保存备用。
1.2.4 样品处理 从冰箱中取出血浆样品,恢复至4℃,取1 mL血浆置于10 mL塑料离心管中,加入适量的无水硫酸钠,再加入3 mL酸化乙腈,均质提取1 min(以8 000 r/min离心5 min);取上清液置于10 mL的尖底玻璃管中,往残渣中重复加入3 mL酸化乙腈,重复上述操作一次,合并上清液于尖底玻璃管中,然后置于氮吹仪上于60℃水浴中吹干;用1.0 mL流动相溶解干燥物,在漩涡振荡器上振荡3 min,直至残留物完全溶解。加入正己烷2 min,在漩涡振荡器上振荡5 min,静置分层,弃上清液,重复加入2 min正己烷一次,重复上述操作。然后用0.22 μm微孔滤膜过滤后,用于高效液相色谱分析。各取肌肉和肝脏样品1 g,处理方法同上。
1.2.5 色谱条件[11]色谱柱C18(5 μm,4.6 mm×250 mm);荧光检测器激发波长为280 nm、发射波长为450 nm;流动相为φ(柠檬酸-醋酸铵混合盐溶液)∶φ(乙睛)=80∶20,柱温为30℃,流速为1 mL/min,进样体积为20 μL。
1.2.6 标准曲线的绘制 精确称取恩诺沙星标准品0.01 g,用流动相溶解定容至100 mL容量瓶中,配成100 μg/mL的标准储备液,再用流动相将标准储备液分别配成0.005、0.01、0.02、0.03、0.05、0.1、0.2、0.5、1、2、5、10 μg/mL的标准溶液,过0.22 μm滤膜上机测定,绘出标准曲线,得到回归方程和相关系数。
1.2.7 回收率的测定 取0.1、0.5、1.0 μg/mL标准储备液0.5 mL,加入空白血浆0.5 mL,混匀,静置2 h,按样品处理方法进行提取和测定,根据标准曲线回归方程计算恩诺沙星的浓度,与原来标准储备液的浓度比较计算相对回收率。即用相同方法可测得肝脏和肌肉组织中的相对回收率。

1.3 数据处理
药物动力学模型拟合及相关参数计算采用3P97药代动力学程序软件处理。
2 结果
2.1 液相色谱的检测方法
恩诺沙星浓度为0.005~10 μg/mL时呈良好的线性关系,相关系数r=0.9998,线性方程为y= 412.11x+1.8749。肌肉、血液和肝脏中的相对回收率均在90%以上,结果见表1。
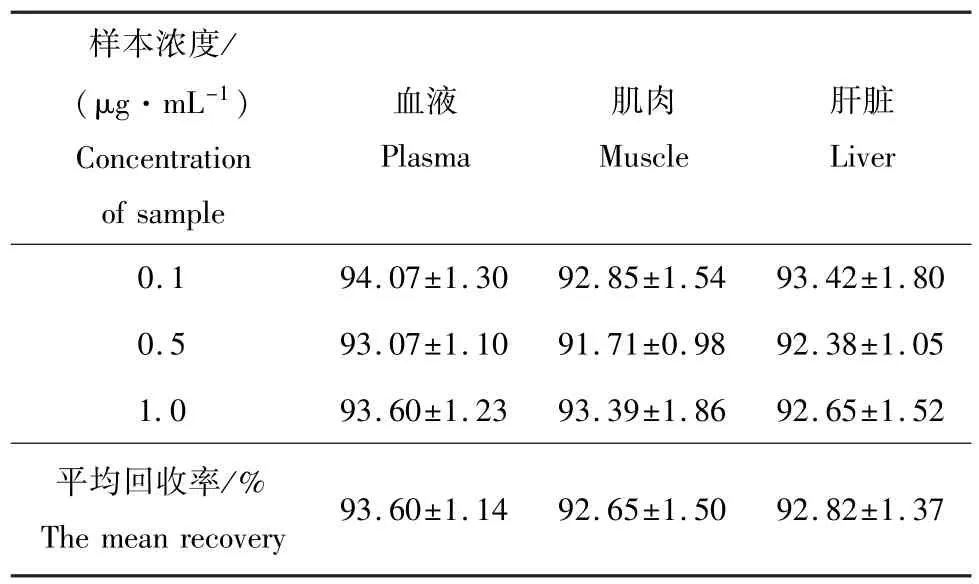
表1 血液及组织中恩诺沙星的相对回收率(¯x±s,n=3)Tab.1 Relative recovery rate of Enrofloxacin in the sturgeon plasma and tissues%
2.2 恩诺沙星在杂交鲟体内的药代动力学
2.2.1 恩诺沙星在杂交鲟体内的药物浓度与时间的关系 恩诺沙星在杂交鲟肌肉、血液和肝脏中的药物浓度与时间的关系见图1。从图1可见,在吸收阶段(1 h内),血液、肌肉和肝脏对药物的吸收迅速,而在消除阶段比较缓慢,利用率不高。
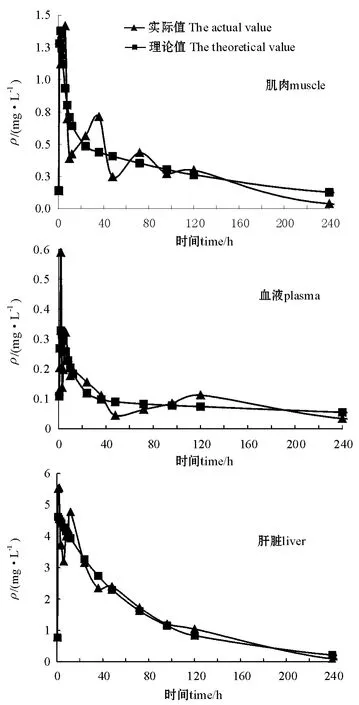
图1 口灌恩诺沙星在肌肉、血液和肝脏中的药时曲线Fig.1 The relationship between Enrofloxacin concentration and time in the muscle,plasma,and liver of the sturgeon administrated orally
恩诺沙星在吸收阶段药物浓度波动比较大,这可能与取样不连续(采样时间间隔长),且对样品的处理不能迅速完成有关。同时,在样品检测时发现,鱼体存在药物代谢的个体差异。在数据处理过程中,本试验中采取多次测定取相近值的方法得出最后数据。从药时曲线图(图1)可以看出,恩诺沙星在杂交鲟体内的代谢符合药物代谢动力学的普遍规律。
在药时曲线中出现多峰现象,这与一些研究结果相符[5,11-14],证明恩诺沙星在杂交鲟体内的再吸收是存在的。
2.2.2 恩诺沙星的药物代谢动力学规律 将恩诺沙星以10 mg/kg剂量灌喂给药,单次给药后,采集血液及组织处理,经高效液相色谱检测,再经3P97药物代谢动力学软件分析,采用简单模式,以均数值计算并自动拟合,采用Marquardt法对一、二、三房室分别以权重1、1/C、1/C/C三种情况进行曲线拟合,根据WSS与AIC值来判断最佳药代动力学模型,最后得出肌肉、血液和肝脏中的药物代谢动力学参数,根据参数可推出药物浓度与时间的关系方程(表2)。恩诺沙星在肌肉、血液和肝脏中的代谢动力学参数见表3。

表2 给药后杂交鲟的血液和组织中药物浓度与时间关系的方程Tab.2 The equation between Enrofloxacin concentration and time in the sturgeon plasma and tissue by single oral administration
经软件处理之后,恩诺沙星在杂交鲟肌肉、血液和肝脏中的代谢均属于一级吸收的二室开放模型。一般认为,表观分布容积v/f值越大,药物穿入组织越多,分布越广,血中的药物浓度越低,反之,则相反。研究表明,当v/f接近于(0.8~1.0)L/kg时,药物在体内分布广泛且分布均匀;而v/f大于1 L/kg时,则表明药物的组织浓度高于血浆浓度,药物在体内分布广泛或者说明组织蛋白对药物有高度的结合。本试验中v/f均大于1,说明恩诺沙星在杂交鲟体内分布广泛。
本研究结果表明,恩诺沙星在各组织中吸收较迅速,由消除率及消除半衰期可知,恩诺沙星在组织中的代谢较为缓慢,这与实际检测中20 d后恩诺沙星仍有少量残留相符合。
3 讨论
3.1 关于流动相的选择
陈雪昌等[15]通过多次比较试验,最终确定流动相为φ(乙腈)∶φ(柠檬酸-醋酸铵混合盐溶液)=20∶80时,用三乙胺调节流动相的pH为4.5,恩诺沙星和杂质峰分离效果好,峰形也比较理想[10,15]。若用甲醇代替乙腈,在流速为1.0 mL/min时,整个体系的压力将超过15.2 MPa,对仪器使用有一定的影响。

表3 给药后杂交鲟肌肉、血液和肝脏中药物代谢动力学参数Tab.3 Pharmacokinetic parameters of Enrofloxacin in the sturgeon plasma and tissue by single oral administration
3.2 关于休药期
休药期是指食用动物组织中的残留低于组织中允许的最大残留限量的时间。本研究结果表明,给药后20 d时,恩诺沙星在杂交鲟血液、肌肉和肝脏中的残留量为0.0325、0.03、0.08 μg/mL。2001年中国农业部制定的《无公害食品水产品中渔药残留限量》[16]中规定,恩诺沙星和环丙沙星在水产动物中的最大残留限量为0.05 μg/g,因此建议临床给药(恩诺沙星的剂量为10 mg/kg)时,经口单次灌喂后的休药期至少为20 d以上。
3.3 恩诺沙星的抗菌活性与药效学
Bowser等[17]研究了用恩诺沙星和恶喹酸治疗杀鲑气单胞菌的效果,结果表明,用恩诺沙星治疗鱼类细菌感染疾病临床效果较好。张雅斌等[4]研究了恩诺沙星在鲤体内的药效学及药动力学,结果表明:该药物对淡水养殖鱼类常见的5种致病菌——苏伯利产气单胞菌Aerormonas sobria、点状产气单胞菌点状亚种Aeronwnas punctata puctata、荧光假单胞菌Pseudomonas fluorescens、鱼害黏球菌Myxococcus piscicola、肠型点状产气单胞菌Aeromonas punctata f.intestinalis均具有较强的抗菌作用,最小抑菌浓度(MIC)分别为0.02、0.04、0.63、0.31、0.04 μg/mL,尤其是细菌出血性败血病致病菌——苏伯利产气单胞菌对恩诺沙星具有高度的敏感性;体外药效试验得知,每日以10 mg/kg剂量混饲口灌给药,能有效的杀灭致病菌,提高感染鱼的成活率。本研究结果和众多研究结果均表明,恩诺沙星对常见的病原菌具有较好的抗菌效果。
3.4 与其它药动学的比较
李春雨等[18]研究了恩诺沙星在鲤体内的药动力学,结果表明口灌给药后,鲤血浆、肝脏、肾脏和肌肉组织中的药时曲线符合一级消除二室模型。灌服给药的血浆动力学参数:AUC为600.2961 μg/(h·mL)、Ka为0.1693 h-1、t1/2β为168.2871 h、Tp为3.6655 h、Cmax为3.2661 μg/mL。简纪常等[6]研究了恩诺沙星在眼斑拟石首鱼体内的药物代谢动力学,结果表明灌服组血浆的药时数据符合一级吸收一室模型,动力学方程为C=61482 (e-71092t-e-101356t),其主要药代动力学参数:AUC为15.805 mg/(L·h)、Cmax为2.770 mg/L、Tmax为1.500 h、t1/2α为4.989 h、v/f为2.072 L/kg、Ka为7.092 h-1。与之相比,恩诺沙星在杂交鲟血浆中的达峰时间Tp为2.01 h,达峰浓度Cmax为0.3275 μg/mL,AUC为43.71 mg/(L·h)。上述研究表明,恩诺沙星在不同种属鱼体间存在一定的差异,特别是达峰浓度差异较大,这可能与给药浓度、给药方式、温度等有关,但恩诺沙星在大多数鱼体内的吸收程度较好。
致谢:本试验在武汉工业学院动物营养与饲料科学湖北省重点实验室的协助下完成,在此表示感谢!
[1] 应翔宇,杨永胜.兽用新型抗菌药物——恩诺沙星[J].中国兽药杂志,1995,29(3):53-56.
[2] Dowling P M,Wilson R C,Tyler J W,et al.Pharmacokinetics of ciprofloxacin in ponies[J].Journal of Veterinary Pharmacology and Therapeutics,1995,18(1):7-12.
[3] Vancutsem P M,Babish J G,Schwark W S,et al.The Fluoroquinolone antimicrobials:structure,antimicrobial activity,pharmacokinetics,clinical use in domestic animals and toxicity[J].Cornell Veterinary,1990,80(2):173-186.
[4] 张雅斌,刘艳辉,张祚新,等.恩诺沙星在鲤体内的药效学及药动力学研究[J].大连水产学院学报,2004,19(4):239-242.
[5] Intorre L,Cecchini S,Bertini S,et al.Pharmacokinetics of enrofloxacin in the seabass(Dicentrarchus labrax)[J].Aquaculture, 2000,182(1-2):49-59.
[6] 简纪常,吴灶和,陈刚.恩诺沙星在眼斑拟石首鱼体内的药物代谢动力学[J].中国兽医学报,2005,25(2):195-197.
[7] 房文红,于慧娟,蔡友琼,等.恩诺沙星及其代谢物环丙沙星在欧洲鳗鲡体内的代谢动力学[J].中国水产科学,2007,14(4): 622-629.
[8] 刘玉林,王翔凌,杨先乐,等.诺氟沙星在大黄鱼体内的药代动力学及残留研究[J].水产学报,2007,31(5):655-660.
[9] 方星星,王群,李健.恩诺沙星及其代谢物环丙沙星在中国对虾体内的药代动力学[J].水产学报,2004,28(增刊):35-41.
[10] 郑宗林,唐俊,喻文娟,等.RP-HPLC法测定中华绒螯蟹主要组织中的恩诺沙星及其代谢物[J].上海水产大学学报,2006, 15(2):156-162.
[11] Horsberg T E,Hoff K A,Nordm O R.Pharmacokinetics of florfenicol and its metabolite florfenicol amine in Atlantic salmon[J]. Journal of Aquatic Animal Health,1996,8:292-301.
[12] 李美同,郭文林,仲锋,等.土霉素在鳗鲡组织中残留的消除规律[J].水产学报,1997,21(1):39-43.
[13] Bjorklund H V,Eriksson A,Bylund G.Temperature-related absorption and excretion of oxolinic acid in rainbow trout(Oncorhynchus mykiss)[J].Aquaculture,1992,102(1-2):17-27.
[14] Park B K,Lim J H,Kim M S,et al.Pharmacokinetics of florfenicol and its metabolite,florfenicol amine,in the Korean catfish[J]. Journal of Veterinary Pharmacology and Therapeutics,2006,29 (1):37-40.
[15] 陈雪昌,郑代明,金彩杏.高效液相色谱法同时测定水产品中盐酸环丙沙星和恩诺沙星残留量[J].科技论坛,2005,14:16-17.
[16] NY 5070.无公害食品水产品中渔药残留限量[S].2001.
[17] Bowser P R,Schachte J J H,Wooster G A,et al.Experimental treatment of Aeromonas salmonicida infections with enrofloxacin and oxolinic acid:field trials[J].Journal of Aquatic Animal Health,1990,2:198-203.
[18] 李春雨,李继昌,卢彤岩,等.不同给药方式下恩诺沙星在鲤体内的药动学研究[J].集美大学学报,2009,14(3):8-13.
Pharmacokinetics of enrofloxacin in sturgeon Acipenser schrenckii
GUO Jiao-jiao1,PAN Hong-yan1,YANG Hu1,LIAO Xin1,GONG Zhi-yong1,LI Gu2
(1.College of Food Science and Engineering,Wuhan Polytechnic University,Wuhan 430023,China; 2.Yangtze River Fisheries Research Institute,Chinese Academy of Fishery Sciences,Jingzhou 434000,China)
The pharmacokinetics of enrofloxacin in the sturgeon Acipenser schrenckii administrated by oral gavage at a dos of 10 mg/kg was investigated using the HPLC and by pharmacokinetics software 3P97.The concentrations versus time in plasma,muscle and liver in the sturgeon were well described by a two-department open model with first-order absorption,with the average enrofloxacin recovery of 93.6%±1.14%in plasma,92.65%±1.5%in muscle,and 92.82%±1.39%in liver.The enrofloxacin in the sturgeon had the ability to be widely distributed to diverse tissues.The apparent volume of distribution was found to be 26.987 L/kg in the plasma,6.2298 L/kg in the muscle and 2.1515 L/kg in the liver.The enrofloxacin elimination was found slowly,the elimination half-life (T1/2β)of 290.139 h in the plasma,114.9 h in the muscle and 901.835 h in the liver,and the total body clearance(CL/f(s))of 0.2288 L/(kg·h)in the plasma,0.1047 L/(kg·h)in the muscle and 0.02164 L/(kg·h)in the liver.So we suggest that other antibacterial drugs be used to prevent and treat bacterial diseases in the process of sturgeon growth on.
Acipenser schrenckii;enrofloxacin;pharmacokinetics
S965
A
2095-1388(2011)04-0362-05
2010-10-13
国家科技支撑计划项目(2007BAD37B05,2009BADB9B02);武汉工业学院校研究生创新基金资助项目(09CX014)
郭娇娇(1985-),女,硕士研究生。E-mail:guojiaojiao3344@126.com
宫智勇(1966-),男,副教授,博士。E-mail:zhiyong-gong@yahoo.com.cn
