仿刺参水管系统与体腔间物质交换问题探究
2023-07-22范栩源王振辉国丽媛孙启睿王轶南
范栩源,王振辉,任 媛,3,国丽媛,孙启睿,王轶南,李 强
( 1.大连海洋大学,辽宁 大连 116023; 2.盐城工学院 海洋与生物工程学院,江苏 盐城 224051;3.大连理工大学 生物工程学院,辽宁 大连 116024 )
仿刺参(Apostichopusjaponicus)属棘皮动物门海参纲,处于从无脊椎动物向脊椎动物分化的独特进化阶段,是棘皮动物门中经济意义较大的一个类群,也是国内外重要的海产经济物种[1]。仿刺参体腔中充满了体腔液,其中悬浮着不同种类的体腔细胞[2],这些体腔细胞在抵御外来异物入侵等免疫反应中显得极为重要,充当了关键的角色[3-4]。仿刺参具有复杂的水管系统,具有运动、呼吸和排泄等功能,其是一个由体腔产生的充满液体的管道网络,主要由石管、环状水管和辐水管组成。石管嵌在背悬肠膜内,末端成为筛板,仿刺参的筛板生在体腔内,因而水管内的液体来自于体腔液[5-7]。已有研究表明,仿刺参水管系统内也悬浮有大量体腔细胞,细胞密度约为体腔中的一半,细胞种类与体腔中的细胞相同,但不同种类的细胞比例存在显著差异[8];同时,仿刺参水管系统内体腔液上清中酸性磷酸酶、碱性磷酸酶、超氧化物歧化酶和过氧化氢酶等免疫酶活性与体腔内该物质也存在显著差异[9]。由此可见,仿刺参的水管系统和体腔间并不是无限畅通的。
为进一步探究仿刺参水管系统与体腔的关联性及连通性,笔者分别利用天然色素(甜菜红)、生物大分子[抗谷胱甘肽巯基转移酶(GST)标签重组蛋白]、无活性外源颗粒物(荧光微球)、病原菌[灿烂弧菌(Vibriosplendidus)]及非致病菌[大肠杆菌(Escherichiacoli)]等物质进行仿刺参体腔注射,检测不同时间点上述物质在仿刺参体腔中和水管系统(以波里氏囊为代表)内的分布,以期探究仿刺参水管系统与体腔间物质交换问题。
1 材料与方法
1.1 试验材料
试验用仿刺参购于山东日照某养殖场,体质量(65±10) g,置于60 cm×30 cm×40 cm 塑料水族箱内暂养,养殖用水为盐城市射阳县海域砂滤海水,盐度28~30,水温16~18 ℃,暂养期间不间断充氧,定期换水,暂养7 d后进行试验。试验用甜菜红购于广州威伦食品有限公司;荧光微球(d=1 μm)购于赛默飞世尔科技有限公司;灿烂弧菌、大肠杆菌由盐城工学院水生动物免疫与疾病研究所保存;GST标签蛋白单克隆抗体购于生工生物工程(上海)股份有限公司。
1.2 仿刺参水管系统与体腔间物质交换分析
1.2.1 体腔注射生物色素
利用提取自甜菜根部的天然着色色素——甜菜红加入无菌海水配制体腔液染色剂母液(称取5 g固体粉末溶于10 mL无菌海水,此时呈现出红色较为鲜艳的液体),将母液稀释2倍进行仿刺参体腔注射(500 μL/头)。分别于注射前和注射后6、12 h解剖仿刺参,每个时间点采集3头,收集体腔液和波里氏囊腔液(简称囊腔液)。具体做法如下:解剖仿刺参,抽取体腔液置于2 mL离心管,3000 r/min(离心半径8.7 cm)离心5 min,收集上清液,以白色为背景色观察体腔液颜色;利用手术线将波里氏囊结扎后,剪下波里氏囊,用无菌磷酸盐缓冲液冲洗后,白色背景板上拍照,同时抽取囊腔液置于2 mL离心管,离心取上清液,以白色为背景色观察囊腔液颜色。
1.2.2 体腔注射GST标签蛋白
利用实验室保藏的含有pGEX-4T-2质粒的BL21感受态细胞对GST标签蛋白进行诱导表达[10],并利用琼脂糖树脂通过亲和层析的方法对表达的蛋白进行纯化,调整蛋白质量浓度至5 mg/mL,进行仿刺参体腔注射(200 μL/头)。分别于注射前和注射后6、12 h解剖仿刺参,每个时间点采集3头,收集体腔液和囊腔液,3000 r/min(离心半径8.7 cm)离心20 min。上清液经SDS-PAGE和蛋白转印后,利用抗GST标签蛋白单克隆抗体通过蛋白免疫印迹试验进行蛋白鉴定和相对定量检测。
1.2.3 体腔注射荧光微球
将荧光微球悬浮液用无菌磷酸盐缓冲液稀释75倍,制备荧光微球稀释液,随后进行仿刺参体腔注射(200 μL/头)。分别于注射前和注射后6、12 h解剖仿刺参,每个时间点采集3头,收集体腔液和囊腔液,制备滴片,荧光显微镜观察、拍照。
1.2.4 体腔注射灿烂弧菌
利用TSB液体培养基进行灿烂弧菌(仿刺参致病菌)活化、培养,以无菌海水为介质制备菌悬液(终密度2×109cfu/mL),进行仿刺参体腔注射(200 μL/头)[11]。分别于注射前和注射后6、12、24、72 h解剖仿刺参,每个时间点采集3头,采集体腔液和囊腔液,无菌条件下在TSA平板上进行细菌涂布,28 ℃恒温倒置培养。
1.2.5 体腔注射大肠杆菌
利用LB液体培养基进行大肠杆菌(仿刺参非致病菌)活化、培养,以无菌磷酸盐缓冲液为介质制备菌悬液(终密度2×109cfu/mL),进行仿刺参体腔注射(200 μL/头)。试验分组和操作同1.2.4。
2 结 果
2.1 生物色素对体腔液着色后示踪“体腔-水管系统”的流通性
通过对仿刺参体腔注射适宜质量浓度的甜菜红溶液6 h和12 h后,解剖仿刺参,发现天然色素已将体腔液完全着色(鲜红色),波里氏囊的外观颜色由注射前的透明色变为鲜红色,由此说明着色的体腔液已经扩散至水管系统内(图1),与此同时,在同一时间点内抽取的体腔液与囊腔液颜色深浅相当(图2),因此判断仿刺参水管系统和体腔间存在液体互通现象。
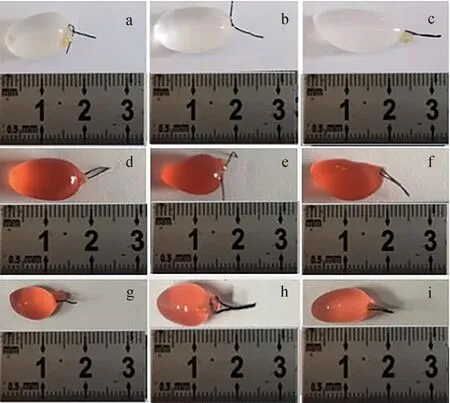
图1 体腔注射甜菜红溶液后仿刺参波里氏囊颜色观察Fig.1 Cystic fluid color observation of polian vesicle in sea cucumber A. japonicus injected with beet red solutiona~c.注射前;d~f.甜菜红注射后6 h;g~i.甜菜红注射后12 h.a—c.without injection;d—f.6 h after injection by beet red solution; g—i.12 h after injection by beet red solution.

图2 注射甜菜红后仿刺参体腔液和波里氏囊腔液颜色对比Fig.2 Color contrast of fluid from coelom and polian vesicle in sea cucumber A. japonicus injection with beet reda1~a3.注射前体腔液;b1~b3.注射前囊腔液;c1~c3.注射后6 h体腔液;d1~d3.注射后6 h囊腔液;e1~e3.注射后12 h体腔液;f1~f3.注射后12 h囊腔液.a1—a3.coelomic fluid from coelom without injection; b1—b3.coelomic fluid from polian vesicle without injection ; c1—c3. coelomic fluid from coelom at 6 h after injection ; d1—d3. coelomic fluid from polian vesicle at 6 h after injection ; e1—e3.coelomic fluid from coelom at 12 h after injection; f1—f3.coelomic fluid from polian vesicle at 12 h after injection.
2.2 体腔注射GST标签蛋白后囊腔液中蛋白示踪
体腔注射GST标签蛋白后6、12 h,收集仿刺参体腔液和囊腔液,通过SDS-PAGE检测发现,与注射前相比,注射GST标签蛋白后仿刺参的体腔液和囊腔液中均有明显蛋白条带增加,分子质量约为26 ku(图3a)。为进一步证明该蛋白为GST标签蛋白,利用抗GST标签蛋白特异性单克隆抗体,通过蛋白免疫印迹试验进行检测,结果显示注射>GST标签蛋白后,仿刺参体腔液中有大量目标蛋白存在,而囊腔液中仅有少量蛋白存在(图3b);利用Graphpad Prism v9.2.0.332软件进行定量统计分析,结果表明,注射后6 h囊腔液中GST标签蛋白含量约为体腔中的12%,注射后12 h约为18%(图4)。


图3 GST标签蛋白注射体腔后在仿刺参体腔液和囊腔液中的分布情况Fig.3 Protein distribution of GST-tag in coelom and polian vesicle in sea cucumber A. japonicus injection with GST-rp1.注射前囊腔液;2.注射前体腔液;3.注射6 h后的囊腔液;4.注射后6 h体腔液;5.注射12 h后囊腔液;6.注射12 h后体腔液;7.GST标签蛋白;M.蛋白标志.1.coelomic fluid from polian vesicle without injection; 2.coelomic fluid from coelom without injection; 3.coelomic fluid from polian vesicle at 6 h after injection; 4.coelomic fluid from coelom at 6 h after injection; 5.coelomic fluid from polian vesicle at 12 h after injection; 6.coelomic fluid from coelom at 12 h after injection; 7.GST-rp;M.protein marker.
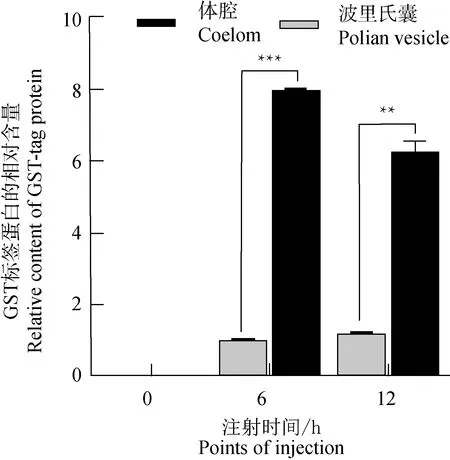
图4 注射不同时间点仿刺参体腔液和囊腔液中GST标签蛋白的相对含量Fig.4 The relative contents of GST-tag protein in the coelomic fluid from coelom and polian vesicle in sea cucumber A. japonicus injection with GST-rp误差线代表标准偏差(n=5); 星号代表差异显著性(**0.001 注射荧光微球后6、12 h,收集仿刺参体腔液和囊腔液,制备滴片,通过荧光显微镜观察发现,仿刺参体腔液中可发现大量的绿色荧光微球,但对应的囊腔液中未发现明显的荧光微球信号(图5)。 图5 体腔注射荧光微球后仿刺参体腔液和囊腔液中荧光微球的分布情况 Fig.5 Distribution of fluorescent microspheres in coelomic fluid from coelom and polian vesicle in sea cucumber A. japonicus exposed to injectiona.注射前体腔液;b、c.注射后6、12 h 体腔液;d.注射前囊腔液;e、f.注射后6、12 h囊腔液.a.coelomic fluid from coelom without injection; b, c.coelomic fluid from coelom at 6 and 12 h after injection; d.coelomic fluid from polian vesicle without injection; e, f.coelomic fluid from polian vesicle at 6 and 12 h after injection. 注射仿刺参致病菌——灿烂弧菌后6、12、24、72 h,收集仿刺参体腔液和囊腔液,进行平板涂布及培养,观察发现,灿烂弧菌注射前仿刺参体腔液和囊腔液中均未分离到细菌,注射后6、12、24、72 h体腔液中均有大量细菌存在,但对应的囊腔液内均未分离到细菌(图6)。 图6 灿烂弧菌注射后不同时间点仿刺参体腔液和囊腔液中细菌的涂布及生长Fig.6 Bacteria culture of coelomic fluid from coelom and polian vesicle in sea cucumber A. japonicus at different time after injection with V. splendidusa.注射前体腔液;b~e.注射后6、12、24、72 h体腔液;f.注射前囊腔液;g~j.注射后6、12、24、72 h囊腔液.a.coelomic fluid from coelom without injection; b—e.coelomic fluid from coelom at different points after injection 6, 12, 24, 72 h, respectively; f.coelomic fluid frompolian vesicle without injection; g—j.coelomic fluid from polian vesicle at different points after injection 6, 12, 24, 72 h, respectively. 注射仿刺参非致病菌——大肠杆菌后6、12、24、72 h,收集仿刺参体腔液和囊腔液,进行平板涂布及培养,观察发现,大肠杆菌注射前仿刺参体腔液和囊腔液中均未分离到细菌,注射后6、12、24、72 h体腔液中均有大量细菌存在,但对应的囊腔液内均未分离到细菌(图7)。 图7 大肠杆菌注射后不同时间点仿刺参体腔液和囊腔液的细菌涂布及生长Fig.7 Culture of bacteria in coelomic fluid from coelom and polian vesicle in sea cucumber A. japonicus at different points after injection with E. colia.注射前体腔液;b~e.注射后6、12、24、72 h体腔液;f.注射前囊腔液;g~j.注射后6、12、24、72 h囊腔液.a.coelomic fluid from coelom without injection; b—e.coelomic fluid from coelom at different points after injection 6, 12, 24, 72 h, respectively; f.coelomic fluid from polian vesicle without injection; g—j.coelomic fluid from polian vesicle at different points after injection 6, 12, 24, 72 h, respectively. 仿刺参具有一套复杂的水管系统,由于其筛板开口于体腔内,所以管腔内充满体腔液和体腔细胞,水管系统可以通过调节体腔液流进和流出管足,从而支配管足的活动[12]。过去观点普遍认为仿刺参水管系统内的体腔液和体腔细胞与体腔中的体腔液和体腔细胞是相同的,然而近年来的研究发现仿刺参水管系统内体腔细胞与体腔中体腔细胞种类相似,但亚群组成存在差异。水管系统内以带伪足的球形细胞为主,淋巴细胞次之;体腔内则以淋巴细胞为主,带伪足的球形细胞次之,且每一种类型的细胞在其细胞数量和比例上都存在显著差异;仿刺参体腔中体腔细胞密度约为水管系统内体腔细胞密度的2倍[8]。此外有研究指出,仿刺参水管系统和体腔内体腔液上清免疫相关酶活性存在差异,水管系统中的酸性磷酸酶和碱性磷酸酶活性显著高于体腔中,而体腔中的超氧化物岐化酶、过氧化氢酶活性显著高于水管系统[9]。波里氏囊作为刺参水管系统的附属物,过去普遍认为其主要功能是调节水管系统内的压力[13],但随着生物认知的发展,其生物学功能逐渐被重新认识。近年来研究证实,仿刺参波里氏囊可能是一种潜在的“造血组织”,且在响应由病原菌引起的免疫反应中发挥了重要的作用[14-15];此外,波里氏囊被认为是一种炎症反应器官,其对异物刺激可表现出明显的炎症现象,有研究者甚至推测其在功能上类似于脊椎动物免疫器官——淋巴结[16-17]。虽然仿刺参水管系统可以通过筛板调节体腔液的流动与进出,但不同类型的实体物质能否在水管系统和体腔间流通目前尚不清楚。因此,笔者聚焦于仿刺参水管系统与体腔的关联性及连通性,以期为后续探究仿刺参水管系统的深层生理构造及其在仿刺参中的生物学作用奠定理论基础。 甜菜红和GST标签蛋白均具有可溶性的特点,且具有一定的稳定性[18]。笔者利用上述2种物质分别代表生物小分子和大分子来探究仿刺参体腔和水管系统间的连通性。结果发现,仿刺参体腔内注射甜菜红和GST标签蛋白后6 h,仿刺参波里氏囊腔内可检测到甜菜红和GST标签蛋白的分布,表明可溶性分子可以从仿刺参体腔流入到水管系统中,其中,小分子可溶性的物质可以完全自由地流通于体腔和水管系统之间,生物大分子亦可进入水管系统,但扩散相对较缓,扩散量相对较少。在12 h时,仿刺参体腔中天然色素甜菜红较6 h颜色变浅。在体腔注射12 h时,波里氏囊腔液中GST标签蛋白浓度较6 h提高,同时,体腔液中GST标签蛋白浓度相比6 h却降低。推测出现此种现象的原因为:一方面随着扩散时间的延长,来自于体腔的GST标签蛋白不断在囊腔中积累;另一方面仿刺参体腔内进行着永不停息的自我更新代谢,体腔内的外源异物,如甜菜红染料和GST标签蛋白会被逐渐稀释甚至被清除。 荧光微球粒度均一、分散性好、稳定性强,对机体细胞无毒副作用,在蓝色激发光下可发出绿色荧光,因此是生物学研究中较为理想的示踪工具[19]。笔者利用荧光微球模拟无活性的外源微粒探究仿刺参体腔和水管系统间的连通性,结果发现,仿刺参体腔内注射荧光微球6 h和12 h后,体腔液中存在大量绿色荧光微球,在囊腔液中未发现大量的荧光微球信号。灿烂弧菌和大肠杆菌作为有活性的外源颗粒物,大小均为微米级,仿刺参体腔注射后6~72 h,体腔液中均可检测到大量细菌的存在,而囊腔液中在各时间点均未发现细菌分布。由此可以判断,外源颗粒物(有活力或无活力)不能通过体腔进入到水管系统。由于仿刺参水管的末端筛板开口于体腔中,开口处有许多带有纤毛的小孔,有可能阻挡了包括荧光微球和细菌在内的所有外源颗粒物质进入水管系统[12],但究其原因是因为筛板的物理阻隔还是存在其他的防御机制需要进一步深入研究。有研究表明,仿刺参的体腔细胞具有一定的吞噬能力,能够有效识别和吞噬入侵到体腔中的外源物质[20]。有学者将异硫氰酸荧光素标记的荧光微球加入原代培养的仿刺参体腔细胞培养液中或将荧光微球直接注射到仿刺参体腔内,通过流式细胞仪均检测到体腔细胞可以吞噬荧光微球[21-22],由此证实,体腔细胞具有吞噬荧光微球的能力,且吞噬后的体腔细胞可以被检测到荧光信号。根据本试验结果,在将荧光微球和细菌注射到仿刺参体腔后,仅仅只能在体腔中观察到绿色荧光和细菌的存在,而在囊腔中未发现绿色的荧光微球和细菌,这从侧面反映了体腔中吞噬了细菌和荧光微球的细胞并未进入水管系统。 将不同外源物质进行仿刺参体腔注射,可以明确判断体腔与水管系统的关联性和连通性。本试验结果表明,仿刺参水管系统和体腔间并非无限畅通,小分子和生物大分子等可溶性物质可以流通于体腔和水管系统之间,但对于外源颗粒物和细菌则不能通过体腔进入到水管系统内。试验结果可为后续研究仿刺参水管系统的生理结构和在机体中的生物学作用奠定理论基础。2.3 体腔注射荧光微球后波里氏囊腔液中微球示踪

2.4 体腔注射灿烂弧菌后波里氏囊腔液中细菌示踪

2.5 体腔注射大肠杆菌后波里氏囊腔液中细菌示踪

3 讨 论
3.1 可溶性物质在体腔和水管系统间的连通性
3.2 外源颗粒物质在体腔和水管系统间的连通性
4 结 论
