仿刺参体壁再生形态学和组织学的研究
2011-03-18李霞周海燕秦艳杰郭娜孙毅
李霞,周海燕,秦艳杰,郭娜,孙毅
(大连海洋大学农业部海水增养殖学重点开放实验室,辽宁大连116023)
仿刺参体壁再生形态学和组织学的研究
李霞,周海燕,秦艳杰,郭娜,孙毅
(大连海洋大学农业部海水增养殖学重点开放实验室,辽宁大连116023)
用手术刀片切掉仿刺参体壁表皮层和结缔组织层,深度至体腔膜。术后将仿刺参放入正常海水中饲养,用肉眼和光学显微镜观察仿刺参体壁再生的外部形态和组织学变化,并通过免疫荧光方法检测小鼠抗人角蛋白19(CK19)的表达。形态学观察表明:术后1 d,伤口呈凹陷状,体腔膜上增生出一薄层乳白色结缔组织;术后7 d伤口表面出现色素;术后11 d凹陷基本变平;术后21 d,伤口处体壁形态与颜色恢复至术前。组织学观察表明:术后1 d,疏松结缔组织直接暴露,创伤面附近有成纤维细胞和胶原纤维聚集;术后3 d,结缔组织外层有上皮细胞聚集;术后4 d,结缔组织间可见一条带状间隙;术后7 d,表皮外层出现角质层;术后11 d,上皮层厚度接近正常组织,但结缔组织较松散;术后21 d,上皮细胞数量、排列以及结缔组织的排列同正常组织。免疫荧光检测结果表明:CK19在正常的仿刺参体壁中表达得比较分散;术后3 d,CK19在创伤面附近集中表达。
仿刺参;体壁;再生;形态学;组织学
目前,国内外学者对仿刺参Apostichopus japonicus体壁的组织学[1]、体壁化学组成及活性物质的提取工艺研究较多[2-3],而关于体壁再生的研究报道很少[4-5]。本研究中,作者采用人工手术方法在仿刺参体壁的疣足间形成创伤,肉眼和显微镜下观察手术后体壁的变化,并采用免疫组织学方法研究了和表皮再生有关的CK19的表达,旨在探讨仿刺参体壁的再生机理,为仿刺参“化皮病”的防治提供一定的参考资料。
1 材料与方法
1.1 材料
仿刺参于2009年10月取自旅顺龙王塘海区,为自然生长个体,体质量为30~60 g,共50个。取回后暂养在大连海洋大学农业部海水增养殖学重点开放实验室生态室90 L的水槽中,饲养用水为砂滤海水,暂养10 d,每天定时半量换水1次,并投喂人工配合饲料。
试验用药品包括:冷冻切片包埋剂(美国SAKURA公司)、丙酮、小鼠抗人角蛋白19单克隆抗体(CK19,英国Abcam公司)、FITC标记的羊抗小鼠IgG(北京中山生物技术有限公司)。
1.2 方法
1.2.1 人工创伤的形成 取仿刺参于冰上麻醉0.5 h,用无菌解剖刀在仿刺参体壁疣足间切掉表皮层和结缔组织层,形成面积约1 cm2的创伤面,深度至体腔膜。将手术后的仿刺参放回水槽中继续饲养。试验进行21 d。
1.2.2 形态学观察 每天用肉眼观察手术后仿刺参体壁伤口的愈合情况,并用数码相机进行拍照。
1.2.3 组织学样品的制备 仿刺参术后1~7 d,每天取样;8~21 d,隔天取样。取样时从水槽中随机选取3个仿刺参,用硫酸镁(0.54 mol/L)麻醉2 h,取创伤处体壁组织1 cm×1 cm×0.5 cm,用Bouin's液固定,常规石蜡包埋,LeicaRM2135型切片机切片,厚度为5 μm。用H.E染色,中性树胶封片,在Olympus显微镜下观察并拍照。
1.2.4 免疫荧光样品的制备 随机选取正常和手术后3 d的仿刺参各3个,在冰块上麻醉0.5 h。取体壁组织1 cm×1 cm×0.5 cm,用冷冻切片包埋剂包埋,再用LeicaCM1900MDL冷冻切片机切片,厚度为5 μm。切片后按以下步骤处理:用丙酮固定15 min后取出载玻片,用滤纸吸干多余水分,滴加50 μL适当稀释的小鼠抗人CK19(1∶50),使其完全覆盖标本,置于有盖搪瓷盒内,37℃下恒温箱内保温1 h。对照组用PBS代替一抗。取出载玻片,用滤纸吸干多余水分,滴加50 μL用FITC标记的羊抗小鼠IgG,避光45 min。加一滴甘油封片,立即在Olympus荧光显微镜下观察标本的特异性荧光强度并拍照。两步骤之间都用0.01 mol/L的PBS(pH为7.4)冲洗3次,每次5 min。
2 结果
2.1 手术后仿刺参体壁形态学的变化
试验中没有个体死亡,仅在术后第一天观察到2个仿刺参有吐肠现象。手术后0 h,将创伤部位的体壁去除,创面可见体腔膜。手术后切口处体壁立即收缩,创口闭合,身体聚缩,仿刺参以管足吸附在槽底(图1-A)。手术后1 d,仿刺参基本伸展恢复常态,伤口处呈凹陷状,体腔膜上增生一薄层乳白色结缔组织(图1-B)。手术后6 d,结缔组织增厚,凹陷程度降低(图1-C)。手术后7 d,伤口与周围表皮连接处出现色素,并逐渐延伸到伤口中心(图1-D)。手术后11 d,色素增多且与正常体壁颜色相近,凹陷基本变平(图1-E)。手术后21 d,体壁形态与颜色恢复至术前(图1-F)。
2.2 手术后仿刺参体壁组织学的变化
手术后1 d,仿刺参体壁已去除,疏松结缔组织直接暴露,创伤面凹陷,附近有成纤维细胞和胶原纤维聚集(图1-G)。手术后3 d,创伤处结缔组织外层有上皮细胞聚集,细胞排列杂乱疏松(图1-H)。手术后4 d,创伤处上皮细胞数量增加,并形成一薄层,细胞排列仍不规则。靠近表层的结缔组织疏松,与内层结缔组织间形成一条带状间隙(图1-I)。手术后7 d,新生表皮层增厚,上皮细胞密集,与结缔组织连接紧密。表皮外层出现角质层。间隙带内的成纤维细胞和胶原纤维增多,排列逐渐均匀(图1-J)。手术后11 d,上皮细胞层和角质层厚度接近正常组织,只是上皮细胞排列仍显凌乱。结缔组织间隙带基本弥合(图1-K)。手术后21 d,上皮层细胞数量和排列同正常组织,结缔组织分布均匀(图1-L)。
2.3 免疫荧光检测结果
与对照组(图1-M)相比,CK19在正常和再生的仿刺参体壁中均有阳性表达,只是表达的部位和程度有所区别:在正常的仿刺参体壁中,CK19分布得比较分散,在体壁的不同部位均有阳性表达(图1-N)。手术后3 d,CK19在创伤面附近集中表达,形成一条发亮的条带(图1-O)。
3 讨论
3.1 仿刺参体壁的再生能力
器官再生的持续时间因种类不同而不同。如肠的再生,拟刺参需145 d,仿刺参需14 d[6],糙海参仅需7 d[7];体壁再生,硬瓜参需20~30 d[5],本试验中仿刺参为20 d。日常观察发现,仿刺参若受到机械损伤或用手术刀片切掉轻微化皮的体壁,短时间内体壁可以修复完好。本试验中将体壁大部分组织切除,只留下体腔膜,仿刺参也能将缺失的部分修复完整,说明仿刺参体壁的再生能力很强。
3.2 仿刺参体壁表皮和结缔组织再生机制的分析
研究表明,海参再生有3种模式:变形再生(Morphallaxis)、新建再生(Epimorphosis)以及两种再生机制的结合。Dolmatov等[8]报道的海参体壁纵肌的再生过程和Gibson等[9]报道的无足类海参Leptosynapta体壁横切后的肠再生都属于变形再生; H.glaberrima肠的再生、H.forskali居维尔氏小管的再生[10]是变形再生和新建再生结合的典型例子。
组织切片观察可见,对仿刺参手术后3 d,伤口表面出现较多数量的表皮细胞,而免疫荧光检测发现该区域有大量CK19的阳性表达。CK19是表皮干细胞的特异性标记物[11-12]。Lyte等[13]的研究表明,CK19阳性的细胞可能是“早期”短暂扩增细胞或表皮干细胞,而短暂扩增细胞也是由干细胞分裂而来的,这些细胞通常位于基膜附近。由于仿刺参上皮组织和结缔组织间无基膜,所以正常情况下CK19阳性细胞分散在结缔组织中,在体壁再生初期集中在伤口处并不断分裂增殖,向表皮迁移、分化为新的上皮细胞。所以仿刺参体壁表皮的再生机制属于新建再生。
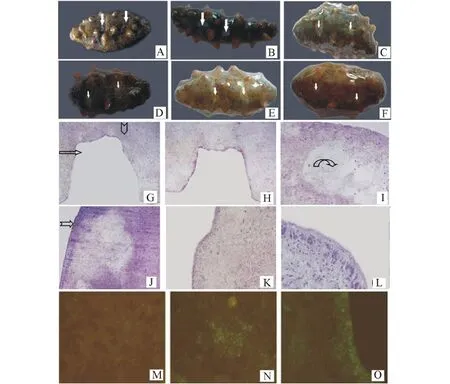
图1 仿刺参体壁的再生形态学(A~F)和组织学(G~O)观察Fig.1 Morphology(A-F)and histology(G-O)of the regenerated body wall of sea cucumber Apostichopus japonicus
组织切片观察还发现,创伤面附近聚集大量的成纤维细胞。创伤后4 d,结缔组织中出现带状间隙。这是因为大量的结缔组织成分向表面移动造成的,以后随成纤维细胞分泌的纤维和基质的增多,填补了间隙,结缔组织结构变得均匀同正常。在人体中深达真皮的损伤是由瘢痕来修复的,而成纤维细胞在瘢痕发生中起着重要作用,如细胞外基质(extracellular matrix,ECM)的合成、分泌以及胶原纤维的形成[14]。ECM主要由胶原蛋白、蛋白多糖和纤维黏连蛋白(fibronectin,FN)组成。已有研究证明[15],在伤口愈合的各个时期,均有纤维黏连蛋白的参与,其含量在伤口区大量增加。笔者推测:成纤维细胞在仿刺参体壁再生过程中的作用与人体相似,即通过分泌大量的胶原纤维和纤维黏连蛋白促进伤口的修复。所以仿刺参体壁结缔组织的再生属于变形再生。
[1] 聂竹兰,李霞,辛涛.仿刺参体壁的组织学和组织化学[J].大连水产学院学报,2007,22(3):184-187.
[2] 姜健,杨宝灵,邰阳.海参资源及其生物活性物质的研究[J].生物技术通讯,2004,15(5):537-540.
[3] 沈鸣.海参的化学成分和药理研究进展[J].中成药,2001,23 (10):758-761.
[4] 李霞,聂竹兰,魏杰.仿刺参体壁表皮再生组织学和超微结构观察[J].中国水产科学,2007,14(7):1-6.
[5] Garcia-Arraras J E,Estrada-Rodgers L,Santiago R,et al.Cellular mechanisms of intestine regeneration in the sea-cucumber Holothuria glaberrina Selenka(Holothuroidea:Echinodermata)[J].J Exp Zool,1998,281:288-304.
[6] 孙修勤,郑法新,张进兴.海参纲动物的吐脏再生[J].中国海洋大学学报,2005,35(5):719-723.
[7] Bai M M.Regeneration in the Holothurian,Holothuria scabra jager [J].Indian J Exp Biol,1971,9:467-471.
[8] Dolmatov I Yu,Eliseikina M G,Ginanova T T,et al.Muscle regeneration in the holothurian Stichopus japonicus[J].Development Genes and Evolution,1996,205:486-493.
[9] Gibson A W,Burke R D.Gut regeneration by morphallaxis in the sea cucumber Leptosynapta clarki(Heding,1928)[J].Can J Zool, 1983,61:2720-2732.
[10] Vanden-Spiegel D,Jangoux M,Flammang P.Maintaining the line of defense:Regeneration of cuvierian tubules in the sea cucumber Holothuria forskali(Echinodermata,Holothuroidea)[J].The Biological Bulletin,2000,198(1):34-49.
[11] Michel M,Torok N,Godbout M J,et al.Keratin 19 as a biochemical marker of skin stem cells in vivo and in vitro:keratin 19 expressing cells are differentially localized in function of anatomic sites,and their mumber varies with donor age and culture stage [J].J Cell,1996,109:1017-1020.
[12] Michel M,L'Heureux N,Auger F A,et al.From newborn to adult: phenotypic and functional properties of skin equivalent and human skin as a function of donor age[J].J Cell Physio,1997,171:179-181.
[13] Lyte S,Christofidou-Solomidou M,Liu Y,et al.The C8/144B monoclonal antibody recognizes cytokeratin 15 and defines the location of human hair follicle stem cells[J].J Cell Sci,1998,111: 3179-3184.
[14] 赵烨德,牛星焘,肖军军.增生性瘢痕组织中成纤维细胞活性功能研究[J].中国修复重建外科杂志,1998,12(2):108-112.
[15] Cheng C Y.Fibeonectin enhances healing of excised wounds in rats[J].Arch Dermatol,1988,124:221-224.
Morphology and histology of the regenerated body wall of sea cucumber Apostichopus japonicus
LI Xia,ZHOU Hai-yan,QING Yan-jie,GUO Na,SUN Yi
(Key Laboratory of Mariculture,Agriculture Ministry,PRC,Dalian Ocean Univ.,Dalian 116023,China)
The morphology and histological changes were observed in the regenerated body walls in sea cucumber Apostichopus japonicus whose epidermis and the connective tissue layer were cut off and reared in the sea water by naked eye and a light microscopy.The CK19 was expressed in the mice by fluorescence radioimmunoassay.A thin milky connective tissue was found in the body cavity membranes and hollowness was visible 1 day after regeneration.Pigment was appeared 7 days after regeneration,and no hollowness 11 days after regeneration.21days after regeneration,the wound epidermis configuration and color was recovery to the original.Histologically,1 day after connective tissue was exposed directly,and in fibroblasts and collagen congregated fibers were the vicinity of trauma surface.3 days after regeneration,a large number of epithelial cells were in the outer layer of connective tissue, and 4 days after regeneration,a band gap became obvious between the connective tissues.7 days after regeneration, the keratose layer appeared out of the epidermis layer,and 11 days after regeneration,the thickness of epidermis layer and keratose layer were consistent with the normal state.21 days after regeneration,the number and arrangement of epidermis cells were the same as the normal tissue,and connective tissue was homogeneous.The confocal microscopy analysis showed that the natural body wall of the sea cucumber had expression of CK19 dispersedly.3 days after regeneration,the CK19 was expressed in the vicinity of trauma surface.
Apostichopus japonicus;body wall;regeneration;morphology;histology
Q246
A
2095-1388(2011)04-0287-04
2010-09-20
国家自然科学基金资助项目(30371099);辽宁省自然科学基金资助项目(20052139);辽宁省创新团队项目(2007T015);辽宁省教育厅重点实验室项目(2008S064)
李霞(1961-),女,教授。E-mail:lx@dlou.edu.cn
