昆虫激素对家蚕血淋巴和体壁酚氧化酶活性及其基因表达水平的影响
2020-01-21杨伟克唐芬芬刘增虎董占鹏
杨伟克 唐芬芬 刘增虎 董占鹏


摘要:【目的】研究外源昆蟲激素对家蚕酚氧化酶活性及其基因表达水平的影响,明确昆虫激素对酚氧化酶的调控作用,为深入解析家蚕酚氧化酶的功能及基因表达调控机制提供参考依据。【方法】对五龄第3 d发育良好的家蚕幼虫注射蜕皮激素20E和保幼激素JH,以注射等量0.1%二甲基亚砜(DMSO)为对照,分别在注射3、6、12和24 h后解剖家蚕幼虫采集血淋巴和体壁,检测分析家蚕酚氧化酶活性及其基因表达的变化情况。【结果】注射外源JH和20E均能促进家蚕血淋巴酚氧化酶原基因PPO1和PPO2的表达,有效增加酚氧化酶活性。家蚕血淋巴PPO1和PPO2基因对JH和20E的响应时间存在一定差异,其中,经JH处理后2个酚氧化酶原基因(PPO1和PPO2)仅在处理6和12 h时显著(P<0.05)或极显著(P<0.01)上调表达;而经20E处理后PPO1和PPO2基因从3 h开始一直持续到12 h均呈上调表达趋势。JH和20E对家蚕体壁PPO1和PPO2基因的影响恰好相反,具体表现为:JH能有效抑制家蚕体壁PPO1和PPO2基因的表达,降低酚氧化酶活性;20E则促进家蚕体壁PPO1基因上调表达,但不影响PPO2基因表达。【结论】家蚕酚氧化酶原基因PPO1和PPO2表达受JH和20E的调控,且激素对酚氧化酶原基因表达水平的影响与其酶活性变化规律一致,提示酚氧化酶不仅参与昆虫激素的代谢,还与激素协同调控家蚕的蜕皮变态。
关键词: 家蚕;昆虫激素;酚氧化酶;血淋巴;体壁;蜕皮变态
中图分类号: S883.89 文献标志码: A 文章编号:2095-1191(2020)10-2573-07
Effects of insect hormone on activity of phenoloxidase and its gene expression inhemolymph and integument of Bombyx mori
YANG Wei-ke1, TANG Fen-fen2, LIU Zeng-hu1, DONG Zhan-peng1*
(1Sericulture and Apiculture Research Institute, Yunnan Academy of Agricultural Sciences, Mengzi, Yunnan 661101, China; 2College of Life Science and Technology, Honghe University, Mengzi, Yunnan 661101, China)
Abstract:【Objective】To clarify the regulation effect of insect hormones on phenoloxidase activity and gene expression of Bombyx mori, and study regulation effect of insect hormones on phenoloxidase, which could provide a theoretical reference for further research on the function of phenoloxidase and gene expression regulation mechanism. 【Method】Ecdysone 20E and juvenile hormone JH were injected into the silkworm at day 3 of 5th instar larva and the same amount of 0.1% dimethyl sulfoxide (DMSO) was injected as a control group. The phenoloxidase activity and gene expression level were determined in hemolymph and integument of silkworm at 3 h, 6 h, 12 h and 24 h after injection. 【Result】The results showed that the expression of prophenoloxidase genes PPO1 and PPO2 in hemolymph of silkworm were up regulated by 20E and JH, and the phenoloxidase activity was also higher than the control group. There was difference in response times of PPO1 and PPO2 in hemolymph of silkworm to 20E and JH. The expression of PPO1 and PPO2 were only significantly up-regulated at 6 h(P<0.05) and extremely up-regulated at 12 h(P<0.01) after JH treatment. While the expression of PPO1 and PPO2 were up-regulated from 3 h to 12 h after 20E treatment. The effects were opposite of JH and 20E on the expression of PPO1 and PPO2 in integument of silkworm. The expression of PPO1 and PPO2 were inhibited by JH and the phenoloxidase activity was decreased at the same time. 20E could induce the expression of PPO1,but did not affect the expression of PPO2 in integument of silkworm. 【Conclusion】The PPO1 and PPO2 expression in silkworm are regula-ted by JH and 20E. In addition, the effects of JH and 20E on the gene expression are consistent with the change rule of phenoloxidase activities. It is suggested that the phenoloxidase are involved in the metabolism of insect hormones and coordinately regulates the molting metamorphosis with JH and 20E in silkworm.
Key words: Bombyx mori; insect hormone; phenoloxidase; hemolymph; integument; molting metamorphosis
Foundation item: Modern Agricultural Sericulture Industrial Technology System Construction(Chief Scientist) Project of Yunnan(2019K-JTX006); Applied Basic Research Project of Yunnan Academy of Agricultural Sciences(YJM 201710)
0 引言
【研究意義】酚氧化酶(Phenoloxidase,PO)是一类能将酚类氧化成邻苯醌或对苯醌的酶,广泛分布于动植物界,在生物体内发挥着极其重要的生理功能作用(陈晓宇等,2015;苑胜垒等,2016)。昆虫酚氧化酶通常以非活化状态的前体酚氧化酶原存在,主要分布在血淋巴和体壁等组织中(Yang et al.,2018)。酚氧化酶原通过酚氧化酶原激活系统转变为具有活性的酚氧化酶,参与调控昆虫的一系列生理过程,包括免疫防御、伤口愈合、表皮的鞣化和黑化等(Jearaphunt et al.,2014;Wu et al.,2017)。保幼激素和蜕皮激素是调控家蚕(Bombyx mori)生长发育与蜕皮变态的主要激素,研究家蚕酚氧化酶活性及其基因表达在外源激素处理后的变化规律,可为阐明激素对酚氧化酶基因的分子调控机制提供理论依据。【前人研究进展】当昆虫机体遭受病原微生物、杀菌剂和杀虫剂等外源异物刺激时,其体内的酚氧化酶活性及基因表达水平均会受到一定程度的影响(杨伟克等,2019a)。杜育哲等(2002)以蜕皮激素类杀虫剂处理棉铃虫四龄幼虫6 h,结果发现血淋巴蜕皮激素滴度下降,幼虫蜕皮困难,酚氧化酶活性显著降低。金华超等(2013)研究表明,三唑酮、肟菌脂、咪鲜胺和申嗪霉素4种杀虫剂能有效激活赤眼蜂酚氧化酶活性,说明杀菌剂不仅对赤眼蜂产生毒害作用,在一定程度上还能激活其免疫应答反应。庞海玉等(2013)研究发现,以0.1和0.5 mg/L的20-羟基蜕皮甾酮(20E)处理异色瓢虫,不影响其生理状态及酚氧化酶活性;但1.0、5.0和10.0 mg/L的20E均导致幼虫生长缓慢,死亡率增加,且过氧化物酶和酚氧化酶活性受到抑制。张道伟和陈静(2014)采用大肠杆菌刺激德国小蠊,结果发现其血淋巴和表皮中的酚氧化酶基因均显著上调表达,酚氧化酶活性也随着诱导时间的延长而逐渐增强。柴连琴等(2015)研究表明,20E不仅能提高棉铃虫血细胞的运动能力,还能通过激活血淋巴酚氧化酶活性,进而增强血细胞对外源微生物的吞噬能力。李一波等(2017)研究发现,喂食曲酸不仅能抑制飞蝗酚氧化酶活性,还会影响飞蝗的其他代谢酶活性。Zhang等(2018)研究表明,南亚寡鬃实蝇ZtPPO1基因在幼虫到蛹的变态过程中高效表达,但喂食曲酸能抑制蜕皮激素的合成,降低酚氧化酶活性,导致化蛹蜕皮困难,暗示ZtPPO1基因表达及其酶活性受蜕皮激素20E调控。家蚕机体内存在2个酚氧化酶原基因(PPO1和PPO2),其幼虫酚氧化酶活性变化具有明显的发育时期和组织特异性,且组织表达谱分析显示酚氧化酶原基因在血淋巴和体壁中均高效表达(毛钰霞等,2017)。唐芬芬等(2016)研究发现,喂食家蚕核型多角体病毒(BmNPV)能诱导家蚕血淋巴酚氧化酶原基因(PPO1和PPO2)上调表达,且酚氧化酶活性显著增加。杨伟克等(2019b)研究表明,经口添食大肠杆菌或金黄色葡萄球菌均能诱导家蚕血淋巴酚氧化酶原基因上调表达及酶活性增加,说明酚氧化酶在家蚕抗病毒及抵御细菌等病原微生物的过程中发挥重要作用。此外,已有研究发现家蚕酚氧化酶原基因PPO1在蜕皮变态阶段呈上调表达,但在蜕皮结束后其表达量下降,即干涉PPO1基因表达可导致家蚕无法正常化蛹(Wang et al.,2013;Xu et al.,2015)。【本研究切入点】家蚕酚氧化酶原基因表达水平及其活性在四龄眠前期较高,眠中减弱,眠后期增强,说明酚氧化酶活性变化与昆虫激素水平存在一定相关性(杨伟克等,2019a),但至今有关昆虫激素对家蚕酚氧化酶活性影响及其基因表达调控的研究相对较少。【拟解决的关键问题】研究外源昆虫激素对家蚕酚氧化酶活性及其基因表达水平的影响,明确昆虫激素对酚氧化酶的调控作用,为深入解析家蚕酚氧化酶的功能及其基因表达调控机制提供参考依据。
1 材料与方法
1. 1 试验材料
供试家蚕品种为大造,恒温培养箱26 ℃,相对湿度(75±5)%,光照周期(12 h光∶12 h暗),新鲜桑叶饲育。蜕皮激素20E(Y0002054)和保幼激素(JH)类似物(33375)购自Sigma公司,动物组织总RNA抽提试剂盒(ER501-01)购自北京全式金生物技术有限公司,反转录试剂盒(RR047A)购自TaKaRa公司,荧光定量试剂Hieff TM qPCR SYBR? Green Master Mix(11201ES03)购自上海翊圣生物科技有限公司,酚氧化酶测试盒(A136-1-1)购自南京建成生物工程研究所。
1. 2 激素处理及样品采集
激素处理操作参照Gui等(2006)的研究方法。选取家蚕五龄第3 d发育良好的幼虫,采用微量注射器在每头家蚕幼虫腹部分别注射2.0 μL保幼激素JH(0.5 μg/μL)和蜕皮激素20E(1.0 μg/μL),以注射等量0.1%二甲基亚砜(DMSO)为对照。分别在注射3、6、12和24 h后解剖家蚕幼虫,采集血淋巴和体壁,每次取样均设5次重复,每个重复取5头蚕,样品收集后置于-80 ℃保存备用。
1. 3 酚氧化酶活性测定
(1)酶液制备:家蚕体壁先用PBS清洗干净,再以液氮充分研磨,加入适量的10 mmol/L Tris-HCL(pH 7.0),在4 ℃下10000 r/min离心10 min,上清液即为待测酶液。血淋巴直接在4 ℃下10000 r/min离心10 min,上清液即为待测酶液。(2)酶活性测定:按照酚氧化酶测试盒说明测定家蚕血淋巴和体壁酚氧化酶活性。
1. 4 总RNA提取及反转录
根據动物组织总RNA抽提试剂盒操作说明提取家蚕血淋巴和体壁总RNA,以分光光度计测定OD260/OD280,并取OD260/OD280在1.9~2.0的样品按照反转录试剂盒操作说明将其反转录合成cDNA,用于实时荧光定量PCR检测。
1. 5 实时荧光定量PCR检测
以家蚕酚氧化酶原基因PPO1(GenBank登录号BAA08368)和PPO2(GenBank登录号BAA08369)为靶基因、RP49基因(GenBank登录号NM_001098 282)为内参基因,利用Primer Premier 5.0设计实时荧光定量PCR引物(表1),并委托深圳华大基因科技有限公司合成。
参照荧光定量试剂Hieff TM qPCR SYBR? Green Master Mix说明进行实时荧光定量PCR检测,其反应体系20.0 μL,扩增程序:95 ℃预变性5 min;95 ℃ 10 s,60 ℃ 30 s,进行40个循环;65 ℃延伸5 s(而后每次加0.5 ℃,直至95 ℃)。以StepOne荧光定量PCR扩增仪记录检测结果,每个样品设3次重复,并根据2-△△Ct计算家蚕酚氧化酶原基因相对表达量。采用Excel 2019进行数据处理及制图,同时以SPSS 21.0进行统计分析。
2 结果与分析
2. 1 JH对家蚕血淋巴和体壁酚氧化酶原基因表达的影响
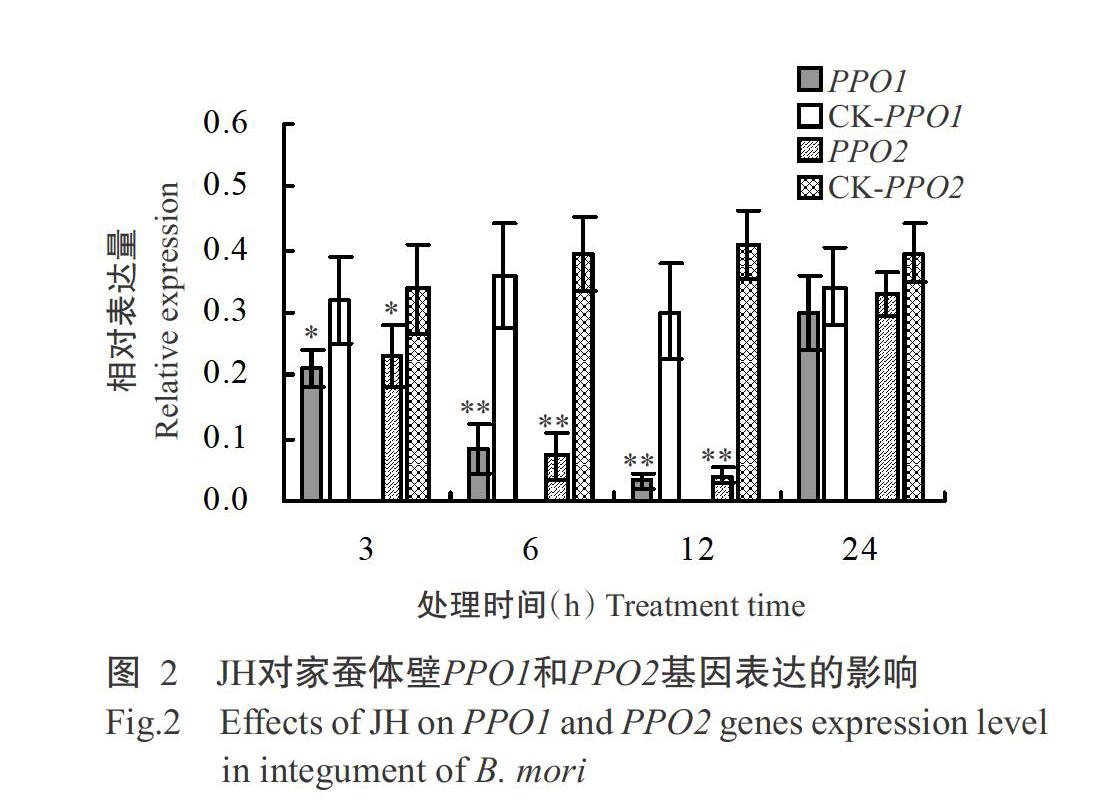
实时荧光定量PCR检测JH处理后家蚕血淋巴和体壁酚氧化酶原基因PPO1和PPO2的表达情况,结果如图1和图2所示。由图1可看出,家蚕血淋巴PPO1和PPO2基因均在JH处理6和12 h后呈上调表达趋势,且相对表达量明显高于相应的对照组。其中,PPO1基因在JH处理6 h后出现表达高峰,与对照组间的差异达极显著水平(P<0.01,下同),至处理12 h时其相对表达量虽有小幅度下调,但仍极显著高于对照组;PPO2基因则在JH处理12 h后出现表达高峰。与相应的对照组相比,PPO1基因的相对表达量在JH处理6和12 h时分别上调2.8和2.3倍,而PPO2基因分别上调1.7和1.9倍,说明家蚕血淋巴PPO1基因对JH的响应更敏感。
由图2可看出,注射外源JH能有效抑制家蚕体壁酚氧化酶原基因PPO1和PPO2的相对表达量。经JH处理3 h后,家蚕体壁PPO1和PPO2基因均开始显著下调表达(P<0.05,下同),且随处理时间的延长,其相对表达量持续降低;至JH处理12 h时家蚕体壁酚氧化酶原基因的相对表达量降至最低值,与相应的对照组相比,其差异均达极显著水平;处理24 h后由于JH可能逐渐被消耗代谢,PPO1和PPO2基因相对表达量得到一定程度的恢复。
2. 2 20E对家蚕血淋巴和体壁酚氧化酶原基因表达的影响
由图3可看出,注射外源20E后家蚕血淋巴PPO1和PPO2基因的相对表达量均高于对照组,整体上呈先显著上调再缓慢下调表达趋势。PPO1和PPO2基因相对表达量均在20E处理3 h开始显著上调表达,至处理6 h时其相对表达量达峰值;随后家蚕血淋巴酚氧化酶原基因相对表达量开始下调,但至处理12 h时其相对表达量仍显著高于对照组;20E处理24 h后家蚕血淋巴酚氧化酶原基因的相对表达量略高于对照组,但差异不显著(P>0.05,下同)。由图4可看出,家蚕体壁PPO1基因在20E处理6和12 h呈上调表达趋势,与对照组的差异达极显著水平;注射外源20E后家蚕体壁PPO2基因的相对表达量无明显变化,表明体壁PPO2基因对外源20E无应答。
2. 3 JH和20E对家蚕血淋巴和体壁酚氧化酶活性的影响
注射外源JH和20E后,家蚕血淋巴和体壁酚氧化酶活性变化趋势如图5和图6所示。由图5可看出,经JH处理3 h后家蚕血淋巴酚氧化酶活性与对照组间无显著差异,但至处理6 h时急剧升高至峰值,极显著高于对照组;处理12 h后酚氧化酶活性有所下降但仍显著高于对照组,至处理24 h时降至对照组水平。经20E处理后,家蚕血淋巴酚氧化酶活性在处理3 h后略高于对照组,但无显著差异,从处理6 h开始逐渐升高,至处理12 h时酚氧化酶活性达峰值,与对照组的差异达极显著水平,但在处理24 h后酚氧化酶活性又恢复至对照组水平。由图6可看出,家蚕体壁酚氧化酶活性在JH处理6和12 h后显著低于对照组,而经20E处理6和12 h后显著高于对照组,说明JH和20E对家蚕体壁酚氧化酶活性的影响并不一致,即JH能抑制酚氧化酶活性,而20E能增强酚氧化酶活性。
3 讨论
酚氧化酶作为一类免疫效应因子,能有效抵御病原微生物的入侵,并通过调节吞噬和黑化等过程,参与昆虫先天性免疫防御反应(Yang et al.,2018)。酚氧化酶也是昆虫体内的一类重要氧化酶,在体壁鞣化、硬化及着色过程中发挥着重要作用(Endler et al.,2018)。酚氧化酶能将表皮中的酚类物质氧化为醌,醌与相应的表皮蛋白发生鞣化,促使表皮硬化。此外,醌类物质可发生一系列的聚合反应,形成黑色素而致使表皮着色(Gibert et al.,2018)。研究发现,黄粉虫幼虫蜕皮初期,血淋巴酚氧化酶活性较高,随着新表皮的不断黑化和硬化,其活性逐渐下降,但在蜕皮结束后又逐渐升高,暗示酚氧化酶参与黄粉虫幼虫体壁的硬化(刘守柱等,2009)。杨伟克等(2019a)研究发现,家蚕四龄将眠时酚氧化酶原基因PPO1和PPO2的表达量显著升高,随后逐渐减弱,但眠起后又逐渐增加,提示酚氧化酶原基因在家蚕蜕皮过程中发挥重要作用。
JH和20E是昆虫机体极其重要的两类激素,协同调控昆虫的蜕皮、变态及生长发育(Kayukawa et al.,2017),并参与表皮黑色素的生成(Wu et al.,2016)。保幼激素类似物JHA能增强亚洲玉米螟五龄幼虫的酚氧化酶活性,20E则抑制酚氧化酶活性(赵同伟,2015)。本研究结果表明,注射外源JH和20E均能促进家蚕血淋巴PPO1和PPO2基因的表达,显著增加酚氧化酶活性。家蚕血淋巴PPO1和PPO2基因对JH和20E的响应时间存在一定差异,经JH处理后酚氧化酶原基因PPO1和PPO2仅在处理6和12 h时显著上调表达;而经20E处理后PPO1和PPO2基因从处理3 h开始一直持续到12 h均呈上调表达趋势。JH和20E对家蚕体壁PPO1和PPO2基因的影响恰好相反。JH抑制家蚕体壁PPO1和PPO2基因的表达,降低酚氧化酶活性;而20E能促进家蚕体壁PPO1基因上调表达,但不影响PPO2基因的表达。昆虫体壁的着色及鞣化过程均需要酚氧化酶参与,同时受蜕皮激素和保幼激素的协同调控,体壁酚氧化酶主要在蜕皮变态时参与旧表皮融离及新表皮合成(Liu et al.,2015;Gibert et al.,2018)。家蚕蜕皮时其机体内的20E滴度较高,此时体壁PPO1基因受20E诱导作用,表达量增加,酚氧化酶被激活,参与家蚕蜕皮变态。JH的主要功能是维持虫态及促进其生长发育,并拮抗20E的作用,因此家蚕体壁PPO1和PPO2基因表达受JH抑制。本研究还发现,不管是JH处理还是20E处理,家蚕血淋巴PPO1基因的相对表达量均高于PPO2基因,说明PPO1基因对JH和20E的响应更强,同时暗示PPO1在蠶体的激素代谢过程中可能发挥着更重要的作用。
已有的研究主要聚焦于JH和20E调控昆虫丝腺相关基因P25、fib-H、fib-L和ser-1等的表达,且近年来发现昆虫激素对机体其他基因也有一定的调控作用(Zhao et al.,2015)。杨欢欢(2016)研究发现,20E能促进五龄前期家蚕丝腺磷酸吡哆醛激酶基因(PLK)和磷酸吡哆醇氧化酶基因(PNOP)的表达,而JH对PLK和PNOP基因的表达具有抑制作用。Mai等(2017)通过研究家蚕抗菌肽基因Lebocin在其中肠的表达调控机制,发现20E可通过上调转录因子BmBR-CZ4和BmEts,进而启动Lebocin基因表达。此外,黑腹果蝇抗菌肽基因Drosocin、Cecropin和Attacin的表达可通过转录因子BR-C直接被20E调控,而不依赖于IMD通路;JH通过拮抗20E而抑制抗菌肽基因的表达(Verma and Tapadia,2015)。在半变态昆虫东亚飞蝗的相关研究中,发现20E可作为激活剂与EcR-RXR配体结合,通过激活PGRP-SA调控抗菌肽基因Defensin和Diptericin及溶菌酶基因lysozyme的表达(Han et al.,2017)。20E或JH可通过作用于基因启动子区域的应答调控元件实现对靶基因的调控(洪芳等,2016)。本研究发现,在外源激素注射前期(3~12 h)家蚕酚氧化酶活性及其基因表达均显著增加,但随着时间的延长,激素逐渐被消耗代谢,酚氧化酶原基因的表达及其活性不再受其影响,逐渐恢复到对照组水平。由于本研究注射JH和20E的剂量较低,在设定的测定时间范围内,蚕体并未出现病变及异常生理状况,酚氧化酶原基因表达及其活性测定也局限在处理后的24 h内。因此,若想通过昆虫激素调控蚕体酚氧化酶活性,增强蚕体免疫能力,进而培育抗逆新品种,则需对激素处理的剂量和时间进行更深入细致的探究。
4 结论
家蚕酚氧化酶原基因PPO1和PPO2表达受JH和20E的调控,且激素对酚氧化酶原基因表达水平的影响与其酶活性变化规律一致,提示酚氧化酶不仅参与昆虫激素的代谢,还与激素协同调控家蚕的蜕皮变态。
参考文献:
柴连琴,苗迎春,王乐. 2015. 20-羟基蜕皮酮对棉铃虫免疫系统的影响[J]. 四川动物,34(5):739-747. [Chai L Q,Miao Y C,Wang L. 2015. The effects of 20-hydroxyecdysone on cotton bollworm immune system[J]. Sichuan Journal of Zoology,34(5):739-747.]
陈晓宇,时敏,陈学新. 2015. 昆虫酚氧化酶原激活酶研究[J]. 应用昆虫学报,52(2):281-288. [Chen X Y,Shi M,Chen X X. 2015. The prophenoloxidase activating proteinase in insects[J]. Chinese Journal of Applied Entomo-logy,52(2):281-288.]
杜育哲,郭世宜,王秀玲,刘安西,汪清民,黄润秋. 2002. 新型非甾醇蜕皮激素类杀虫剂对棉铃虫幼虫蜕皮的影响[J]. 昆虫学报,45(6):748-752. [Du Y Z,Guo S Y,Wang X L,Liu A X,Wang Q M,Huang R Q. 2002. The effects of a new type of nonsteroidal ecdysteroid agonist on cuticle formation in larvae of the cotton bollworm(Helicoverpa armigera)[J]. Acta Entomologica Sinica,45(6):748-752.]
洪芳,宋赫,安春菊. 2016. 昆虫变态发育类型与调控机制[J]. 应用昆虫学报,53(1):1-8. [Hong F,Song H,An C J. 2016. Introduction to insect metamorphosis[J]. Chinese Journal of Applied Entomology,53(1):1-8.]
金华超,尹晓辉,朱国念. 2013. 四种杀菌剂对玉米螟赤眼蜂酚氧化酶活性的影响[J]. 昆虫学报,56(2):136-144. [Jin H C,Yin X H,Zhu G N. 2013. Effect of four fungicides on phenoloxidase activity in Trichogramma ostriniae(Hymenoptera:Trichogrammatidae)[J]. Acta Entomologica Sinica,56(2):136-144.]
李一波,曹广春,贾苗,纪明山. 2017. 曲酸对飞蝗酚氧化酶以及其他生化酶活性的影响[J]. 环境昆虫学报,39(3):640-649. [Li Y B,Cao G C,Jia M,Ji M S. 2017. The effects of kojic acid on the activities of phenoloxidase and other biochemical enzymes of Locust migratoria L.[J]. Journal of Environmental Entomology,39(3):640-649.]
刘守柱,薛超彬,罗万春. 2009. 黄粉虫幼虫体壁硬化过程中酚氧化酶活性的变化[J]. 昆虫学报,52(9):941-945. [Liu S Z,Xue C B,Luo W C. 2009. Phenoloxidase acti-vity during cuticle sclerotization in larvae of Tenebrio molitor(Coleoptera:Tenebrionidae)[J]. Acta Entomologica Sinica,52(9):941-945.]
毛钰霞,赵晓明,许雅香,沈卫德,卫正国. 2017. 不同家蚕品种与野桑蚕大龄期幼虫血淋巴和体壁中的多酚氧化酶活性检测分析[J]. 蚕业科学,43(5):782-788. [Mao Y X,Zhao X M,Xu Y X,Shen W D,Wei Z G. 2017. Ana-lysis of polyphenol oxidase activity in hemolymph and integument during late developmental stage of different Bombyx mori varieties and Bombyx mandarina larvae[J]. Science of Sericulture,43(5):782-788.]
庞海玉,宇佳,迟德富,李晓灿,钱晶晶,张朝群. 2013. 20-羟基蜕皮甾酮对异色瓢虫幼虫的活力和保护酶活性的影响[J]. 江苏农业学报,29(2):288-293. [Pang H Y,Yu J,Chi D F,Li X C,Qian J J,Zhang C Q. 2013. Influence of 20-hydroxyecdysone on vitality and protective enzyme activities of fourth instar larvae of Harmonia axyridis Pallas[J]. Jiangsu Journal of Agricultural Sciences,29(2):288-293.]
唐芬芬,楊伟克,朱峰,邵榆岚,张永红,白兴荣. 2016. 家蚕核型多角体病毒对家蚕酚氧化酶活性及其基因表达的影响[J]. 中国农学通报,32(32):25-28. [Tang F F,Yang W K,Zhu F,Shao Y L,Zhang Y H,Bai X R. 2016. BmNPV affecting the activity and gene expression of phenoloxidase in Bombyx mori[J]. Chinese Agricultural Science Bulletin,32(32):25-28.]
杨欢欢. 2016. 外源激素对家蚕磷酸吡哆醛合成酶转录水平的影响及转录组学分析[D]. 合肥:安徽农业大学. [Yang H H. 2016. The study of the transtriptional level of synthetase of pyridoxal-5'-phosphate and the transcriptomics analysis in the silkworm,Bombyx mori[D]. Hefei:Anhui Agricultural University.]
杨伟克,刘增虎,钟健,董占鹏. 2019a. 家蚕眠期血淋巴酚氧化酶活性变化及其基因表达分析[J]. 南方农业学报,50(2):391-396. [Yang W K,Liu Z H,Zhong J,Dong Z P. 2019a. Variation of activity of phenoloxidase and its gene expression in hemolymph of Bombyx mori larvae during molting stage[J]. Journal of Southern Agriculture,50(2):391-396.]
杨伟克,唐芬芬,刘增虎,钟健,董占鹏. 2019b. 喂食细菌对家蚕血淋巴酚氧化酶活性及其基因表达的影响[J]. 中国农学通报,35(5):160-164. [Yang W K,Tang F F,Liu Z H,Zhong J,Dong Z P. 2019b. Feeding bacteria:Effect on phenoloxidase activity and its gene expression in hemolymph of Bombyx mori[J].Chinese Agricultural Science Bulletin,35(5):160-164.]
苑勝垒,管京敏,杨兵,路岸瑞,凌尔军,宋红生. 2016. 昆虫免疫蛋白多酚氧化酶的研究进展[J]. 生命科学,28(1):70-76. [Yuan S L,Guan J M,Yang B,Lu A R,Ling E J,Song H S. 2016. Recent achievements on the insect important innate immunity protein prophenoloxidase[J]. Chinese Bulletin of Life Sciences,28(1):70-76.]
张道伟,陈静. 2014. 酚氧化酶参与德国小蠊对大肠杆菌的免疫应答[J]. 昆虫学报,57(10):1123-1132. [Zhang D W,Chen J. 2014. Phenoloxidase is involved in regulating immune response to Escherichia coli in Blattella germanica (Blattodea:Blattellidae)[J]. Acta Entomologica Sinica,57(10):1123-1132.]
赵同伟. 2015. 亚洲玉米螟Ostrinia furnacalis Guenée酚氧化酶原的原核表达和性质分析[D]. 扬州:扬州大学. [Zhao T W. 2015. Prokaryotic expression and characte-rization of prophenoloxidase from the Asian corn borer,Ostrinia furnacalis(Lepidoptera:Pyralidae)[D]. Yangzhou:Yangzhou University.]
Endler L,Gibert J M,Nolte V,Schl?tterer C. 2018. Pleiotropic effects of regulatory variation in tan result in correlation of two pigmentation traits in Drosophila melanogaster[J]. Molecular Ecology,27(16):3207-3218.
Gibert J M,Mouchel-Vielh E,Peronnet F. 2018. Pigmentation pattern and developmental constraints:Flight muscle attachment sites delimit the thoracic trident of Drosophila melanogaster[J]. Scientific Reports,8(1):5328. doi:10. 1038/s41598-018-23741-4.
Gui Z Z,Lee K S,Kim B Y,Choi Y S,Wei Y D,Choo Y M,Kang P D,Yoon H J,Kim I,Je Y H,Seo S J,Lee S M,Guo X,Sohn H D,Jin B R. 2006. Functional role of aspartic proteinase cathepsin D in insect metamorphosis[J]. BMC Developmental Biology,6:49. doi:10.1186/1471-213X-6-49.
Han P F,Han J,Fan J Q,Zhang M,Ma E B,Li S,Fan R J,Zhang J Z. 2017. 20-hydroxyecdysone activates PGRP-SA mediated immune response in Locusta migratoria[J]. Developmental and Comparative Immunology,72:128-139.
Jearaphunt M,Noonin C,Jiravanichpaisal P,Nakamura S,Tassanakajon A,S?derh?ll I,S?derh?ll K. 2014. Caspase-1-like regulation of the proPO-system and role of ppA and caspase-1-like cleaved peptides from proPO in innate immunity[J]. PLoS Pathogens,10(4):e1004059.
Kayukawa T,Jouraku A,Ito Y,Shinoda T. 2017. Molecular mechanism underlying juvenile hormone-mediated repression of precocious larval-adult metamorphosis[J]. Procee-dings of the National Academy of Sciences of the United States of America,114(5):1057-1062.
Liu S S,Wang M,Li X C. 2015. Overexpression of Tyrosine hydroxylase and Dopa decarboxylase associated with pupal melanization in Spodoptera exigua[J]. Scientific Reports,5:11273. doi:10.1038/srep11273.
Mai T Y,Chen S N,Lin X Y,Zhang X J,Zou X P,Feng Q L,Zheng S C. 2017. 20-hydroxyecdysone positively regulates the transcription of the antimicrobial peptide,lebocin,via BmEts and BmBR-C Z4 in the midgut of Bombyx mori during metamorphosis[J]. Developmental and Comparative Immunology,74:10-18.
Verma P,Tapadia M G. 2015. Early gene Broad complex plays a key role in regulating the immune response triggered by ecdysone in the malpighian tubules of Drosophila melanogaster[J]. Molecular Immunology,66(2):325-339.
Wang M X,Lu Y,Cai Z Z,Liang S,Niu Y S,Miao Y G. 2013. Phenol oxidase is a necessary enzyme for the silkworm molting which is regulated by molting hormone[J]. Molecular Biology Reports,40(5):3549-3555.
Wu T Y,Zhao Y,Wang Z Y,Song Q S,Wang Z X,Xu Q W,Wang Y J,Wang L B,Zhang Y Q,Feng C J. 2017. β-1,3-Glucan recognition protein 3 activates the prophenoloxidase system in response to bacterial infection in Ostrinia furnacalis Guenée[J]. Developmental and Comparative Immunology,79:31-43.
Wu Z X,Guo W,Xie Y T,Zhou S T. 2016. Juvenile hormone activates the transcription of cell-division-cycle 6 (Cdc6) for polyploidy-dependent insect vitellogenesis and ooge-nesis[J]. The Journal of Biological Chemistry,291(10):5418-5427.
Xu M,Wang X,Tan J,Zhang K,Guan X,Patterson L H,Ding H F,Cui H J. 2015. A novel Lozenge gene in silkworm,Bombyx mori regulates the melanization response of hemolymph[J]. Developmental and Comparative Immuno-logy,53(1):191-198.
Yang Y H,Tang H H,Zhang Y Y,Zhu F F,Lü P,Yao Q,Chen K P. 2018. Research progress on the immune mecha-nism of the silkworm Bombyx mori[J]. Physiological Entomology,43(3):159-168.
Zhang H H,Luo M J,Zhang Q W,Cai P M,Idrees A,Ji Q E,Yang J Q,Chen J H. 2018. Molecular characterization of prophenoloxidase-1(PPO1) and the inhibitory effect of kojic acid on phenoloxidase(PO) activity and on the development of Zeugodacus tau(Walker)(Diptera:Tephritidae)[J]. Bulletin of Entomological Research,109(2):236-247.
Zhao X M,Liu C,Jiang L Y,Li Q Y,Zhou M T,Cheng T C,Mita K,Xia Q Y. 2015. A juvenile hormone-transcription factor Bmdimm-fibroin H chain pathway is involved in the synthesis of silk protein in silkworm,Bombyx mori[J]. Journal of Biological Chemistry,290(2):972-986.
(責任编辑 兰宗宝)
