改良型痘苗病毒安卡拉株表达系统可删除筛选标记的双表达穿梭载体
2011-02-10郑其升毕志香李梅清侯继波陈溥言
郑其升,毕志香,李梅清,侯继波,陈溥言
1 国家兽用生物制品工程技术研究中心,南京 210014
2 山东省畜牧兽医职业学院,潍坊 261061
3 南京农业大学 农业部动物疫病诊断与免疫重点开放实验室,南京 210095
随着DNA重组技术的发展和应用,疫苗研究正逐渐从传统的灭活和减毒疫苗向基因工程疫苗过渡,特别是以病毒和细菌为载体的重组活疫苗的研制,有望克服常规疫苗的一些弊端。但同时,重组病毒的安全性问题也越来越多地受到人们的关注[1]。在获得重组活载体疫苗后,一般随同目的基因转入载体的还有非目的基因,主要是抗性选择基因或报告基因。利用标记基因等可以从大量非转化细胞中将阳性重组克隆筛选出来,但随着重组病毒的传代,抗性选择基因变得不再有用,却仍在细胞内表达,这些基因也可能会进入环境中,产生安全性问题。因此,如果在获得重组活载体疫苗后,能除去这些非目的基因片段,可大大提高重组疫苗的安全性。
Cre/LoxP DNA重组系统具有位点特异、时期特异、组织特异和高效重组的特点,被广泛用于细菌、真菌、植物、昆虫和哺乳动物的体内、体外基因重组[2]。Cre和LoxP均来自于P1噬菌体,其介导因重组不需要其他蛋白质或辅助因子参与,仅需纳摩尔的量即可与LoxP位点结合,完成体内或体外的DNA重组,将外源基因定点整合到染色体上或将特定的DNA片段删除;Cre/LoxP重组系统在基因靶位操作、基因功能鉴定、外源基因整合等方面得到了广泛的应用,在转基因酵母、植物、昆虫、哺乳动物的体内外DNA重组方面成为有力的工具[3-4]。
改良型痘苗病毒安卡拉株 (Modified vaccinia virus ankara,MVA) 是亲本痘苗病毒安卡拉株经鸡胚成纤维细胞 (CEF) 连续传代 500次以上所获得的高度减毒的复制缺陷型痘苗病毒株。鉴于 MVA突出的安全性和免疫原性,近年来通过基因重组构建的rMVA已被广泛应用于多种重要传染病及肿瘤的疫苗研制,并已取得良好的效果[5-8]。在本研究中,我们构建了一种实用新型可删除筛选标记双表达穿梭载体pLR-gpt。为了彻底删除筛选标记实现重组病毒无标记,将重组病毒的筛选标记基因放在 2个同向LoxP位点间;而在2个LoxP位点外,设有2个多克隆位点,可插入目的基因表达盒。当穿梭载体与MVA基因组发生同源重组后,利用gpt抗性筛选阳性克隆,然后将重组病毒接种 BHK-Cre细胞,2个同向LoxP位点间的筛选标记基因将被剔除,最终获得删除筛选标记的重组病毒。
为了验证系统的有效性,将 PRRSVNJ-a株ORF5与ORF6基因分别克隆入pLR-gpt的2个多克隆位点中,经脂质体介导,将构建好的 pLR-ORF5/ ORF6转染已感染亲本MVA 2 h的BHK-21细胞单层,用药物选择性培养基 (MXHAT) 在24孔板上进行连续筛选纯化,得到带有筛选标记的重组病毒rMVAgpt-GP5/M。将rMVAgpt-GP5/M感染BHK-Cre,经PCR和病毒生长曲线鉴定,获得删除筛选标记的重组病毒rMVA-GP5/M,筛选标记gpt已被完全删除。
1 材料与方法
1.1 质粒、菌种及细胞
MVA表达系统转移载体pLR-lacZ,由美国范德比特尔大学传染病学部张秀根博士惠赠,由本实验室保存,其筛选标记为lacZ基因;鸡痘病毒表达系统的转移载体 pEFgpt12S,由美国明尼苏达大学张玉根博士惠赠,具有一个痘苗病毒的双向启动子,其中P7.5调控筛选标记Eco gpt基因的表达;克隆质粒pBluescript SK II(+) 及宿主菌大肠杆菌DH5α,由本实验室保存;质粒pMD18-T载体购自TaKaRa公司;BHK-21细胞由本实验室保存;表达Cre酶的BHK-21细胞系由本实验室苏鑫铭博士构建;含有PRRSV NJ-a株ORF5及ORF6基因的重组质粒由笔者构建。
1.2 工具酶与试剂
DNA分子量标准 DL2000、DL15000,限制性内切酶PmeⅠ、AscⅠ、KpnⅠ、SacⅠ、ApaⅠ及T4 DNA连接酶、dNTPs、LA Taq DNA聚合酶为宝生物 (大连) 公司产品;DNA胶回收试剂盒购自上海华舜生物公司;霉酚酸 (Mycophenolic Acid,MPA)购自Sigma公司;黄嘌呤、氨基喋呤、胸苷均购自Promega公司;LipofectaminTM2000转染试剂盒购自Invitrogen公司;胰酶购自Difico公司;兔抗PRRSV NJ-a株高免血清由本室制备,系用纯化的 PRRSV NJ-a株多次免疫家兔制备;兔抗 PRRSV NJ-a株GP5、M 蛋白的特异性多抗由本室制备,系分别用纯化的原核表达的重组GP5与M蛋白多次免疫家兔制备;HRP标记的羊抗兔 IgG、FITC标记的羊抗兔IgG均购自晶美生物公司;其他各种化学试剂均为分析纯。
1.3 引物设计
根据质粒pLR-lacZ序列分析结果,在筛选标记lacZ基因与左重组臂之间设计一对特异性引物P1、P2,用于扩增pLR-lacZ中除去lacZ的部分,在P1的5′端依次添加KpnⅠ与SacⅠ位点;在P2的5′端依次添加KpnⅠ、ApaⅠ与MluⅠ位点,在ApaⅠ位点之后加入了一个痘苗病毒早期转录双向终止信号;根据质粒 pEFgpt12S的序列分析结果,设计一对特异性引物 P3、P4,用于扩增由痘苗病毒 P7.5启动子调控表达的Eco gpt基因,在2条引物的5′端添加2个同向的LoxP基因序列,然后在LoxP基因序列外侧分别加入 SacⅠ及 ApaⅠ位点;P5、P6为检测重组MVA的特异性引物,所有引物均为上海英骏生物技术公司合成。

表1 PCR反应所用引物Table 1 Primers used for gene PCR amplification in the study
1.4 可删除筛选标记双表达穿梭载体 pLR-gpt的构建
利用引物 P1、P2,以原有的转移载体质粒pLR-lacZ为模板,扩增包括质粒骨架、左右重组臂,以及痘苗病毒启动子在内的基因序列。PCR产物回收纯化后用KpnⅠ单酶切,酶切产物再回收,在T4 DNA连接酶作用下自连,获得删除lacZ筛选标记的转移载体pLR。
利用引物P3、P4,以禽痘病毒表达系统的转移载体pEFgpt12S为模板,扩增Eco gpt基因表达盒(P7.5+Eco gpt),PCR产物克隆入pMD18-T载体后,获得重组质粒 pMD-LoxP-gpt-LoxP,将阳性质粒送交大连宝生物生物工程公司进行序列测定,以验证2个同向LoxP位点与Eco gpt表达盒基因序列的正确性。将测序正确的质粒,用AscⅠ与ApaⅠ双酶切,回收目的基因,克隆入经相同酶处理的质粒 pLR,获得改造后的重组转移载体,命名为pLR-gpt。
1.5 含有 PRRSV 基因的双表达穿梭载体pLR-ORF5/ORF6的构建
用PmeⅠ与AscⅠ双酶切PRRSV NJ-a株ORF5基因后克隆入 pLR-gpt相应的位点中,获得重组质粒pLRgpt-ORF5;利用SacⅠ与ApaⅠ双酶切PRRSV NJ-a株ORF6基因后克隆入pLRgpt-ORF5相应的位点中,获得共表达PRRSV NJ-a株ORF5与ORF6基因的重组MVA转移载体pLRgpt-ORF5/ORF6。
1.6 删除筛选标记重组MVA的获得及删除
重组转移载体与亲本 MVA的共转染照LipofectaminTM2000转染试剂盒说明书步骤进行。用含2% MXHAT的DMEM 10倍连续稀释病毒,接种到长满单层BHK-21细胞的24孔板,接毒量500 µL/孔,37 ℃吸附1 h,用PBS洗涤2次,用含2%胎牛血清的选择性培养基维持,每隔 48 h换 1次液,逐日观察,收获稀释倍数大且出现病变孔的病毒液,如此反复,直到病毒在选择性培养基和正常培养基中的TCID50值达到一致,表明重组病毒已纯化,为防止细胞脱落,在接毒前2 h更换选择性培养基。
以0.1 MOI接种纯化的rMVAgpt-GP5/M于长满BHK-Cre细胞的6孔板,37 ℃、5% CO2培养至细胞病变明显后收获病毒。收获病毒分为 2份,1份重新接种BHK-Cre细胞,另1份接种BHK-21细胞,用2%的MXHAT选择性培养基培养,连续反复传代筛选,直到所收获病毒在 BHK-21细胞上以选择性培养基培养不形成病变,得到删除筛选标记的重组病毒rMVA-GP5/M。
1.7 重组MVA筛选标记删除的鉴定
提取rMVAgpt-GP5/M与rMVA-GP5/M病毒基因组作为模板,利用引物P5、P6进行目的基因的扩增,以鉴定筛选标记基因在MVA基因组中的插入与缺失,同时设亲本MVA基因组DNA对照。
取纯化的rMVA-GP5/M、rMVAgpt-GP5/M和亲本MVA,分别以2.0 MOI感染24孔板BHK-21细胞单层,37 ℃吸附1 h,用DMEM冲洗3 次,加入含2% FCS的DMEM与含2% MXHAT选择性培养基,于37 ℃、5% CO2培养箱中培养。分别在接毒后12、24、48、72 h时,收获病毒,测定病毒的TCID50,绘制生长曲线。
1.8 外源基因表达的鉴定
1.8.1 重组病毒Western blotting分析
将纯化的rMVA-GP5/M按2.0 MOI接种单层的BHK-21细胞,感染48 h后收集并裂解细胞,进行SDS-PAGE分离、转膜后以兔抗PRRSV NJ-a株多克隆抗体为一抗,以HRP标记的羊抗兔IgG抗体为二抗进行显色反应,显色后观察是否存在与预期蛋白大小一致的蛋白条带。
1.8.2 重组病毒IFA鉴定
将纯化的rMVA-GP5/M按2.0 MOI接种单层的BHK-21细胞,在感染后 48 h,弃营养液,每孔用PBS (pH 7.4) 洗涤3次,加−20 ℃预冷的固定液 (丙酮∶乙醇=6∶4),固定5 min,用PBS漂洗3次后空气干燥;分别加入1∶100稀释的兔抗PRRSV NJ-a株GP5或M蛋白的高免血清,37 ℃作用30 min;PBS漂洗3次后,加入FITC标记的羊抗兔抗体,37 ℃作用45 min;PBS漂洗3次,风干后直接观察荧光。同时以MVA感染细胞作对照。
2 结果与分析
2.1 骨架质粒的获得
以转移载体 pLR-lacZ为模板,扩增除去 lacZ基因的质粒全长基因。PCR产物经 1%琼脂糖凝胶电泳观察,可清晰看到位于4 000 bp附近的特异性条带。PCR产物回收后经KpnⅠ单酶切,酶切产物再回收,在T4 DNA连接酶作用下进行连接反应。连接产物转化大肠杆菌DH5α感受态细胞,挑取单菌落,碱裂解法提取质粒,用KpnⅠ单酶切鉴定,可见约4 000 bp的单一片段 (图略),表明成功获得骨架质粒pLR,测序结果也证实了我们的结论。
2.2 带有2个同向LoxP位点的Eco gpt基因表达盒的扩增
以禽痘病毒表达系统的转移质粒 pEFgpt12S为模板,利用引物 P3、P4,扩增带有 2个同向 LoxP位点的Eco gpt基因表达盒。PCR产物回收后克隆入pMD18-T载体,用SacⅠ与ApaⅠ双酶切鉴定,可见2 600 bp的载体片段与890 bp的目的基因片段(图略),阳性重组质粒命名为pMD-LoxP-gpt-LoxP。序列测定结果证实了LoxP位点及Eco gpt基因表达盒序列的正确性。
2.3 可删除筛选标记的双表达转移载体的构建结果
将 pMD-LoxP-gpt-LoxP用 SacⅠ/ApaⅠ双酶切,回收890 bp的条带与用同样2个酶处理的pLR进行连接,转化大肠杆菌 DH5α感受态细胞后,挑取白色菌落,碱裂解法小量提取质粒,经 SacⅠ与ApaⅠ双酶切鉴定为阳性,命名为pLR-gpt (图1),表明带有2个同向LoxP位点的以Eco gpt为筛选标记的重组痘苗病毒转移载体构建成功,载体构建的过程见图2。
2.4 含有PRRSV基因的双表达穿梭载体构建结果

图1 重组质粒pLR-gpt的酶切鉴定Fig. 1 Identification of the recombinant plasmid pLR-gpt. 1: DNA marker DL2000; 2: recombinant plasmid pLR-gpt digested by SacⅠand ApaⅠ.
pLR-ORF5/ORF6用 PmeⅠ/AscⅠ或 MluⅠ/ ApaⅠ双酶切,酶切产物电泳,在紫外光灯下出现4 000 bp的载体片段及603 bp的ORF5基因或525 bp的 ORF6基因,表明重组转移载体构建成功,结果见图3。
2.5 删除筛选标记重组MVA的获得及鉴定
以rMVAgpt-GP5/M为亲本毒,在BHK-Cre细胞上筛选纯化后得到 rMVA-GP5/M。rMVA-GP5/M在 2% MXHAT选择性培养基中完全不能产生病变,说明在Cre酶的作用下,rMVAgpt-GP5/M中的Eco gpt表达盒已被正确删除。
2.6 删除筛选标记重组MVA的鉴定
rMVAgpt-GP5/M中带 2个同向 LoxP位点的Eco gpt表达盒为890 bp,本实验设计的引物实际扩增大小为 1 012 bp (下游引物位于重组臂上),rMVA-GP5/M由于Eco gpt表达盒被删除,所以没有扩增产物。结果表明,在Cre酶的作用下,Eco gpt表达盒被正确除去,结果见图4。
2.7 外源基因表达的鉴定结果
2.7.1 Western blotting分析
由图5可见,rMVAgpt-GP5/M感染的细胞能够出现25 kDa和19 kDa的蛋白条带,而亲本毒对照孔没有任何条带。结果表明,构建的重组病毒能够同时表达GP5和M蛋白,并且表达产物具有与兔抗PRRSV NJ-a株阳性血清结合的能力。
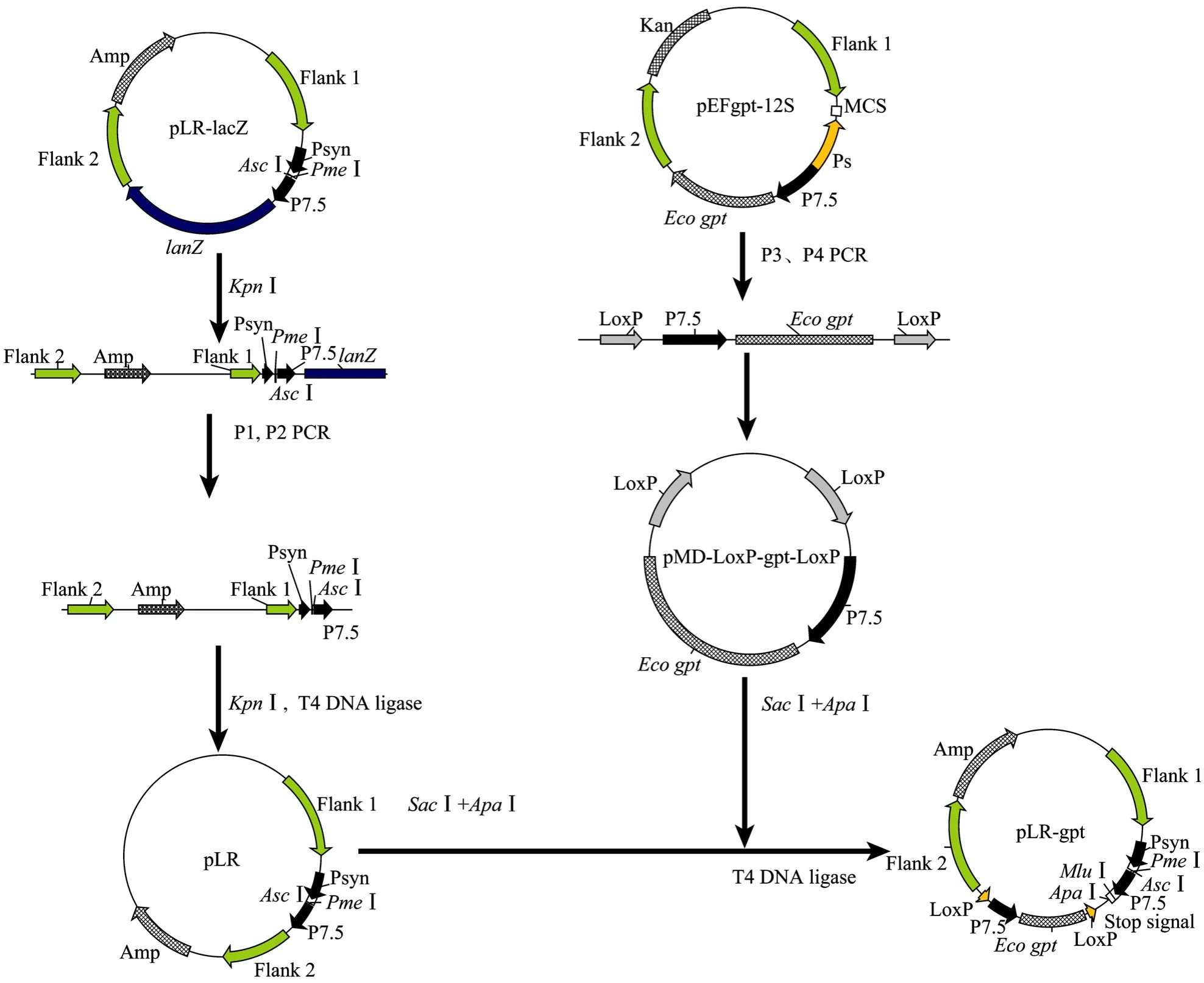
图2 改良型痘苗病毒安卡拉株表达系统可删除筛选标记的双表达载体的构建流程图Fig. 2 Construction for the marker free bio-expression transfer vector of the MVA expression system expression system.

图3 重组质粒pLRgpt-ORF5/ORF6的双酶切鉴定Fig. 3 Identification for the recombinant plasmid pLRgpt-ORF5/ORF6. 1: pLRgpt-ORF5/ORF6 digested with PmeⅠand AscⅠ ; 2: DNA marker DL2000; 3: pLRgpt -ORF5/ORF6 digested with MluⅠand Apa Ⅰ; 4: DNA marker DL15000.

图4 重组病毒筛选标记删除的PCR鉴定Fig. 4 PCR identification for ECO gpt deletion of recombinant virus. 1: rMVAgpt-GP5/M amplified with primer P5 and P6; 2: rMVA-GP5/M amplified with primer P5 and P6; 3: DNA marker DL2000.
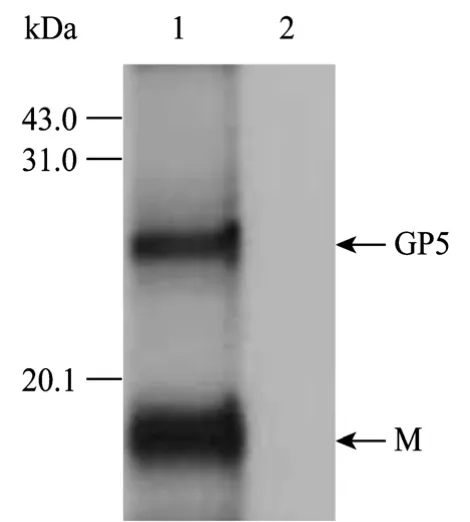
图5 rMVAgpt-GP5/M的Western blotting鉴定Fig. 5 Western blotting analysis of rMVAgpt-GP5/M. 1: rMVAgpt-GP5/M reacts with PRRSV positive serum; 2: MVA reacts with PRRSV positive serum.
2.7.2 IFA鉴定
纯化的rMVAgpt-GP5/M和亲本毒MVA分别感染 BHK-21细胞,待病变明显后进行间接免疫荧光染色,结果 rMVAgpt-GP5/M 感染细胞经与兔抗GP5、M 特异性多抗反应后均呈现很强的绿色荧光(图6),而亲本毒MVA感染细胞没有荧光,进一步证明重组病毒能同时表达GP5和M蛋白。
2.8 重组病毒在BHK-21细胞上的生长特性

图6 IFA检测重组病毒感染BHK-21细胞中PRRSV蛋白的表达Fig. 6 Immunofluorescence assay with rMVAgpt-GP5/M-infected BHK-21 cells. (A) rMVAgpt-GP5/M infected BHK-21 cells reacted with GP5-specific antiserum. (B) rMVAgpt-GP5/M infected BHK-21 cells reacted with M-specific antiserum. (C) Negative control.
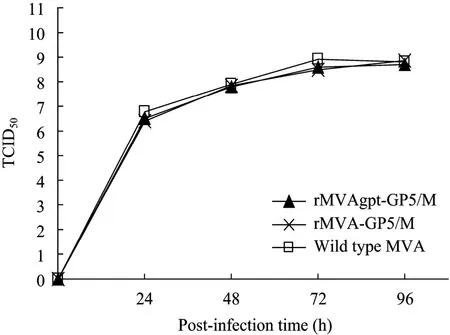
图7 重组病毒rMVAgpt-GP5/M、rMVA-GP5/M与亲本毒MVA在2% DMEM培养基中的生长曲线Fig. 7 One-step growth cruve for rMVAgpt-GP5/M, rMVA-GP5/M and wtMVA in DMEM containing 2% FCS.
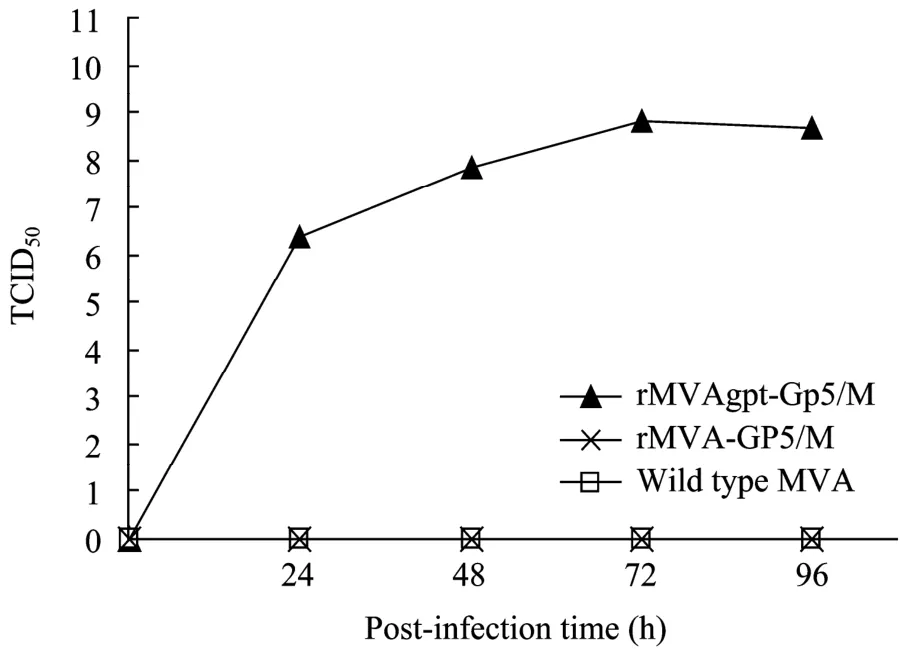
图8 重组病毒rMVAgpt-GP5/M、rMVA-GP5/M与亲本毒MVA在2% MXHAT培养基中的生长曲线Fig. 8 One-step growth cruve for rMVAgpt-GP5/M, rMVA-GP5/M and wtMVA in DMEM containing 2% MXHAT.
rMVA-GP5/M与rMVAgpt-GP5/M在BHK-21细胞上分别以普通培养基与选择性培养基 (含 2% MXHAT) 进行培养,生长曲线见图 7、8。由图 7可见,当2个重组病毒在2% DMEM中培养时,滴度与亲本毒MVA基本一致,说明外源基因的插入不影响病毒的增殖;由图8可见,当2个重组病毒在选择性培养基中培养时,rMVAgpt-GP5/M滴度未发生明显的变化,而rMVA-GP5/M与亲本毒MVA的生长被完全抑制,也表明在 Cre酶的作用下,rMVAgpt-GP5/M中的Eco gpt表达盒已被正确删除。
3 讨论
MVA的亲本病毒早先是从马的痘损害中分离获得,起初经驴皮肤划痕传代,经CEF连续传516代后,其宿主范围和组织病理表型发生了显著的变化,除在CEF和极少数哺乳细胞 (BHK-21) 中能够进行有效增殖以外,在绝大多数哺乳细胞中都受到严格的限制。与亲本病毒导致大的皮肤溃疡痘痕不同,接种MVA后仅产生小的白色痘痕[9-10]。
改良型痘病毒安卡拉株是研究传染病与癌症重组活载体疫苗的首选载体。活载体疫苗能够模仿体内病毒感染的过程,向机体的免疫系统提供“危险信号”。另外,痘病毒的生活周期允许疫苗抗原能够在感染细胞的细胞浆中进行从头合成,对抗原分子向MHC-Ⅰ类分子的有效递呈,引发特异性CD8+T细胞反应特别有利。与复制型痘苗病毒不同,MVA的宿主范围很窄,对人类及其他哺乳动物仅产生一过性感染,接种后的副反应小。因此,许多利用MVA作为载体的前临床疫苗已经在动物模型中显示了非常好的保护型体液免疫与细胞免疫反应[10]。也正是由于MVA载体具有的这些优点,使其从众多的活病毒载体中脱颖而出,成为目前重组病毒活载体疫苗研究的热点。目前,对重组MVA活载体疫苗的研究已进入应用阶段。以其作为载体表达 HIV gag-pol和env基因及疟疾红前期抗原CSP的重组活载体疫苗已分别进入了临床Ⅰ与Ⅱ试验[12-13]。
本实验室所用的 MVA表达系统的转移载体的筛选标记为lacZ基因,虽然利用lacZ基因作为筛选标记成功筛选到重组病毒的报道已经很多,但是我们这套表达系统还是存在许多缺点。1) 筛选标记基因lacZ过大 (3 500 bp),使得整个转移载体太大(7 200 bp),不便于基因的操作。2) 生物安全性问题,利用此筛选标记获得的重组病毒最终不能去除筛选标记,对于重组病毒的生物安全性存在严重的影响。3) 利用lacZ作为筛选标记,在筛选过程中需要用低熔点琼脂糖固定细胞以挑取噬斑,操作过于繁琐。4) 原有的转移载体只能进行单基因表达或者对多个基因进行融合表达,而不能对2个基因进行共表达。
对该系统进行改造后,转移载体的筛选标记Eco gpt基因大小只有890 bp,使转移质粒大大减小,方便了基因的操作;Cre/LoxP系统的引入提高了最终所获得重组病毒的生物安全性,利用本实验室所拥有的表达Cre酶的BHK-21细胞系 (BHK-Cre),在最后获得的重组病毒中,筛选标记Eco gpt基因将被删除,只保留一个LoxP位点;转移载体改造后,又添加了一个由痘苗病毒P7.5调控表达的多克隆位点框,因此可以对 2个基因同时进行共表达,这对于表达存在相互作用的2个蛋白特别有利。总之,本研究构建的可删除筛选标记的双表达穿梭载体,用于无筛选标记的重组改良型痘苗病毒安卡拉株构建,将为开发更安全高效重组 MVA活载体疫苗奠定基础。
[1] Liu Q, Zhu XQ. Biosafety. Beijing: Science Press, 2001.刘谦, 朱鑫泉. 生物安全. 北京: 科学出版社, 2001.
[2] Kinker DR, Swenson SL, Wu LL, et al. Evaluation of serological tests for the detection of pseudorabies gE antibodies during early infection. Vet Microbiol, 1997, 55(1/4): 99−106.
[3] Ray MK, Fagan SP, Brunicardi FC. The Cre-loxP system: a versatile tool for targeting genes in a cell- and stage-specific manner. Cell Transplant, 2000, 9(6): 805−815.
[4] Marx CJ, Lidstrom ME. Broad-host-range cre-lox system for antibiotic marker recycling in gram-negative bacteria. Biotechniques, 2004, 33(5): 1062−1067.
[5] Meyer H, Sutter G, Mayr A. Mapping of deletions in the genome of the highly attenuated vaccinia virus MVA and their influence on virulence. J Gen Virol, 1991, 72(5): 1031−1038.
[6] Antoine G, Scheiflinger F, Dorner F, et al. The complete genomic sequence of the modified vaccinia Ankara strain: comparison with other orthopoxviruses. Virology, 1998, 244(2): 365−396.
[7] Carroll MW, Moss B. Host range and cytopathogenicity of the highly attenuated MVA strain of vaccinia virus: propagation and generation of recombinant viruses in a nonhuman mammalian cell line. Virology, 2002, 238(2): 198−211.
[8] Sutter G, Moss B. Nonreplicating vaccinia vector efficiently expresses recombinant genes. Proc Natl Acad Sci USA, 1992, 89(22): 10847−10851.
[9] Blanchard TJ, Alcami A, Andrea P, et al. Modified vaccinia virus Ankara undergoes limited replication in human cells and lacks several immunomodulatory proteins: implications for use as a human vaccine. J Gen Virol, 1998, 79(5): 1159−1167.
[10] Sutter G, Staib C. Vaccinia vectors as candidate vaccines: the development of modified vaccinia virus Ankara for antigen delivery. Curr Drug Targets Infect Disord, 2003, 3(3): 263−271.
[11] Antoine G, Scheiflinger F, Dorner F, et al. The complete genomic sequence of the modified vaccinia Ankara strain: comparison with other orthopoxviruses. Virology, 1998, 244(2): 365−396.
[12] Dorrell L, Williams P, Suttill A, et al. Safety and tolerability of recombinant modified vaccinia virus Ankara expressing an HIV-1 gag/multiepitope immunogen (MVA.HIVA) in HIV-1-infected persons receiving combination antiretroviral therapy. Vaccine, 2007, 25(17): 3277−3283.
[13] Weyer J, Rupprecht CE, Mans J, et al. Generation and evaluation of a recombinant modified vaccinia virus Ankara vaccine for rabies. Vaccine, 2007, 25(21): 4213−4222.
