敬钊毒素-XI与突变体R3A-JZTX-XI的合成、复性及其药理活性鉴定
2011-02-10池宇朋邓梅春吴远远罗吉容明强张亦雅张东裔曾雄智梁宋平
池宇朋,邓梅春,吴远远,罗吉,容明强,张亦雅,张东裔,曾雄智,梁宋平
1 湖南师范大学 蛋白质化学与发育生物学教育部重点实验室,长沙 410081
2 国防科学技术大学理学院 化学与生物学系生物信息研究中心,长沙 410073
延迟整流钾通道主要负责动作电位复极化,其中该通道 Kv2.1亚型被发现在人等几类物种的β-胰岛细胞上广泛存在,有研究报道显示 Kv2.1通道在调节β-胰岛细胞的胰岛素分泌上发挥重要的作用[1-4]。河豚毒素不敏感型钠通道 Nav1.5亚型是心肌的主要钠通道并在心肌电活动中发挥重要作用,许多心脏疾病如长 QT综合症、心肌传导功能障碍等已经被证明是 Nav1.5基因突变所致[5]。敬钊毒素-XI (Jingzhaotoxin-XI,JZTX-XI) 是从我国境内新发现的珍稀蜘蛛敬钊缨毛蛛 Chilobrachys jingzhao[6]粗毒中纯化得到的一种新型肽类神经毒素。该毒素由34个氨基酸残基组成,分子中6个半胱氨酸形成 3对二硫键。前期的研究结果显示JZTX-XI对大鼠背根神经节细胞膜上表达的电压门控钠通道和钙通道均没有影响,却对非洲爪蟾卵母细胞上表达的 Kv2.1钾通道电流和急性分离的大鼠心肌细胞钠通道电流具有抑制作用,并采用二维核磁共振技术解析了JZTX-XI的三维溶液结构,根据该毒素的结构信息推测JZTX-XI的N端第3位的精氨酸残基可能是负责 JZTX-XI与 Kv2.1通道及Nav1.5通道相互结合的关键活性残基[7]。我们正在研究通过蛋白质工程技术力争消除 JZTX-XI对Nav1.5通道的抑制活性,从而正在把JZTX-XI改造成为一个高效特异性的 Kv2.1通道亚型抑制剂,实现将该毒素开发成治疗2型糖尿病药物的潜在医用价值。为了深入研究其结构与功能关系,本文用固相多肽合成的方法合成了天然JZTX-XI及其突变体R3A-JZTX-XI,并探索合成产物的氧化复性条件,结合电生理膜片钳技术研究合成毒素对 HEK293T细胞上瞬时转染表达的钾通道亚型 Kv2.1和钠通道亚型Nav1.5电流的抑制作用,为下一步通过蛋白质工程将JZTX-XI改造成一个高效特异性的Kv2.1通道亚型或Nav1.5通道亚型的抑制剂提供实验依据。
1 材料与方法
1.1 材料
9-芴甲氧羰基 (Fmoc) 氨基酸、N-甲基吗啡啉(NMM)、哌啶 (Piperidine) 购自吉尔生化 (上海) 有限公司;Rink Resin树脂购自天津南开和成公司;还原型谷胱甘肽 (GSH)、氧化型谷胱甘肽 (GSSG)、三羟甲基氨基甲烷盐酸盐 (Tris-HCL)、N-2-羟乙基哌嗪-N’-2’-乙磺酸 (HEPES)、乙二醇双 (2-氨基乙基) 四乙酸(EGTA)、N-甲基-D-葡萄糖胺 (NMG)、二巯基乙烷、苯甲硫醚、三氟乙酸 (TFA)、α-氰基-4-羟基-肉桂酸(CCA) 等购自Sigma公司;二甲基甲酰氨 (DMF) 购自美国Tedia公司;3-四甲基脲六氟磷酸酯 (HCTU) 购自上海正极生物科技有限公司;乙腈、甲醇均购自湖南化工研究院。HEK293T细胞购自中国科学院上海生命科学研究生院生物化学与细胞生物学研究所,SCN5A-pCDNA3.1[8]和hK2.1[9]通道质粒分别由美国哥伦比亚大学Robert S. Kass教授和英国伦敦大学药学院的Martin Stocker教授提供。
1.2 JZTX-XI及R3A-JZTX-XI的化学合成与分离纯化
采用Fmoc-氨基酸和HCTU偶联的固相多肽化学合成方法[10],在PS3 多肽合成仪上进行多肽的固相化学合成。多肽粗品利用半制备型的反相 HPLC进行分离纯化 (反相柱:10 mm×250 mm Phenomenex C18 column;洗脱液A:含0.1% TFA的水溶液;洗脱液B:含0.1% TFA 的乙腈,洗脱梯度为20 min内B液的浓度变化为25%~35%;流速是3.0 mL/min),利用MALDI-TOF/TOF质谱分析各峰的质荷比,以确定目的峰的位置,然后收集目的峰真空冷冻干燥。再选取目的峰再用分析型的反相HPLC (Waters Alliance) 进行分离纯化 (反相柱:Waters 4.6 mm×250 mm C18 column;洗脱梯度同上,流速为1.0 mL/min),通过上述2次分离纯化确保合成产品纯度达到95%以上,然后冻干备用。
1.3 JZTX-XI及R3A-JZTX-XI的氧化还原复性
参照文献[10]的方法,每次各取0.1 mg纯化的合成的JZTX-XI粗样在1 mL 0.1 mol/L Tris-HCl、一定比例浓度的 GSH/GSSG、不同pH值的缓冲液中进行氧化复性。对于每个复性条件都在不同的时间间隔取出100 µL反应液,加10 µL 50% TFA水溶液终止反应后,用分析型反相HPLC进行氧化复性的实时监测 (反相柱:Waters 4.6 mm×250 mm C18 column,洗脱液A:含0.1% TFA 的水溶液;洗脱液B:含0.1% TFA的乙腈,洗脱梯度为20 min内B液的浓度变化为25%~35%,流速为1.0 mL/min),对收集洗脱峰进行质谱分析来确定合适的复性时间和pH值。根据实验结果,再采用最优条件对天然毒素和突变体R3A-JZTX-XI进行氧化复性。
1.4 氧化复性产物与天然JZTX-XI共洗脱实验
将氧化复性JZTX-XI与天然JZTX-XI等量混合后,在反相HPLC (Waters Alliance) 上进行共洗脱实验 (色谱条件同1.3)。
1.5 人胚肾细胞 (Human embryonic kidney 293T,HEK293T) 的培养与转染
HEK293T细胞的培养按照标准的组织培养条件 (37 ℃、5% CO2、15%的相对湿度),在培养箱中用含 10%胎牛血清的 DMEM培养液培养。Nav1.5和K2.1通道质粒与HEK293T细胞的瞬时转染是采用美国Invitrogen公司的脂质体2000按照用户使用手册进行。先将Nav1.5或K2.1通道质粒与脂质体2000和绿色荧光蛋白GFP报告质粒复合物滴加进入盛有HEK293T细胞的培养皿中,轻轻混匀后孵育4~6 h,再换新鲜的培养液培养。瞬时转染后24~72 h内均可挑选显示绿色荧光的细胞进行膜片钳实验[11]。
1.6 瞬时表达于 HEK293T细胞的 hKv2.1和hNav1.5通道电流的记录
室温 (25±1) ℃下采用全细胞膜片钳技术进行实验。电流记录利用 EPC9放大器 (HEKA公司,German) 在电脑上进行,记录和分析系统采用Pulse+Pulsefit 8.0软件。玻璃管为 100 µL (VWR micropipettes,VWR Company) 的硼硅酸盐玻璃毛细管。玻璃电极经两步拉制而成,充灌电极液后电极电阻一般为 2~3 MΩ。测定钠电流的细胞外液为(mmol/L):NaCl 140、KCl 3、MgCl21、CaCl21和HEPES 10,调pH值为7.3;细胞内液为 (mmol/L):CsF 140、EGTA 1、NaCl 10和HEPES 10,pH 7.3。测定钾通道电流的细胞外液为 (mmol/L):Choline chloride 130、D-glucose 12、MgCl22、CaCl22和HEPES 10,pH 7.2。细胞内液为 (mmol/L):KF 120、NMG 20、HEPES 10、EGTA 10、MgATP 2和Li2GTP 0.5,pH 7.2。细胞外液和细胞内液均用0.22 µm滤膜过滤。
2 结果与分析
2.1 JZTX-XI与R3A-JZTX-XI的固相化学合成
合成的 JZTX-XI粗品经真空冷冻干燥后为白色粉末,采用RP-HPLC分离纯化2次,收集洗脱峰经MALDI-TOF/TOF质谱仪鉴定,其中保留时间为15.1 min的单一峰相对分子量 (MH+) 为3 734.041 (图1A),与JZTX-XI (线性) 理论分子量3 733.358相符;保留时间为 17.0 min的单一峰相对分子量(MH+) 为3 649.012 (图1B),与R3A-JZTX-XI (线性) 理论分子量3 648.250相符,提示固相多肽合成是成功的。
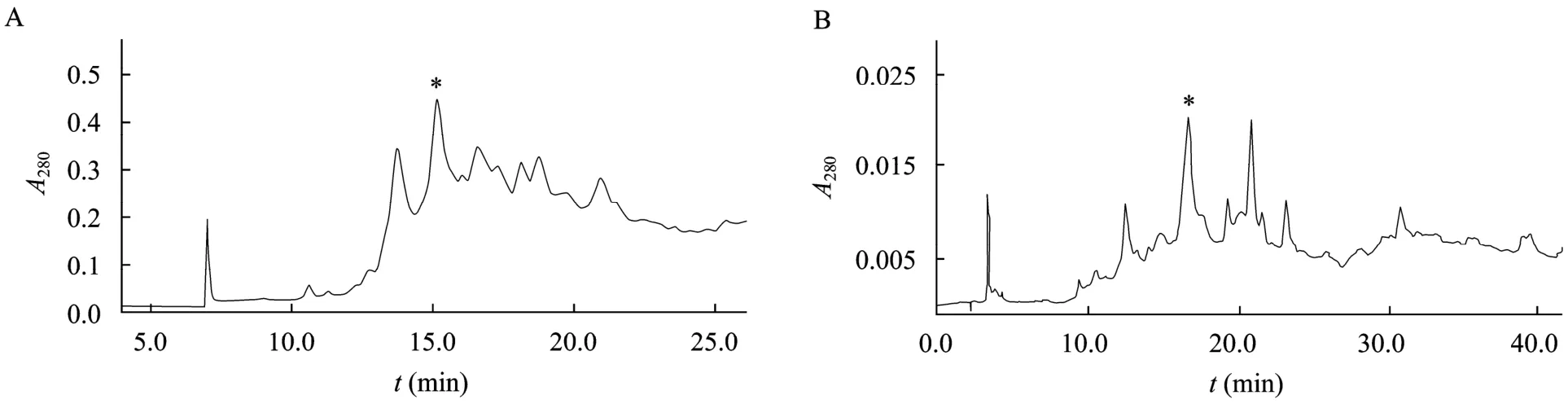
图1 JZTX-XI和R3A-JZTX-XI的合成RP-HPLC分析图Fig. 1 Identification of synthetic JZTX-XI and R3A-JZTX-XI by RP-HPLC. (A) JZTX-XI. (B) R3A-JZTX-XI. The synthetic JZTX-XI and R3A-JZTX-XI were applied to a phenonmenex C18 column (10 mm×250 mm) pre-equilibrated with 0.1% TFA. Elution was performed with a linear gradient of 25%−35% acetonitrile over 20 min at a flow rate 3.0 mL/min at 40 °C. Asterisks indicated the fractions of interest.
2.2 JZTX-XI及R3A-JZTX-XI的氧化还原复性
化学合成的多肽由于是线性分子,没有生物学活性,所以检测活性前需要进行氧化复性,使其形成正确的空间结构和二硫键配对,但氧化还原复性的过程常受多种因素的影响。因此在大量合成多肽进行复性前,需要探索其最佳氧化复性条件。根据实验室以往的复性研究结果,确定样品浓度为0.05 g/L较好,然后比较采用不同比例浓度的谷胱甘肽组合GSH/GSSG (5 mmol/L∶0.5 mmol/L,2 mmol/L∶0.2 mmol/L,1.0 mmol/L∶0.1 mmol/L)和不同pH值 (7.0、7.5、8.0) 缓冲溶液条件下复性产物峰面积的大小,从而确认JZTX-XI的最佳氧化复性条件为:含 1.0 mmol/L GSH、0.1 mmol/L GSSG、pH为8.0、浓度为0.1 mol/L的Tris-HCl缓冲液,样品质量浓度为0.05 g/L,复性温度为4 ℃。图 2A展示了线性 JZTX-XI氧化复性动态变化情况。随着复性时间的延长,复性目的峰形逐渐变大,峰面积逐渐增加。当复性进行至12 h以后,峰形在48 h之内都能够保持相对稳定,单一主峰明显,提示该毒素分子的复性在12 h内已经基本完成。复性产物经MALDI-TOF/TOF质谱仪鉴定,相对分子质量为3 726.115 (图3A),比线性JZTX-XI的分子质量减少了6,提示复性后的JZTX-XI形成了3对二硫键。将复性产物与天然JZTX-XI等量混合后进行共洗脱实验只得到单一峰 (图2B),推断复性产物的二硫键配对方式正确,合成毒素与天然毒素在结构上具有一致性。突变体R3A-JZTX-XI的合成、分离和复性方法均同上。复性产物经MALDI-TOF/TOF质谱仪鉴定,其相对分子质量为3 642.617 (图3B),形成了3对二硫键,与预期一致。

图2 JZTX-XI的反相色谱图Fig. 2 RP-HPLC chromatograms of sJZTX-XI. (A) HPLC chromatograms in refolding process of synthetic JZTX-XI. (B) HPLC chromatogram of co-injected native and refolded JZTX-XI in refolding process.
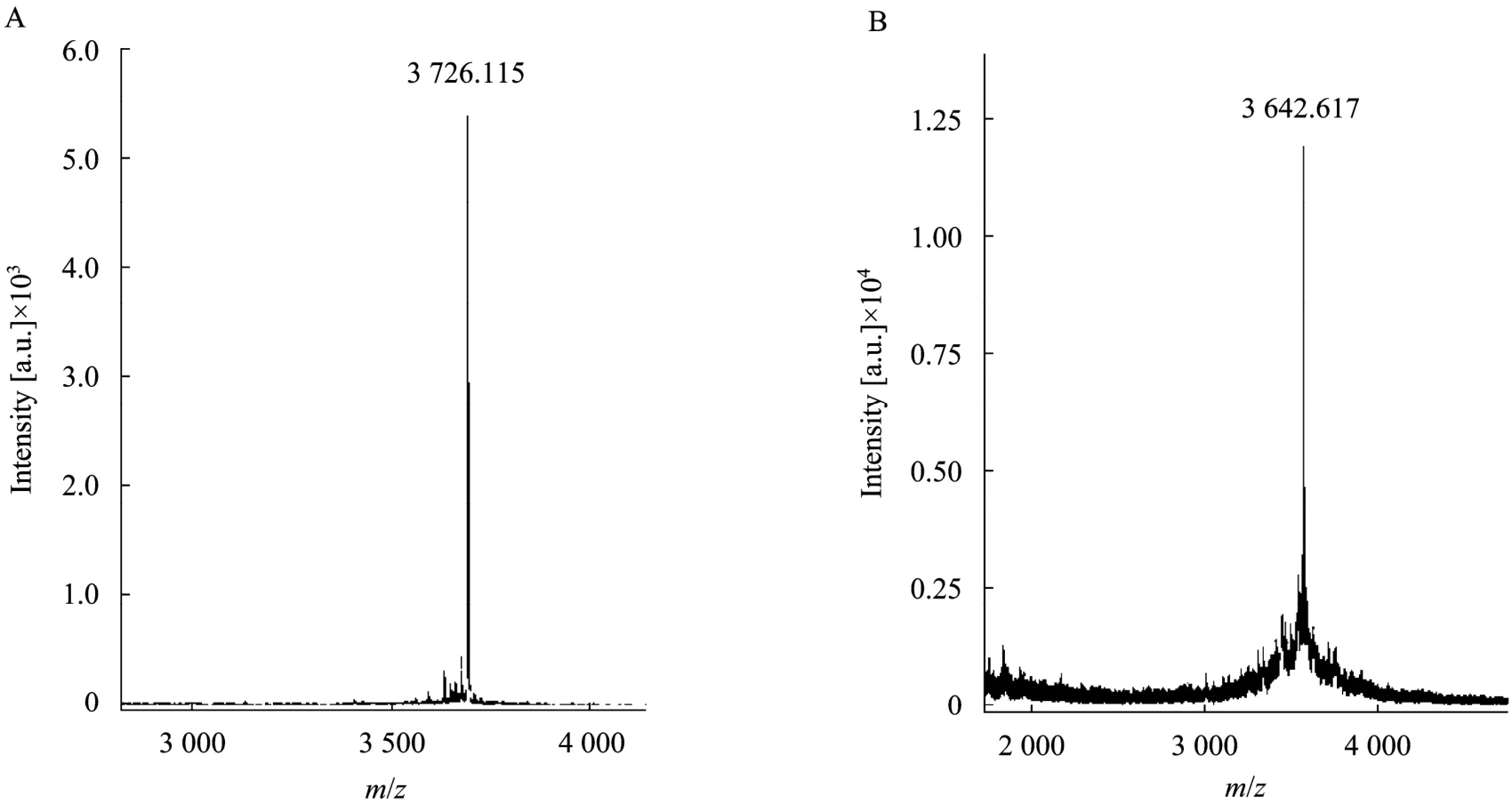
图3 sJZTX-XI和R3A-JZTX-XI复性产物的质谱图谱Fig. 3 Mass spectra of refolded sJZTX-XI and R3A-JZTX-XI. (A) sJZTX-XI. (B) R3A-JZTX-XI.
2.3 JZTX-XI和 R3A-JZTX-XI对瞬时表达于HEK293T细胞的hNav1.5钠通道活性的影响
前期的研究显示JZTX-XI可以抑制大鼠心肌细胞上的钠通道电流,其Kd为0.74 µmol/L[7]。然而,JZTX-XI对电压门控钠通道亚型的作用却还不清楚。本文运用全细胞膜片钳技术研究了JZTX-XI对瞬时表达于HEK293T细胞的钠通道亚型hNav1.5的影响。电流去极化诱导方式:细胞膜电位钳制−80 mV,以50 ms的时程给予一测试电压−10 mV,每隔 5 s重复 1次。膜片钳电生理实验表明,1.0 µmol/L的天然 JZTX-XI (nJZTX-XI) 和合成JZTX-XI (sJZTX-XI) 分别能抑制 (70.4±3.1)% (图4A,n=5) 与 (67.5±4.2)% (图4B,n=5) 的hNav1.5通道电流,表明合成 JZTX-XI与天然 JZTX-XI对hNav1.5通道电流的抑制作用的大小非常接近,进一步证实合成JZTX-XI与天然JZTX-XI在结构与活性性上具有一致性。同时实验结果表明合成JZTX-XI对 hNav1.5通道的抑制作用具有明显的浓度依从性,其半数有效抑制浓度 (IC50) 为437.12 nmol/L。然而1.0 µmol/L的合成突变体R3A-JZTX-XI却只能抑制同样转染表达的钠通道 hNav1.5电流的(35.7±4.1)% (图 4C,n=4),其半数有效抑制浓度(IC50) 为1.96 µmol/L (图4D)。比较上述研究结果发现突变体 R3A-JZTX-XI对钠通道亚型 hNav1.5的抑制活性比天然nJZTX-XI降低了约4.5倍,表明JZTX-XI分子中第3位的精氨酸残基是与Nav1.5通道结合活性相关的氨基酸残基。

图4 JZTX-XI与突变体R3A-JZTX-XI对表达于HEK293T细胞hNav1.5通道电流的抑制作用Fig. 4 Effects of nJZTX-XI, sJZTX-XI and R3A-JZTX-XI on hNav1.5 channel currents expressed in HEK293T cells. Nav1.5 currents traces were evoked by a 50 ms depolarization to −10 mV from a holding potential of −80 mV. Every data point (±s) came from 3−5 separated experimental cells. A, B and C showed that 1.0 µmol/L nJZTX-XI, sJZTX-XI and R3A-JZTX-XI could inhibit hNav1.5 channel currents expressed in HEK293T cells, and they reduced Nav1.5 currents by (70.4±3.1)% (n=5), (67.5±4.2)% (n=5) and (35.7±4.1)% (n=4), respectively. D showed that the IC50 values of sJZTX-XI and R3A-JZTX-XI were 437.12 nmol/L and 1.96 µmol/L, respectively.
2.4 JZTX-XI和 R3A-JZTX-XI对瞬时表达于HEK293T细胞的hKv2.1通道活性的影响
进一步研究了天然 JZTX-XI及其突变体R3A-JZTX-XI对瞬时表达于HEK293T细胞上的电压门控钾通道亚型hKv2.1的抑制作用。电流去极化诱导方式:细胞膜电位钳制−80 mV,以300 ms的时程给予一测试电压+30 mV,每隔 5 s重复 1次。膜片钳实验表明,100 nmol/L天然 JZTX-XI (nJZTX-XI)、合成 JZTX-XI (sJZTX-XI) 和突变体R3A-JZTX-XI对hKv2.1钾通道电流的抑制程度分别为 (53.9±7.8)% (图 5A,n=5)、(51.2±5.4)% (图5B,n=5) 和 (5.7±3.1)% (图 5C,n=4)。如图 5D所示,sJZTX-XI和R3A-JZTX-XI对hKv2.1钾电流的抑制作用随浓度的增大而增强,具有明显的浓度依从性,其半数有效抑制浓度 (IC50) 分别为95.8 nmol/L和1.22 µmol/L。比较上述研究结果发现突变体R3A-JZTX-XI对hKv2.1钾通道的抑制活性比天然JZTX-XI降低了约12.4倍,说明第3位的精氨酸残基是负责JZTX-XI与Kv2.1通道结合的关键活性残基。

图5 JZTX-XI与突变体R3A-JZTX-XI对表达于HEK293T细胞hKv2.1通道电流的抑制作用Fig. 5 Effects of nJZTX-XI, sJZTX-XI and R3A-JZTX-XI on hKv2.1 channel currents expressed in HEK293T cells. hKv2.1 currents traces were evoked by a 300 ms depolarization to +30 mV from a holding potential of -80 mV. Every data point (±s) came from 3−5 separated experimental cells. A, B and C showed that 100 nmol/L nJZTX-XI, sJZTX-XI and R3A-JZTX-XI could inhibit hKv2.1 channels currents expressed in HEK293T cells, and they reduced hKv2.1 currents by (53.9±7.8)% (n=5), (51.2±5.4)% (n=5) and (5.7±3.1)% (n=4), respectively. D showed that the IC50 values of sJZTX-XI and R3A-JZTX-XI were 95.8 nmol/L and 1.22 µmol/L, respectively.
3 讨论
Kv2.1钾离子通道是一种延迟整流型钾通道,广泛分布于胰岛β细胞、大脑海马和皮层神经元细胞上,在调控胰岛素分泌和脑缺血介导的细胞损伤过程中发挥一定作用[12-13],但目前人们对于 Kv2.1通道在细胞生命活动过程中具体功能依然不是十分清楚,而蜘蛛毒素中存在的 Kv2.1通道抑制剂为该研究提供了合适的药理学工具,如著名的蜘蛛毒素Hanatoxin1就是一种常用的研究 Kv2.1通道的工具试剂,但是该毒素因为其复性产率太低很难通过合成的方法大量获得该毒素而限制了其应用[14]。另外一个Kv2.1钾离子通道抑制毒素是SGTx1,该毒素可以化学合成,通过丙氨酸扫描突变研究确定了其与 Kv2.1通道发生作用的关键活性残基[15]。目前Hanatoxin1、SGTx1和JZTX-XI的三维溶液结构都已经得到解析,单从氨基酸序列上看这 3个毒素第3位都是精氨酸残基,而且已有研究显示SGTx1第3位的精氨酸残基是一个关键氨基酸残基。本文成功合成了野生型 JZTX-XI和该毒素的突变体R3A-JZTX-XI,通过高效液相色谱与生物质谱分析显示合成产物能够较好的折叠复性并形成 3对二硫键。电生理实验结果显示突变体R3A-JZTX-XI对瞬时表达于HEK293T细胞的钾通道hKv2.1电流的抑制活性比野生型毒素降低了约 12.4倍,说明 Arg3是负责 JZTX-XI与hKv2.1通道结合的关键活性残基,进一步通过三维结构分析发现 Hanatoxin1、SGTx1和JZTX-XI毒素第3位的精氨酸残在空间结构上具有保守性,提示这3个毒素分子在hKv2.1通道上可能具有相同的结合位点。
Nav1.5通道是一种河豚毒素不敏感型钠离子通道,主要分布于心肌细胞上,近年来也发现在神经母细胞瘤细胞和脑组织中高度表达。已有的研究结果表明一些心血管、肿瘤和癫痫等疾病的发生也与Nav1.5通道有关[5]。敬钊缨毛蛛毒素-III (JZTX-III)是已经报道过的心肌细胞钠通道抑制剂,其半数有效抑制浓度为380 nmol/L[16],但是该毒素第3位是谷氨酸残基,JZTX-XI与JZTX-III在 Nav1.5通道上是否有相同的作用位点还有待进一步研究证明。
总之,敬钊毒素-XI是一种新型Kv2.1和Nav1.5交叉通道活性抑制剂,开展其结构与功能关系研究可以为深入阐明该毒素与通道相互作用的分子机制提供实验依据,并为将来通过蛋白质工程手段移除该毒素Nav1.5通道的相关活性,使其改造成为研究胰脏钾通道 Kv2.1的分子探针,设计开发以 Kv2.1通道为靶点相关的药物研究提供新的思路。
[1] MacDonald PE, Sewing S, Wang J, et al. Inhibition of Kv2.1 voltage-dependent K+channels in pancreatic beta-cells enhances glucose-dependent insulin secretion. J Biol Chem, 2002, 277(47): 44938−44945.
[2] Herrington J, Sanchez M, Wunderler D, et al. Biophysical and pharmacological properties of the voltage-gated potassium current of human pancreatic β-cells. J Physiol, 2005, 567(1): 159−175.
[3] MacDonald PE, Ha XF, Wang J, et al. Members of the Kv1 and Kv2 voltage-dependent K+channel families regulate insulin secretion. Mol Endocrinol, 2001, 15(8): 1423−1435.
[4] Herrington J, Zhou YP, Bugianesi RM, et al. Blockers of the delayed-rectifier potassium current in pancreatic β-cells enhance glucose-dependent insulin secretion. Diabetes, 2006, 55(6): 1034−1042.
[5] Wang J, Ou SW, Wang YJ, et al. Progress in voltage-gated sodium channel α-subunit Nav1.5. Chin J Biochem Mol Biol, 2008, 24(4): 287−294.王军, 欧绍武, 王运杰, 等. 电压-门控Na+通道α亚单位Nav1.5. 中国生物化学与分子生物学报, 2008, 24(4): 287−294.
[6] Zhu MS, Song DX, Li TH. A new species of the family theraphosidae, with taxonomic study on the species selenocosmia hainana (arachnida: araneae). J Baoding Teach Coll, 2001, 14(2): 1−6.朱明生, 宋大祥, 李廷辉. 我国狒蛛科一新种及海南捕鸟蛛的分类研究 (蛛形纲: 蜘蛛目). 保定师专学报, 2001, 14(2): 1−6.
[7] Liao Z, Yuan CH, Deng MC, et al. Solution structure and functional characterization of Jingzhaotoxin-XI: a novel gating modifier of both potassium and sodium channels. Biochemistry, 2006, 45(51): 15591−15600.
[8] Splawski I, Timothy KW, Tateyama M, et al. Variant of SCN5A sodium channel implicated in risk of cardiac arrhythmia. Science, 2002, 297(5585):1333−1336.
[9] Kerschensteiner D, Monje F, Stocker M. Structural determinants of the regulation of the voltage-gated potassium channel Kv2.1 by the modulatory α-subunit Kv9.3. J Biol Chem, 2003, 278(20): 18154−18161.
[10] Zeng XZ, Deng MC, Pi JH, et al. Effects of Arg20 mutation on sodium channels activity of JZTX-V. Chin J Biotech, 2008, 24(7): 1228−1232.曾雄智, 邓梅春, 皮建辉, 等. Arg20突变对敬钊缨毛蛛毒素-V钠通道活性的影响. 生物工程学报, 2008, 24(7): 1228−1232.
[11] [11] Deng MC, Kuang F, Sun ZH, et al. Jingzhaotoxin-IX, a novel gating modifier of both sodium and potassium channels from Chinese tarantula Chilobrachys jingzhao. Neuropharmacology, 2009, 57(2): 77−87.
[12] Yuan H, Wang WP, Ma SP, et al. Potential pharmacologic role of Kv2.1 potassium channel in ischemic neuron injury. Chin Pharm J, 2009, 44(6): 436−439.袁辉, 王伟平, 马士平, 等. Kv2.1钾通道在神经元缺氧损伤中的潜在药理学作用. 中国药学杂志, 2009, 44(6): 436−439.
[13] Herrington J. Gating modifier peptides as probes of pancreatic β-cell physiology. Toxicon, 2007, 49(2): 231−238.
[14] Takahashi H, Kim JI, Min HJ, et al. Solution structure of hanatoxin1, a gating modifier of voltage-dependent K+channels: common surface features of gating modifier toxins. J Mol Biol, 2000, 297(3): 771−780.
[15] Lee CW, Kim S, Roh SH, et al. Solution structure and functional characterization of SGTx1, a modifier of Kv2.1 channel gating. Biochemistry, 2004, 43(3): 890−897.
[16] Xiao YC, Tang JZ, Yang YJ, et al. Jingzhaotoxin-III, a novel spider toxin inhibiting activation of voltage-gated sodium channel in rat cardiac mvocvtes. J Biol Chem, 2004, 279(25): 26220−26226.
