丝素蛋白在电纺丝法构建组织工程支架中的应用进展
2011-02-10陈玲竺亚斌李媛媛刘玉新俞珺瑶
陈玲,竺亚斌,李媛媛,刘玉新,俞珺瑶
宁波大学医学院,宁波 315211
丝素蛋白在电纺丝法构建组织工程支架中的应用进展
陈玲,竺亚斌,李媛媛,刘玉新,俞珺瑶
宁波大学医学院,宁波 315211
丝素蛋白是天然高分子纤维蛋白,具有良好的物理和机械力学性能及生物相容性,因而在组织工程领域有着广阔的应用前景。文中对丝素蛋白的化学组成、分子结构特点、提取方法以及利用静电纺丝技术在组织工程化支架构建中的应用作了概述。总结了丝素蛋白在用于组织工程材料上的性能和优势以及在人工血管、皮肤、骨组织等工程化支架方面的应用情况,探讨了丝素蛋白支架对细胞在其上生长、增殖和功能的影响,同时对丝素蛋白在组织工程化食道支架及其他再生医学上的应用前景进行了展望。
丝素蛋白,电纺丝,组织工程,支架构建
1 丝素蛋白的性质及制备
丝素蛋白,由蚕丝蛋白脱胶而得到,约占蚕丝总重量的75%。分子结构上,丝素蛋白由轻、重两条链构成,分子量分别为25 kDa和325 kDa,两条链紧紧缠绕,结构致密,其空间结构主要包括 3种构象:无规卷曲、α-螺旋和β-折叠。蛋白分子链按α-螺旋和β-平行折叠构象交替堆积形成Ⅰ型结构,按 β-反平行折叠堆积形成Ⅱ型结构,这些分子链构象与晶型结构决定了丝素蛋白具有良好的力学性能[5],使其在静电高压电场下容易被拉成纤维,而被用于电纺丝研究,并且它的分子量大、黏度高、分子构象稳定。据报道[6],纯丝素蛋白的抗拉强度为610~690 MPa,强度系数为15~17 GPa,断裂伸长率为4%~16%,具有高度重复的丙氨酸-甘氨酸-丝氨酸序列,是一种无生理活性的天然结构性蛋白,具有其他高分子材料所不可比拟的优点:无毒、无刺激、无污染、独特的机械性能及优良的透气性、透湿性和生物相容性,支持组织细胞的生长与增殖。而且丝素蛋白具有与其他生物大分子一样的生物可降解性,这使其成为了组织工程器官和组织构建中的新型材料[7-9]。目前正在研究开发的如人工皮肤、血管、免拆除手术缝合线、丝素膜、生物反应器等产品已取得了突破性进展,有些已进入临床应用研究。
纯丝素蛋白外边包裹着胶状的丝胶蛋白,要获取纯丝素蛋白首先要脱胶,传统上的脱胶方法是把蚕茧或蚕丝以 1∶100 (W/W) 的比例放入 0.5% Na2CO3溶液里煮沸1 h,然后用去离子水反复清洗,直至胶状物脱尽,即得丝素蛋白。
由于丝素蛋白分子的结构存在很多结晶区,其分子构象很稳定,较难溶解成溶液状态。目前丝素蛋白的溶解方法主要有以下几种:
1) Ajisawa’s法[10]:把丝素蛋白以1∶15 (W/V)的比例放入 Ajisawa,s (氯化钙/甲醇/水,111 g/92 g/144 g) 体系中,置于75 ℃水浴中,直至丝素蛋白完全溶解。
2) Ca(NO3)2·4H2O 溶解法:将脱胶蚕丝放入Ca(NO3)2·4H2O熔融体系中,加热溶解。不同的溶解条件对最终所得的可溶性丝素蛋白的构象和蛋白的裂解程度有较大影响。
3) LiSCN溶解法:把丝素蛋白以1∶30~1∶100 (W/V) 的比例加入9 mol/L的LiSCN溶液中,置于室温直至溶解。
溶解后的丝素蛋白于去离子水中透析至盐离子完全移除,在室温、鼓风烘箱、冷冻抽干机中分别制得室干膜、烘干膜及海绵状冷冻膜。
我国是蚕丝生产大国,蚕丝的产量占全世界总产量的65%,如果能加以良好开发并实际应用,相信将会产生很高的社会效益和经济效益。
2 丝素蛋白的电纺丝
自从Formhals等[11]在1934年利用电纺技术实现纳米纤维无纺布的构建之后,静电纺丝技术就为大家所熟知。这一技术的核心是使带电流体在静电场中流动与变形,最终得到纤维状物质。当给注射器针尖和收集板之间加上静电高压时,电场力克服针尖液滴的表面张力,高速射流被拉伸,然后形成泰勒锥,静电力使射流分岔,变成极细的丝状纤维。最后溶剂挥发,收集板收集到无序的无纺布式纳米级纤维。
Zhu等[12]制备了再生丝素蛋白水溶液,使用静电纺方法,在注射器针尖和收集板之间距离为20 cm,电压40 kV,溶液浓度为30%的条件下,得到直径在1 700 nm左右均匀的丝。使用水作为溶剂安全、可控,对培养细胞无毒副作用,移植入人体内无排斥反应。
Sukigara等[13-14]把丝素蛋白溶于甲酸制备电纺液,通过调节电纺参数 (如电压、流速、接收距离,射流角度等) 和丝素蛋白溶液的浓度,得到了直径在12~1 500 nm范围内的纤维。如当溶液浓度为12%~15%,距离为7 cm和10 cm,电压为3 kV/cm和4 kV/cm时,得到了100 nm左右的均匀的纤维;经过效应面优化法检测,当溶液浓度为8%~10%,距离为5 cm和7 cm,电压为4 kV/cm和5 kV/cm时,得到了直径在40 nm左右的电纺纤维,其抗断强度为515 MPa,断裂应变为3.2%。
Jeong等[16]把丝素蛋白溶于六氟异丙醇(HFIP)制备电纺液,当溶液浓度为7%,接收距离为8 cm,电压为16 kV时,纺织出最优化的无规则电纺布,但是经过研究分析,单纯由再生丝素蛋白制得的无纺布,其机械强度均比原始丝的机械强度有所降低。如电纺丝比自然蚕丝纤维的断裂应变小,主要原因是在处理过程中,改变了自然丝的部分原始结构,影响了它的强度。因此也有人将丝素蛋白与其他高聚物共纺,以提高组织工程支架的机械强度。
McClure等[17]把丝素蛋白、聚己内酯、聚二恶烷酮 (PDO) 溶于HFIP,然后按50∶50 (V/V) 的比例把丝素蛋白分别与聚己内酯和聚二恶烷酮共混,使用滚轴为接收器,当滚轴的转速分别为500 r/min和8 000 r/min时,丝素蛋白-聚己内酯共纺纤维的直径分别在 (1.3±0.3) µm和 (0.9±0.4) µm范围内;丝素蛋白-聚二恶烷酮共纺纤维的直径分别在(1.0±0.3) µm和 (1.0±0.2) µm范围内。当接收器的转速为500 r/min时,得到的纤维杂乱无序,而当接收器的转速为8 000 r/min时得到了有序排列的取向纤维。
Wang等[18]对传统电纺进行了创新,他们用丝素蛋白与明胶 (Gelatin) 共混电纺作为管状支架的内层,再在管状支架的外层电纺上一层聚乳酸,当电压为30 kV,接收距离为15 cm,流速为0.2 mL/h,接收器转速为1 000 r/min时,内层得到的纤维直径范围在 (139±42) nm 内,孔隙率为(82±2)%。经过力学性能测试,其抗断强度为(2.21±0.18) MPa,延展率为 (60.58±1.23)%,爆破强度为 (1 596±20) mmHg。
由上述可知,要想得到适合结构的支架可以通过调节电纺条件和电纺液参数来实现。丝素蛋白在不同条件下静电纺丝得到的纤维直径及其机械性能列于表1。
3 丝素蛋白电纺支架在组织工程上的应用
利用静电纺丝的方法重新构丝,模拟细胞外基质结构,使细胞能粘附和增殖。目前对丝素蛋白用于组织工程支架材料的研究已得到广泛的关注,在人工血管、皮肤、骨等诸多组织工程领域得到开发和应用 (表2)。
3.1 人工血管
人体血管的结构和功能极其复杂,电纺法制备的管状支架拥有极高的孔隙率,纤维之间紧密连接,具有较强的抗爆能力,与人体血管的结构相似,有利于血管支架的构建。
Soffer等[19]利用丝素蛋白和聚氧乙烯 (PEO)作电纺液,制备了内径为 0.15 mm,弹性模量为(2.45±0.47) MPa,抗张强度为 (2.42±0.48) MPa,平均爆破压为811 mmHg的血管支架,经过在含内皮生长因子-2的培养基中孵化一段时间后,人冠状动脉平滑肌细胞 (HCASMCs) 和人大动脉内皮细胞(HAECs) 在其上生长良好。
Zhang等[20-21]以丝素蛋白和PEO为电纺液,以滚轴为接收器,制备了内径为3 mm的管状血管支架,在其上培养人冠状动脉平滑肌细胞 (HCASMCs)和人大动脉内皮细胞 (HAECs),5 d后,HCASMCs已由星状结构迁移为锤状,10 d后,HCASMCs完全扩展,检测得到细胞Ⅰ型胶原的表达和转录水平最高,而HAECs在14 d后最高,这些实验证明了细胞在丝素蛋白支架上的生长、黏附、形态和增殖效果良好。

表1 电纺丝素蛋白纤维性能及其纺丝条件Table 1 Fibre properties of silk as a function of electrospinning parameters
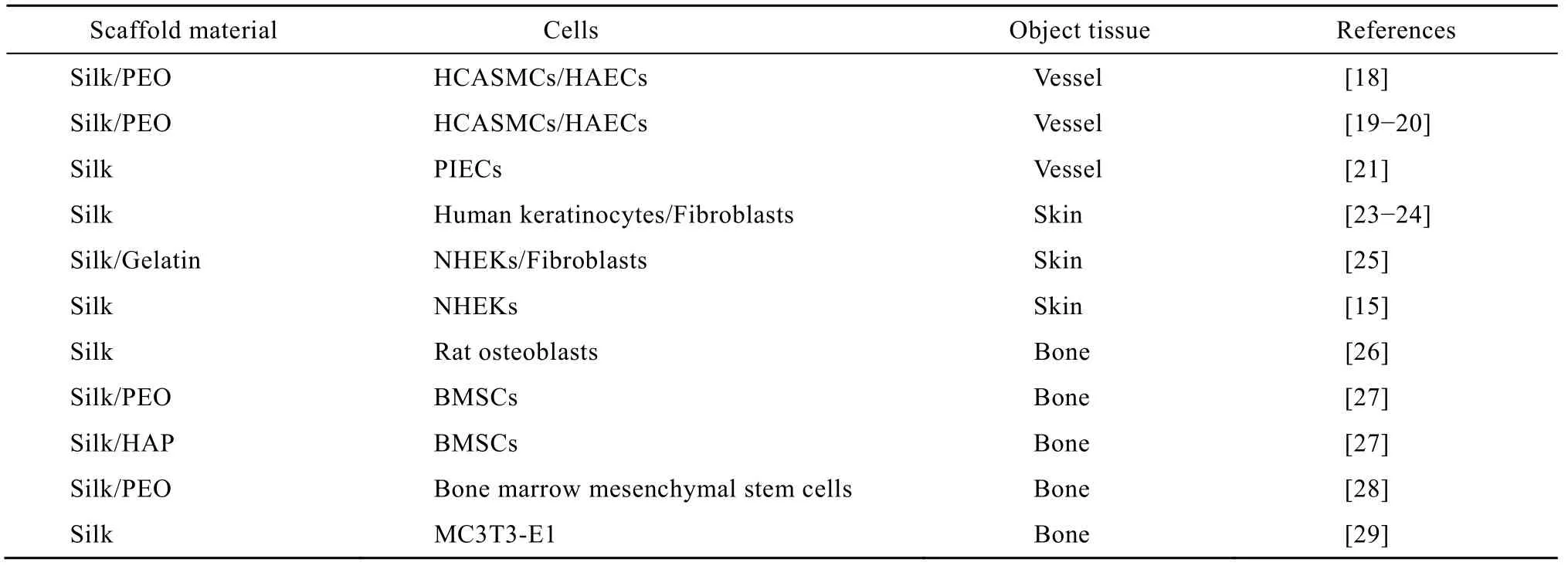
表2 电纺丝素蛋白纤维在组织工程化支架构建中的应用Table 2 Object tissue and seeded cells of scaffolds fabricated from electrospun silk or silk complex
Zhang等[22]将丝素蛋白水溶液进行电纺,然后在其上种植髋动脉内皮细胞 (PIECs),电镜图显示,经过24 h的培养,PIECs在支架上粘附与铺展良好,7 d以后,PIECs爬满了整个支架,形成了一个内皮组织层,这一实验证明了丝素蛋白与血管内皮细胞具有良好的相容性,是制备人工血管的优质基质材料之一。
3.2 人工皮肤
对皮肤组织工程支架的要求是能在尽量短的时间内生产出能永久覆盖的假体皮肤,并且将黑色素细胞和郎格罕氏细胞引入皮肤构建,形成“真皮肤”。表皮干细胞具有产生皮肤附属器的能力,在严重烧伤致皮肤缺损时,这些干细胞能保留像胚胎细胞的多能性,是潜在的多能性细胞[23]。利用具有良好生物相容性的丝素蛋白为材料,使用电纺技术制备纳米纤维多孔支架,种植多能性的“种子细胞”来生产更接近于实体皮肤的“人造皮肤”,具有良好的发展前景。
Min等[24-25]采用静电纺技术制成的丝素纳米纤维多孔支架,平均孔径为 80 nm,在此材料上培养人体角质细胞 (Human keratinocytes) 和成纤维细胞 (Fibroblasts) 效果良好。电镜照片显示,培养3 d后,角质细胞在丝素纳米纤维材料表面黏附生长,并沿孔扩散到内层,且细胞之间以及细胞与周围纤维之间作用良好;7 d后,细胞沿纤维方向生长并形成三维网络状细胞层结构。
Yeo等[26]把丝素蛋白和胶原 (Collagen) 按不同比例溶于 HFIP制备粘度为 (176±4)~(211±6) cP的电纺液,织出了纤维直径为320~360 nm的多孔支架,然后在上边种植人表皮角质细胞 (NHEKs) 和成纤维细胞 (Fibroblasts)。种植1 d后,NHEK在胶原、丝素蛋白支架以及不同比例 (除50/50外) 的胶原和丝素蛋白的混合支架上,细胞粘附和生长良好。
Jeong等[16]用氧气和甲烷对丝素蛋白支架表面进行改性并培养人表皮角质细胞,数小时后,细胞黏附率很高,并且增殖和迁移态势良好,可见这样制备的支架符合皮肤组织工程的要求。
3.3 骨组织
基于丝素蛋白的韧性及电纺技术制备的纤维具有高孔隙率、高比表面积等特点,使用电纺技术和丝素蛋白作骨组织工程支架的研究日趋得到发展。
Meechaisue等[27]把丝素蛋白溶于甲酸,制备骨支架,在其上培养大鼠成骨细胞 (Rat osteoblasts),3 d后,细胞扩増面积明显增大,细胞之间以及细胞与周围纤维之间作用良好,5 d后,细胞完全把支架铺满,达到最大增殖率。利用生长因子刺激细胞伪足,可以指导细胞取向生长。
单纯的丝素蛋白多孔支架作为骨组织工程支架,在机械强度上不能满足要求。Li等[28]利用丝素蛋白与PEO和羟基磷灰石 (HAP) 共混,制备了多种支架,经过比较,丝素蛋白与羟基磷灰石共纺的支架性能最优,纤维直径为 (590±60) nm,并在其上培养骨髓干细胞,经过骨成型蛋白-2(BMP-2) 的处理,细胞生长良好。
Meinel等[29]利用丝素蛋白和PEO水溶液共混电纺,得到了纤维直径为 (530±100) nm的支架,然后种植人骨髓间充质干细胞,72 h之后,细胞沿着轴向完全迁移,伪足明显可见。
Park等[30]利用丝素蛋白制作纳米级三维多孔支架,其直径为6 mm,壁厚为1.5 mm。在支架上种植MC3T3-E1成骨细胞,经过DNA计数和四甲基偶氮唑盐比色法 (MTT),分析细胞的增殖和新陈代谢能力,细胞生长良好,把支架移植入骨损伤的小鼠体内,7 d后,小鼠的骨完全恢复。这说明丝素蛋白和电纺技术在骨组织工程研究和应用上是有潜力的。
我们实验室正致力于组织工程化食道的构建,前期工作中对支持食道上皮细胞的基膜结构、力学性能和蛋白质组成进行了定性和定量分析,对可降解聚合物如PLA、PCL等多孔支架与食道上皮细胞、成纤维细胞和平滑肌细胞等的相互作用进行了研究。在这些实验的基础上,我们以丝素蛋白和可降解合成聚合物为基材,运用自行研制的静电纺丝系统,构建在宏观外形和微观结构上模拟食道天然结构的复合支架[31-34]。如利用丝素蛋白和 PLA、PCL等混合共纺制备了系列电纺丝纤维,其纤维直径在30~500 nm范围内,运用Instron力学分析系统,对其机械力学性能进行了测试分析。细胞培养实验结果,证明上述电纺丝纤维与食道原代上皮细胞和平滑肌细胞具有良好的细胞相容性 (待发表)。
以上实验均证明了丝素蛋白在以静电纺丝技术制备组织工程支架方面具有良好的发展和应用前景。但是目前的研究仅限于实验室和动物体内,还未涉及人体试验和临床应用。另一方面,在提取丝素蛋白时,不同的提取处理方法可能导致丝素蛋白构象的改变,从而影响其物理和/或化学性能,进一步影响所构建支架的机械力学性能、降解性或生物特性等,而这些方面的研究目前还未见详细报道。
4 展望
丝素蛋白具有良好的生物相容性和可调控的生物降解性,在组织工程领域如皮肤、血管、食道等组织和器官的构建具有广阔的发展前景。以后的研究一方面应对丝素蛋白的理化性质及化学处理对其性质的影响规律等内容进行系统研究,以补充有关丝素蛋白结构和性质的基础知识;另一方面,全面了解丝素蛋白与组织工程领域中种子细胞如动物组织来源的原代细胞或干细胞的作用及生物学功能,并进一步深入研究细胞-材料复合支架的力学性能、降解性及动物体内的功能性等,这些知识将为以后构建组织工程化食道并用于动物体内实验提供很好的理论指导和实验依据,使体外构建的支架最终用于临床上病变食管的修复成为可能。
[1] Zhang RL. Topography and fracture procedure of raw silk during stretching. J Text Res, 1985, 6: 542−547.张瑞林. 生丝在拉伸过程中的表面形貌及断裂过程. 纺织学报, 1985, 6(9): 542−547.
[2] Shi QS, Yu JX, Gu KZ, et al, Electrospinning technique and its application. Chem World, 2005, 46(5): 313−316.师奇松, 于建香, 顾克壮, 等. 静电纺丝技术及其应用.化学世界, 2004, 46(5): 313−316.
[3] Hu P, Zhang L, Fang ZX, et al. Electrospinning and its application in biomedical material research. Text Sci Res, 2004(2): 26−32.胡平, 张璐, 方壮熙, 等. 电纺丝及其在生物医用材料中的应用. 纺织科学研究, 2004(2): 26−32.
[4] Liao SR, Luo YJ, Wei Y. Electrispinning. Chin Syn Fiber Ind, 2005, 28(2): 47−50.廖肃然, 罗运军, 魏媛. 电纺丝. 合成纤维工业, 2005, 28(2): 47−50.
[5] Hojo S, ed. Xu JL, trans. The Formation and Structure of Silk Fiber. Beijing: Agricultural Press, 1990.北条舒正编著. 徐俊良等译. 蚕丝的形成和结构. 北京:农业出版社, 1990.
[6] Perez-Rigueiro J, Viney C, Llorca J, et al. Mechanical properties of single-brin silkworm silk. J Appl Polym Sci, 2000, 75(10): 1270−1277.
[7] Shao ZZ, Vollrath F. Materials: Surprising strength of silkworm silk. Nature, 2002, 418(6899): 741.
[8] Altman GH, Diaz F, Jakuba C, et al. Silk-based biomaterials. Biomaterials, 2003, 24(3): 401−416.
[9] Li MZ, Ogiso M, Minoura N, et al. Enzymatic degradation behavior of porous silk fibroin sheets. Biomaterials, 2003, 24(2): 357−365.
[10] Ajisawa A. Dissolution of silk fibroin with calcium chloride/ethanol aqueous solution. Seric Sci Jpn, 1998, 67(2): 91−94.
[11] Formhals A. Process and apparatus for preparing artificial threads: US Patent. 19755042. 1934-06-06.
[12] Zhu JX, Shao HL, Hu XC. Electrospinning of biomimetic regenerated silk fibroin aqueous solutions-part 1: processing parameters and structure properties. J Funct Mater, 2008, 39(1): 115−118.朱晶心, 邵惠丽, 胡学超. 仿生制备的再生丝素蛋白水溶液的静电纺丝(Ⅰ)-工艺参数及结构特性. 功能材料, 2008, 39(1): 115−118.
[13] Sukigara S, Gandhi M, Ayutsede J, et al. Regeneration of Bombyxmori mori silk by electrospinning—part 1: processing parameters and geometric properties. Polymer, 2003, 44(19): 5721−5727.
[14] Sukigara S, Gandhi M, Ayutsede J, et al. Regeneration of Bombyxmori mori silk by electrospinning—part 2: process optimization and empirical modeling using response surface methodology. Polymer, 2004, 45(11): 3701−3708.
[15] Sukigara S, Gandhi M, Ayutsede J, et al. Regeneration of Bombyxmori mori silk by electrospinning—part3: characterization of electrospun nonwoven mat. Polymer, 2005, 46(5): 1625−1634.
[16] Jeong L, Yeo IS, Kim HN, et al. Plasma-treated silk fibroin nanofibers for skin regeneration. Int J Biol Macromol, 2009, 44(3): 222−228.
[17] McClure MJ, Sell SA, Ayres CE, et al. Electrospinningaligned and random polydioxanone−polycaprolactone−silk fibroin-blended scaffolds: geometry for a vascular matrix. Biomed Mater, 2009, 4(5): 055010.
[18] Wang SD, Zhang YZ, Wang HW, et al. Fabrication and properties of the electrospun polylactide/silk fibroingelatin composite tubular scaffold. Biomacromolecules, 2009, 10(8): 2240−2244.
[19] Soffer L, Wang XY, Zhang XH, et al. Silk-Based electrospun tubular scaffolds for tissue-engineered vascular grafts. J Biomater Sci Polym Ed, 2008, 19(5): 653−664.
[20] Zhang XH, Cassandra BB, David LK, et al. In vitro evaluation of electrospun silk fibroin scaffolds for vascular cell growth. Biomaterials, 2008, 29(14): 2217−2227.
[21] Zhang XH, Wang XL, Keshav V, et al. Dynamic culture conditions to generate silk-based tissue-engineered vascular grafts. Biomaterials, 2009, 30(19): 3213−3223. [22] Zhang KH, Mo XM, Huang C, et al. Electrospun scaffolds from silk fibroin and their cellular compatibility. J Biomed Mater Res A, 2010, 93(3): 976−983.
[23] Slack JMW. Stem cells in epithelial tissues. Science, 2000, 287(5457): 1431−1433.
[24] Min BM, Lee G, Nam YS, et al. Electrospinning of silk fibroin nanofibers and its effect on the adhesion and spreading of normal human keratinocytes and fibroblasts in vitro. Biomaterials, 2004, 25(7/8): 1289−1297.
[25] Min BM, Jeong L, Nam YS, et al. Formation of silk fibroin matrices with different texture and its cellular response to normal human keratinocytes. Int J Bio Macromole, 2004, 34(5): 223−230.
[26] Yeo IS, Oh JE, Jeong L, et al. Collagen-based biomimetic nanofibrous scaffolds: preparation and characterization of collagen/silk fibroin bicomponent nanofibrous structures. Biomacromolecules, 2008, 9(4): 1106−1116.
[27] Meechaisue C, Wutticharoenmongkol P, Waraput R, et al. Preparation of electrospun silk fibroin fiber mats as bone scaffolds: a preliminary study. Biomed Mater, 2007, 2(3): 181−188.
[28] Li CM, Vepari C, Jin HJ, et al. Electrospun silk-BMP-2 scaffolds for bone tissue engineering. Biomaterials, 2006, 27(16): 3115−3124.
[29] Meinel AJ, Kubow KE, Klotzsch E, et al. Optimization strategies for electrospun silk fibroin tissue engineering scaffolds. Biomaterials, 2009, 30(17): 3058−3067.
[30] Park SY, Ki CS, Park YH, et al. Electrospun silk fibroin scaffolds with macropores for bone regeneration: an in vitro and in vivo study. Tissue Eng: Part A, 2010, 16(4): 1271−1279.
[31] Zhu YB, Chian KS, Chan-Park MB, et al. Proteinbonding on biodegradable poly (L-lactide-co-caprolactone) membrane for esophageal tissue engineering. Biomaterials, 2006, 27(1): 68−78.
[32] Zhu YB, Leong MF, Ong WF, et al. Esophageal epithelium regeneration on fibronectin grafted poly (L-lactide-co-caprolactone) (PLLC) nanofiber scaffold. Biomaterials, 2007, 28(5): 861−868.
[33] Zhu YB, Ong WF, Chan WY, et al. Construct of asymmetrical scaffold and primary cells for tissue engineered esophagus. Mater Sci Eng C, 2010, 30(3): 400−406.
[34] Zhu YB, Cao Y, Pan J, et al. Macro-alignment of electrospun fibers for vascular tissue engineering. J Biomed Mater Res B: Appl Biomater, 2010, 92(2): 508−516.
Progress and prospect of electrospun silk fibroin in construction of tissue-engineering scaffold
Ling Chen, Yabin Zhu, Yuanyuan Li, Yuxin Liu, and Junyao Yu
Medical School of Ningbo University, Ningbo 315211, China
Silk fibroin is a natural macromolecular fibroin. It has broad prospects in tissue engineering application due to its good physical and mechanical properties and good biocompatibility. This paper reviews its chemistry structure, property, the usage as matrix of tissue-engineering scaffold using electrospinning technology, and the influence on growth, proliferation and function of vascular endothelial cell, smooth muscle cell, keratinocyte and fibroblast. It also addresses the advantages and disadvantages of silk fibroin applied in tissue engineering study like artificial vascular, skin, bone stent etc. The potential applications on esophageal tissue engineering and regenerative medicine were discussed.
silk fibroin, electrospinning technology, tissue engineering, scaffold construction
随着再生医学的发展,组织工程这一学科也越来越受到人们的关注。组织工程研究中最重要的环节是三维支架的构建及支架与细胞的复合,高分子材料如聚乳酸 (PLA)、聚己内酯 (PCL)、聚乙烯醇(PVA) 等因具有良好的力学机械性能及生物可降解性而受到广泛关注,其来源广泛、成本低廉、易造型等特点都是天然高分子所无法比拟的。而天然生物材料,如胶原、壳聚糖、明胶、去细胞外基质等,因其普遍存在于生物体内,生物和细胞相容性好等特点,也一直受到研究者的关注。但由于它们来源有限、价格相对昂贵,限制了它们在构建支架上的应用。丝素蛋白因为其优良的机械性能和易制得等优点,在组织工程上的应用越来越受到人们的关注。丝素蛋白随着不同的存在形式其力学性能会有所不同,以纤维形式存在的丝素蛋白的力学性能更佳[1],而电纺丝技术是制备纳米纤维的最佳方法[2-4]。本文就丝素蛋白的结构特点及其在电纺丝法制备组织工程用支架方面的应用作了概述。
September 7, 2010; Accepted: January 5, 2011
Supported by: National Natural Science Foundation of China (No. 30870645), Qianjiang Talents Project of Zhejiang Province (No. 2007R10004).
Yabin Zhu. Tel: +86-574-87609592; E-mail: zhuyabin@nbu.edu.cn
国家自然科学基金 (No. 30870645),浙江省钱江人才项目 (No. 2007R10004) 资助。
