蔗糖转运蛋白基因VvSUC11和VvSUC12双价植物表达载体的构建及在甜菜中的遗传转化
2011-02-09殷东林祝建波王爱英向本春
殷东林,祝建波,王爱英,向本春
石河子大学农业生物技术重点实验室,石河子 832000
蔗糖是植物光合作用同化产物最主要的转运形式,其转运的方向和速率对于高等植物的生长发育至关重要[1]。蔗糖由源向库的运输是通过韧皮部进行的。光合同化物进出韧皮部筛管分子是通过两种不同模式转运的,即共质体途径和质外体途径[2]。其中蔗糖运输的质外体途径在许多农作物中占有重要的地位。在质外体途径中,蔗糖主动越膜装载入韧皮部进行运输,然后在库端越膜卸载进入库器官细胞。蔗糖的跨膜运输及其在植物中的分配需要依赖于膜上的蔗糖转运蛋白 (Sucrose/H+cotransporters或sucrose transporters,SUCs或SUTs),因此蔗糖转运蛋白在蔗糖转运过程中起着极为重要的作用[3-4]。
在高等植物中,自1992年Riesmeier等[5]从菠菜Spinacia oleracea L.中克隆得到第一个蔗糖转运蛋白以来,许多蔗糖转运蛋白相继从不同植物以及不同器官克隆得到[6]。Davies等[7]于1999年从葡萄V. vinifera果实中克隆得到了3个预测为葡萄蔗糖转运蛋白的基因 (VvSUC11、VvSUC12、VvSUC27),其中2个 (VvSUC11、VvSUC12) 在酵母中得到了功能验证[8]。VvSUC11和VvSUC12在葡萄果实中具有相似的表达模式,在果实成熟的过程中表达量增高,二者的主要功能被认为是负责蔗糖从质外体(Apoplast) 向薄壁细胞 (Parenchyma cell) 装载[8];而VvSUC27的表达与前两者有显著不同,在果实成熟过程中表达量降低[7]。VvSUC12和VvSUC27在葡萄胚性和非胚性愈伤组织中的表达也有差异[9]。最近VvSUC27的功能也在酵母中得到了验证[10]。
虽然这 3种蔗糖转运蛋白的功能在酵母中得到了验证,并且发现转基因酵母提高了积累蔗糖的能力、糖转运蛋白在酵母中的表达有助于蔗糖的跨膜运输及糖转运功能的促进与温度和 pH有很大的关系[8,10],但这3种蔗糖转运蛋白在植物中的功能验证方面却鲜有报道。
蔗糖通过韧皮部从源到库的运输被广泛报道[1,3]。蔗糖从源组织运输和装载到韧皮部中的过程已经研究很详细了,而蔗糖从韧皮部卸载到诸如根、种子和块茎等库组织的过程研究的不够深入。对蔗糖进入果实即一些植物主要库器官的机制了解还很少。
基于上述原因,本研究根据蔗糖转运蛋白在糖分积累中的作用,从调控源、库关系的角度出发,利用分子生物学手段,构建含有甘薯的甘薯贮藏蛋白基因根部特异性启动子的植物表达载体pCAMBIA2301-SP1-VvSUC11-SP2-VvSUC12,把蔗糖转运蛋白基因VvSUC11和VvSUC12转化到甜菜中验证其在植物中的功能和探索蔗糖在甜菜块根中可能的运输机制。
1 材料与方法
1.1 材料
1.1.1 质粒和菌种
原核表达载体pGM-T-SP1、pGM-T-VvSUC11、pGM-T-VvSUC12,以及植物表达载体 pBI121-SP2-GUS均由本实验室构建并保存,植物表达载体pCAMBIA2301,以及大肠杆菌 Escherichia coli DH5α、根癌农杆菌Agrobacterium tumefaciens菌株GV3101均为本实验室保存。
1.1.2 生化试剂
Taq DNA聚合酶、限制性内切酶XbaⅠ、SacⅠ、HindⅢ、EcoRⅠ、DraⅢ、T4 DNA连接酶、反转录试剂盒RNA PCR Kit (AMV) 均购于上海生物工程公司;琼脂糖凝胶回收试剂盒购自 Promega公司(美国);总RNA提取试剂盒、DNA marker购自北京Tiangen公司;其他试剂均为国产或进口分析纯试剂。
1.1.3 植物材料
甜菜B. vulgaris KWS-9103品种的种子由石河子甜菜研究所提供。
1.2 方法
1.2.1 双价植物表达载体 pCAMBIA2301-SP1-VvSUC11-SP2-VvSUC12的构建
本实验室已从葡萄中克隆出蔗糖转运蛋白基因VvSUC11和VvSUC12,从甘薯中克隆出甘薯贮藏蛋白 (Sporamin) 基因的根部特异性启动子[11],本文中命名为SP1和SP2。为了构建这个双价载体需要构建3个中间表达载体。
1) pCAMBIA2301-SP1载体的构建:启动子SP1左右两端的酶切位点分别为Hind Ⅲ和Dra Ⅲ(表 1)。用 HindⅢ/DraⅢ在 37 ℃下分别双酶切pCAMBIA2301和pGM-T-SP1载体,回收大片段和小片段,大、小片段在 T4 DNA连接酶作用下16 ℃连接过夜,转化大肠杆菌DH5α,挑单克隆,用SP1的引物 (表1) 进行菌液PCR鉴定。对阳性菌液提取质粒用HindⅢ/DraⅢ双酶切鉴定正确后命名为pCAMBIA2301-SP1。同时阳性克隆的菌种和质粒于−70 ℃保存备用。
2) pCAMBIA2301-SP2-GUS-SP1载体的构建:启动子SP2与启动子SP1的区别仅在于右端酶切位点不同,启动子SP2左右两端的酶切位点是HindⅢ和XbaⅠ (表1)。用HindⅢ/EcoRⅠ在37 ℃下双酶切载体 pCAMBIA2301-SP1多克隆位点,回收大片段,同时用 HindⅢ/EcoRⅠ双酶切载体 pBI121-SP2-GUS,回收小片段得到表达框SP2-GUS-NOS,将表达框插入到载体 pCAMBIA2301-SP1多克隆位点,转化大肠杆菌 DH5α,挑单克隆,用 GUS的引物 (表1) 进行菌液PCR鉴定。对阳性菌液提取质粒用 HindⅢ/EcoRⅠ双酶切鉴定正确后命名为pCAMBIA2301-SP2-GUS-SP1。同时阳性克隆的菌种和质粒于−70 ℃保存备用。
3) pCAMBIA2301-SP2-VvSUC12-SP1载体的构建:基因GUS和VvSUC12左右两端的酶切位点都是XbaⅠ和SacⅠ (表1)。用XbaⅠ/SacⅠ双酶切上面的载体pCAMBIA2301-SP2-GUS -SP1,回收大片段。Xba I/Sac I双酶切pGM-T-VvSUC12载体,回收小片段。小片段与大片段在T4 DNA连接酶的作用下连接过夜,转化DH5α,挑单克隆,用基因VvSUC12的引物 (表 1) 菌液 PCR鉴定。对阳性菌液提取质粒用 XbaⅠ/SacⅠ双酶切鉴定正确后命名为pCAMBIA2301-SP2-VvSUC12-SP1。阳性克隆的菌种和质粒于−70 ℃保存备用。
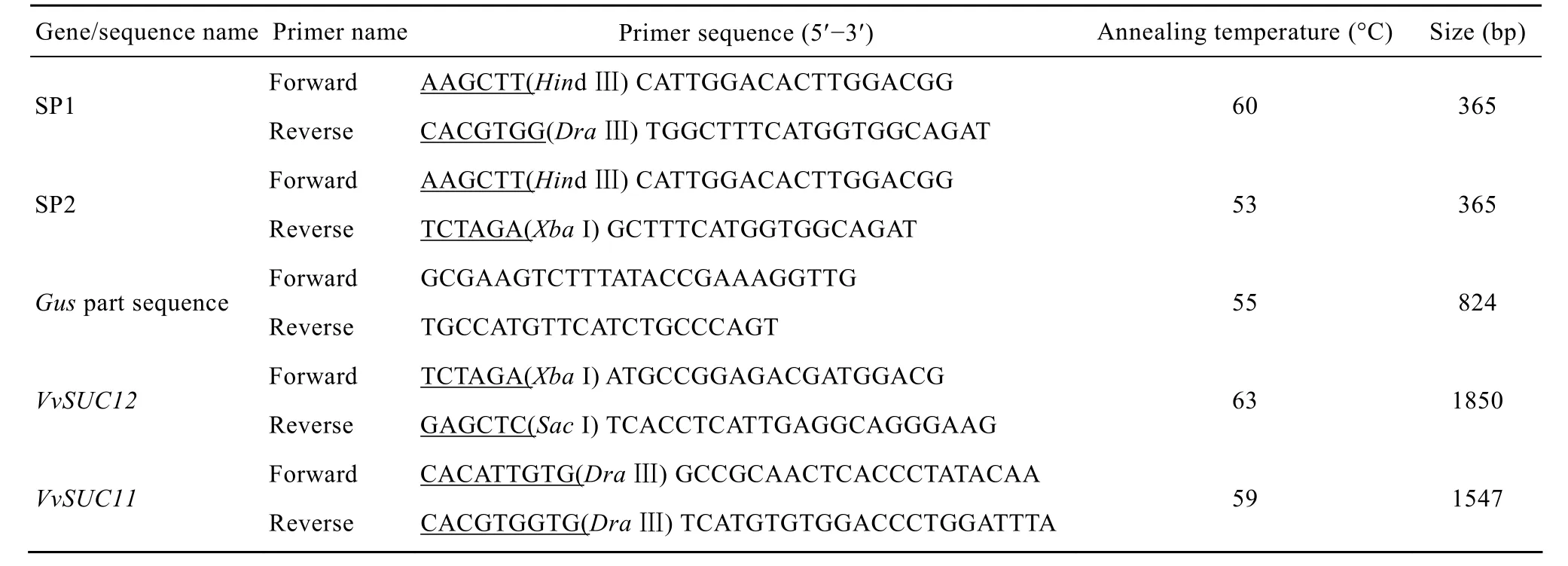
表1 研究中使用的引物序列Table 1 Sequences of oligonucleotide primers used in this study
4) pCAMBIA2301-SP1-VvSUC11-SP2-VvSUC12载体的构建:基因VvSUC11左右两端的酶切位点都是Dra Ⅲ,但两端的序列并不完全相同,右端酶切位点的序列与启动子 SP1右端酶切位点的序列相同,左端的与它们不同 (表 1),这样不会出现反向连接。用 Dra Ⅲ单酶切 pCAMBIA2301-SP2-VvSUC12-SP1载体,回收大片段,然后去磷酸化,同时用Dra Ⅲ单酶切pGM-T-VvSUC11载体,回收小片段与大片段在T4 DNA连接酶作用下16 ℃连接过夜,转化大肠杆菌 DH5α,挑单克隆,用基因VvSUC11引物 (表1) 菌液PCR鉴定。对阳性菌液提取质粒用 Dra Ⅲ单酶切鉴定正确后命名为pCAMBIA2301- SP1-VvSUC11-SP2-VvSUC12。同样,阳性克隆的菌种和质粒于−70 ℃保存备用。
1.2.2 双价植物表达载体用冻融法转化根癌农杆菌GV3101
农杆菌 GV3101感受态的制备及转化,参考本实验室的方法[11],并使用基因VvSUC11的引物 (表1) 进行菌液PCR检测。
1.2.3 农杆菌介导法转化甜菜
1) 外植体的制备:将甜菜KWS-9103品种的种子用自来水浸泡1 h,在超净工作台中转移到灭过菌的三角瓶中,先用10%的H2O2处理3 min,然后用0.1%的升汞处理8 min,再用无菌水漂洗5~6次。将消过毒的种子接种于含琼脂 0.7%、蔗糖 3%的1/2 MS (pH 5.8) 基本培养基上,在24 ℃±2 ℃下暗培养,使种子萌发。取发芽10 d左右的小苗,剪掉根部,转移至预培养培养基 (Pre-culture medium) (表2) 中进行预培养50~60 d后剪甜菜的叶柄1 cm左右做外植体。甜菜的叶柄在预培养培养基 (表 2)中再预培养2、4、6 d。
2) 农杆菌的培养:取保存的含有目的基因的菌种GV3101在含有50 mg/L卡那霉素 (Kan)、40 mg/L利福平 (Rif) 和50 mg/L庆大霉素的LB固体培养基上划线,28 ℃培养2 d。从平板上挑取单菌落接入10 mL含有50 mg/L Kan、40 mg/L Rif和50 mg/L庆大霉素的LB液体培养基中,28 ℃、150 r/min振荡培养过夜。吸取2 mL农杆菌菌液,转入100 mL含有50 mg/L Kan、40 mg/L Rif和50 mg/L庆大霉素的LB液体培养基中,28 ℃、150 r/min振荡培养4~5 h,直到菌液浓度OD600为0.6~0.7,将菌液4 ℃、4 000 r/min离心8 min,收集菌体,并将菌体重悬于已加入0、0.005%、0.01%的表面活性剂Silwet L-77的重悬培养基 (Suspension medium) (表2) 中,使重悬培养基 (表2) 的OD600为0.3、0.5、0.7、0.9。
3) 甜菜转化:将预培养的叶柄浸泡到农杆菌的重悬培养基 (表2) 中,摇荡10 min后弃掉菌液;用无菌滤纸吸干表面菌液后,将叶柄接种于铺有滤纸的共培养培养基 (Co-cultivation medium) (表2)中,暗培养3 d。
4) 延迟筛选、选择培养及植株再生:将共培养后的叶柄转接到延迟筛选培养基 (Delay-screening medium) (表2) 中,培养0 d、2 d、4 d、6 d。然后,转接到选择培养基 (Selection medium) (表2) 中进行选择培养,每隔15 d左右更换一次培养基。待抗卡那霉素甜菜再生芽长至2~3 cm时,切下放入生根培养基 (Root-induction medium) (表2) 中,诱导生根。
1.2.4 转基因甜菜的PCR及RT-PCR检测
待转化的甜菜生根后,采用CTAB法提取甜菜叶片基因组 DNA。通过PCR扩增来检测目的基因是否整合到甜菜基因组中。用Trizol法提取PCR阳性植株RNA,按照Tiangen公司的Trizol试剂说明书进行。首先反转录合成 cDNA,然后以此为模板进行PCR来检测目的基因是否表达。
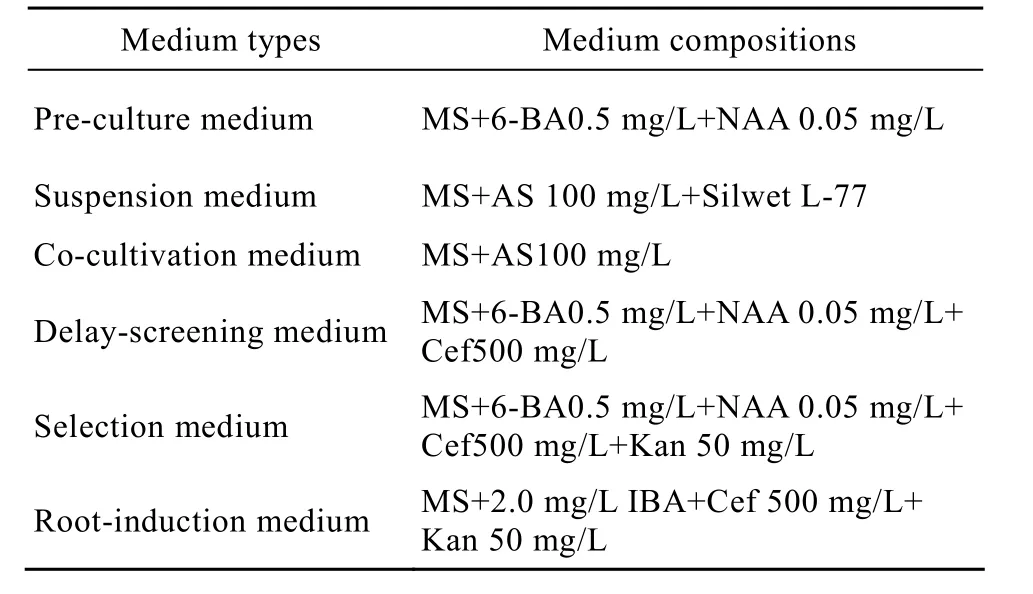
表2 甜菜转化和再生培养基Table 2 Media used in transformation and regeneration of sugar beet
2 结果与分析
2.1 双价植物表达载体 pCAMBIA2301-SP1-VvSUC11-SP2-VvSUC12的构建和鉴定
2.1.1 pCAMBIA2301-SP1载体的构建和鉴定
用 HindⅢ/DraⅢ双酶切重组质粒pCAMBIA2301-SP1,得到预期大小 (365 bp) 的片段 (图1A)。
2.1.2 pCAMBIA2301-SP2-GUS-SP1载体的构建和鉴定
用 HindⅢ/EcoRⅠ双酶切重组质粒pCAMBIA2301-SP2-GUS-SP1,得到预期大小 (约2.2 kb) 的片段 (图1B)。
2.1.3 pCAMBIA2301-SP2-VvSUC12-SP1载体的构建和鉴定
重组质粒pCAMBIA2301-SP2-VvSUC12-SP1用XbaⅠ/SacⅠ双酶切鉴定,得到1 850 bp大小的片段(图1C),与目标片段一致。
2.1.4 pCAMBIA2301-SP1-VvSUC11-SP2-VvSUC12载体的构建和鉴定
重组质粒 pCAMBIA2301-SP1-VvSUC11-SP2-VvSUC12用Dra Ⅲ单酶切鉴定,得到1 547 bp大小的片段 (图1D),与目标片段一致。
2.2 双价植物表达载体转化根癌农杆菌和 PCR鉴定
将 质 粒 pCAMBIA2301-SP1-VvSUC11-SP2-VvSUC12转化制备好的根癌农杆菌GV3101感受态细胞,在固体培养基 (LB+50 mg/L Kan+40 mg/L Rif+50 mg/L庆大霉素) 上筛选转化子。随机挑取不同单菌落接种于加有50 mg/L Kan、40 mg/L Rif和50 mg/L庆大霉素的LB液体培养基中,28 ℃,200 r/min培养大约48 h,使用基因VvSUC11的引物进行菌液PCR鉴定,得到预期1 547 bp的片段(图2)。
2.3 双价植物表达载体转化甜菜和甜菜遗传转化体系的建立
2.3.1 外植体预培养时间对抗性芽分化频率的影响
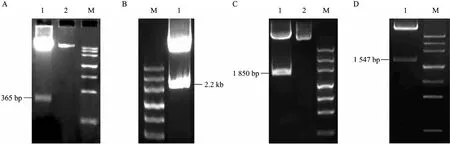
图1 双价植物表达载体pCAMBIA2301-SP1-VvSUC11-SP2-VvSUC12的构建和鉴定Fig. 1 Construction and identification of the bivalent plant expression vector pCAMBIA2301-SP1-VvSUC11-SP2-VvSUC12. (A) 1: pCAMBIA2301-SP1 is digested by Hind Ⅲ/Dra Ⅲ to get the 365 bp SP1 fragment; 2: recombined plasmid pCAMBIA2301-SP1; M: marker Ⅲ . (B) M:marker Ⅲ; 1: pCAMBIA2301-SP2-GUS-SP1 is digested by Hind Ⅲ/EcoR Ⅰto get about 2.2 kb SP2-GUS-NOS fragment. (C) 1: pCAMBIA2301-SP2-VvSUC12-SP1 is digested by Xba I/Sac I to get the 1 850 bp VvSUC12 fragment; 2: recombined plasmid pCAMBIA2301-SP2-VvSUC12-SP1; M: marker Ⅲ . (D) 1: pCAMBIA2301-SP1-VvSUC11-SP2-VvSUC12 is digested by Dra Ⅲ to get the 1 547 bpVvSUC11 fragment; M: marker Ⅲ.
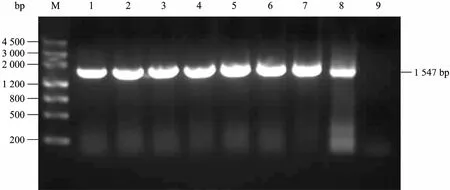
图2 双价植物表达载体转化根癌农杆菌的PCR鉴定Fig. 2 Identification of recombinant plasmid pCAMBIA2301- SP1-VvSUC11-SP2-VvSUC12 in A. tumefaciens strains GV3101 by PCR. M: marker Ⅲ; 1–7: Results of PCR of single-colony of A. tumefaciens strains GV3101 transformed by recombinant plasmid pCAMBIA2301-SP1-VvSUC11-SP2-VvSUC12; 8: PCR product of recombined plasmid pCAMBIA2301-SP1-VvSUC11-SP2-VvSUC12; 9: negative control.
取甜菜的叶柄约1 cm作外植体,在Pre-culture medium (表2) 中预培养2、4、6 d,进行遗传转化研究。预培养时间对抗性芽分化率有很大的影响,预培养4 d抗性芽分化率最高,可达37%。预培养过短或过长都会大大降低转化率 (图 3)。预培养过短侵染后外植体褐化严重,这可能是由于伤口尚未愈合的外植体对农杆菌比较敏感,恢复农杆菌对其的伤害能力较弱,在筛选培养基中褐化比较严重;预培养过长 (大于6 d) 抗性芽的分化频率降低,是因为部分外植体在侵染前已分化产生不定芽,这些不定芽在以后的选择培养中逐渐褐化死亡。
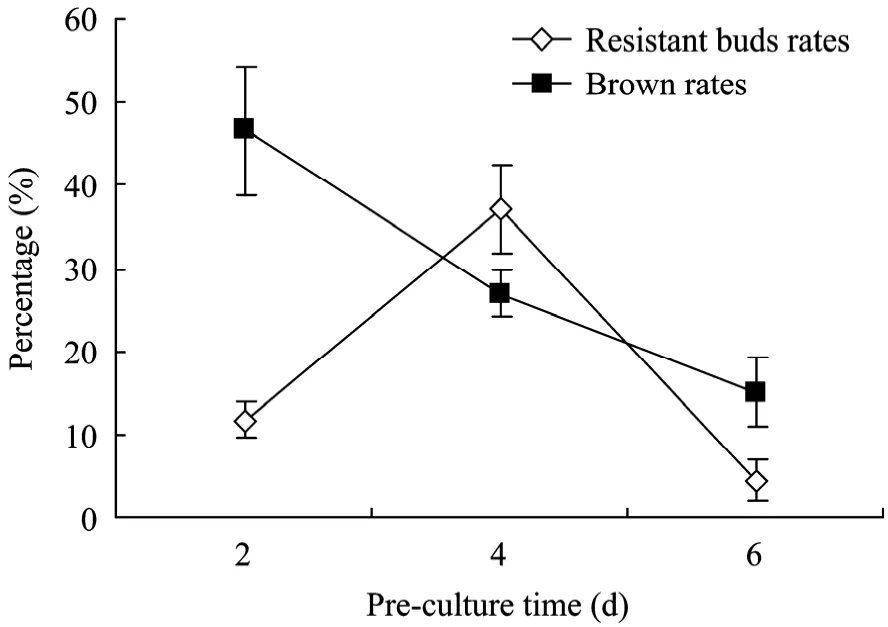
图3 预培养时间对转化效率的影响Fig. 3 Effect of pre-culture time on transformation efficiency.
2.3.2 农杆菌重悬液的浓度对抗性芽分化频率的影响
不同的外植体材料对根癌农杆菌的敏感性不同,为了确定最佳的侵染浓度,将预培养后的甜菜叶柄置于不同浓度的农杆菌重悬液中进行侵染。由图4可知,农杆菌重悬液浓度OD600为0.5时,侵染效果最佳,抗性芽分化率最高。菌液浓度 OD600高于 0.7时,外植体褐化加重,可能是因为高浓度的菌液对叶柄细胞有毒害作用。同时菌液浓度过高暗培养后农杆菌不易抑制,污染较重。
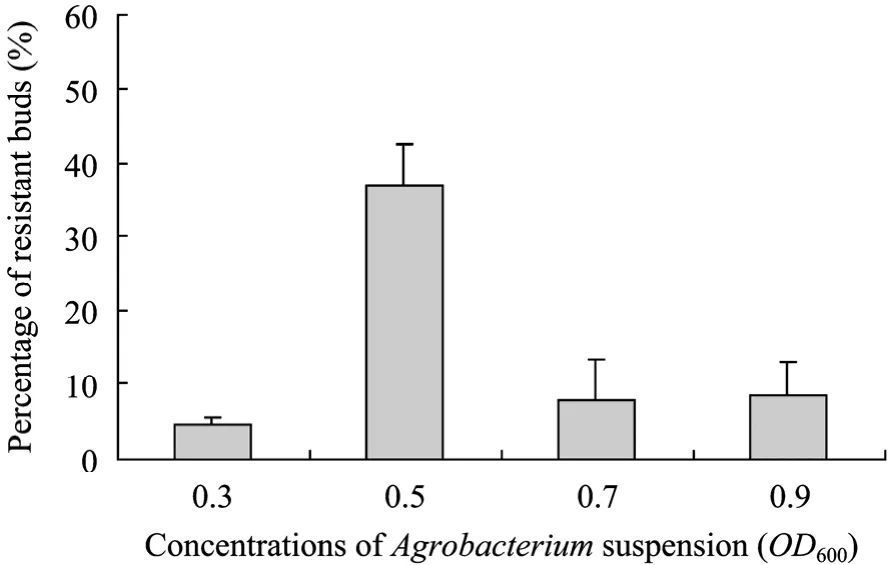
图4 农杆菌重悬液浓度对抗性芽分化频率的影响Fig. 4 Effect of concentrations of Agrobacterium suspension on resistant buds rates.
2.3.3 表面活性剂Silwet L-77的浓度对抗性芽分化频率的影响
表面活性剂Silwet L-77可以降低菌液的表面张力,增加菌液与外植体的接触面积,从而促进转化。但表面活性剂浓度过大对外植体有一定的伤害,所以要确定最适宜的浓度。为此,侵染前在农杆菌重悬液中加了0、0.005%、0.01%的表面活性剂Silwet L-77进行试验。由图5可知,当表面活性剂Silwet L-77的浓度为0.005%时叶柄的褐化率最低,抗性芽的分化频率最高,可达39%。
2.3.4 延迟筛选时间对对抗性芽分化频率的影响
共培养后的叶柄如果立刻进行筛选,则抗性芽的分化率比较低 (图 6),如果适当在 Delayscreening medium (表2) 中,培养一段时间会大大增加转化率。延迟筛选4 d,抗性芽的分化率最高,可达42%。延迟筛选时间大于4 d时,抗性芽也随之降低 (图6)。
2.3.5 转化甜菜的再生
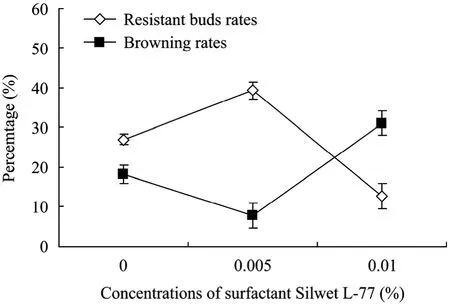
图5 表面活性剂Silwet L-77的浓度对转化效率的影响Fig. 5 Effect of concentrations of surfactant Silwet L-77on transformation efficiency.
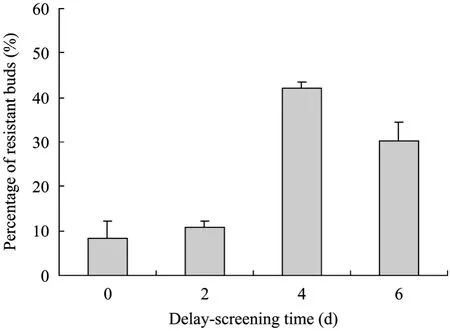
图6 延迟筛选时间对抗性芽分化频率的影响Fig. 6 Effect of delay-screening time on resistant buds rates.
甜菜叶柄预培养4 d (图7A),在OD600为0.5的含有 0.005% Silwet L-77的农杆菌 Suspension medium中侵染10 min;转入Co-cultivation medium中培养3 d,转入Delay-screening medium中培养4 d;移入Selection medium中选择培养30 d,得到抗性芽 (图7B)。待抗性芽长至2~3 cm时,切下放入Root-induction medium中生根 (图7C、D)。
2.4 转基因甜菜的PCR及RT-PCR检测
2.4.1 转基因植株的PCR检测
取 6株转化甜菜和 1株对照甜菜的叶片提DNA,分别用基因VvSUC11和VvSUC12的引物 (表1) 进行PCR检测。有4株检测到基因VvSUC11的活性 (图8A),有3株检测到基因 VvSUC12活性 (图8B)。PCR结果表明,在 6株转化甜菜中有3株是VvSUC11和 VvSUC12共整合到甜菜基因组中 (图9A、B)。
2.4.2 转基因植株的RT-PCR检测
以3株同时转化了2个基因的甜菜植株为材料,用基因 VvSUC11和 VvSUC12引物 (表 1) 进行RT-PCR检测。有 2株甜菜在根和茎中都检测到VvSUC11和VvSUC12的活性 (图9A、B),这可能是因为一般情况下,甘薯的甘薯贮藏蛋白(Sporamin) 基因的根部特异性启动子主要在块根中起作用[12],而在含蔗糖的培养基上生长的植物茎部也有其活性[13]。

图7 转化甜菜的再生Fig. 7 Regeneration of transformation sugar beet. (A) Pre-culture of petioles. (B) Regeneration of resistant buds. (C, D) Induced roots.
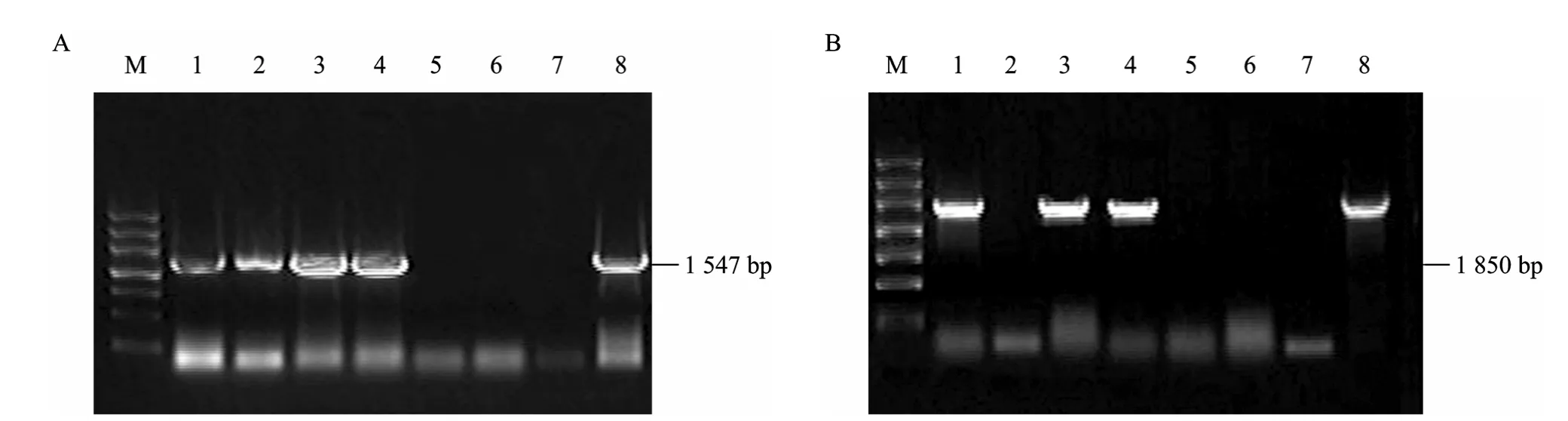
图8 转化甜菜的PCR检测结果Fig. 8 Identification of transformed sugar beets by PCR. (A) M: marker Ⅲ ; 1−6: PCR results of transformed sug ar beets using the primers of VvSUC11; 7: PCR results of wild-type sugar beet using the primers of VvSUC11; 8: PCR results of plasmid carrying VvSUC11 using the primers of VvSUC11. (B) M: marker Ⅲ ; 1−6: PCR results of transformed sugar beets using the primers of VvSUC12; 7: PCR results of wild-type sugar beet using the primers of VvSUC12; 8: PCR results of plasmid carrying VvSUC12 using the primers of VvSUC12.
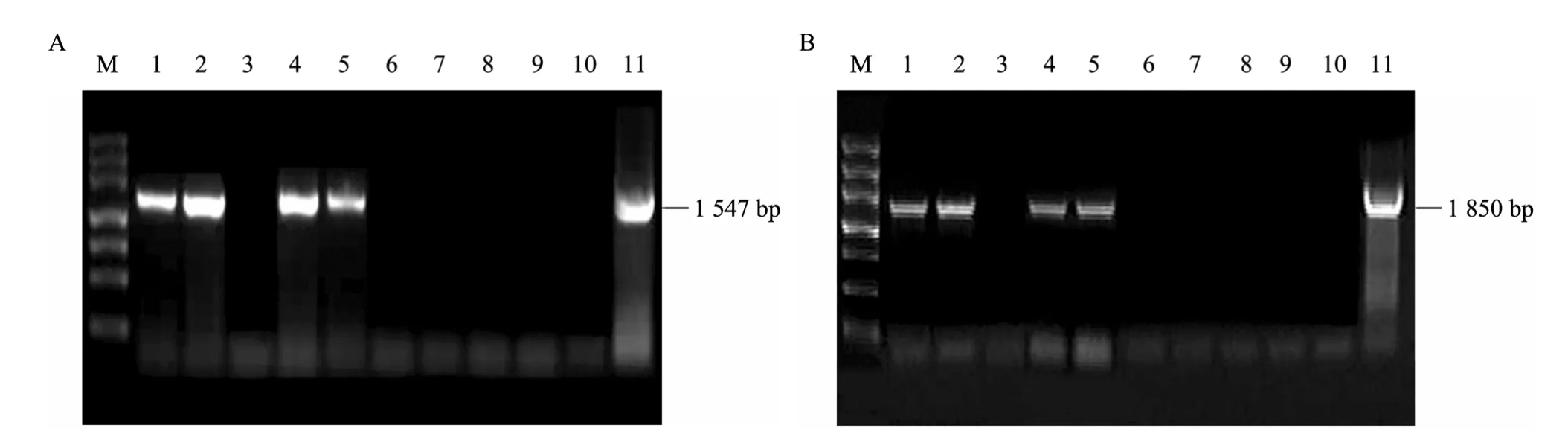
图9 转化甜菜的RT-PCR检测结果Fig. 9 Identification of transformed sugar beets by RT-PCR. (A, B) M: marker Ⅲ ; 1−3: RT-PCR results of root, stem, leaf of the fist transformed sugar beet respectively using the primers of VvSUC11and VvSUC12; 4−6 : RT-PCR results of root, stem, leaf of the second transformed sugar beet respectively using the primers of VvSUC11and VvSUC12; 7−9: RT-PCR results of root, stem, leaf of the third transformed sugar respectively using the primers of VvSUC11and VvSUC12; 10: RT-PCR results of wild-type sugar beet respectively using the primers of VvSUC11and VvSUC12; 11: RT-PCR results of plasmid pCAMBIA2301-SP1-VvSUC11-SP2-VvSUC12 respectively using the primers of VvSUC11and VvSUC12.
3 讨论
根据系统发生学的分析,所有已知的蔗糖转运蛋白和蔗糖转运蛋白类似蛋白可以分为 3个亚群:SUT1、SUT2和SUT4;VvSUC11属于SUT4亚群,VvSUC12 属于SUT2亚群[14]。SUT4亚群中的成员一般都具有低亲和性/高转运能力 (Low-affinityhigh-capacity,LAHC)[14]。尽管该类 SUT对蔗糖的亲和力要弱一些,但在蔗糖浓度高时却有助于大量蔗糖的转运。它们主要参与高浓度蔗糖的转运步骤,向库组织大量转运蔗糖,在决定库容大小上起主要作用,还可能参与蔗糖吸收效率的调控[15]。SUT2亚族或为无蔗糖转运能力、可能具有蔗糖信号感应(Sucrose sensing) 功能的类蔗糖载体蛋白[4],或为低亲和性/高转运能力的蔗糖载体蛋白[16-17]。Manning等[8]研究表明,VvSUC11和VvSUC12在葡萄果浆中作用是负责蔗糖从质外体向薄壁细胞装载。可见,VvSUC11和VvSUC12决定着葡萄浆果的糖含量。
植 物 SUC 属 于 MFS (Major facilitator superfamily) 中的糖转运家族的一个中等规模的亚家族[18]。属于 MFS 的膜蛋白,通过寡聚化(Oligomerization) 而形成同源二聚体、异源二聚体、甚至四聚体等是一种非常普遍的现象,这可能是其调节自身转运活性的一种方式[19]。根据不同蔗糖载体蛋白在植株中的分布和组织细胞定位、不同的动力学特征及表达调控模式等推测,寡聚化可能也是植物对其蔗糖载体转运活性进行精确调控的一种主要方式[20]。Davies等[7]研究发现,VvSUC11 和VvSUC12在葡萄浆果中的表达模式一致,当己糖开始在液泡中积累的时候,VvSUC11和VvSUC12在浆果中的表达增加。这暗示了 VvSUC11和 VvSUC12在功能上可能存在着互作。基于这种考虑,本研究构建了含这两个基因的双价植物表达载体。
农业生产中,为了获得高产,不仅要设法提高光合作用形成的生物学产量,而且要通过一定的措施来提高经济学产量。本研究把甘薯的甘薯贮藏蛋白 (Sporamin) 基因的根部特异性启动子构建到载体上用于启动VvSUC11和VvSUC12基因的表达,就是根据蔗糖转运蛋白在糖分积累中的作用,从调控源到库关系的角度出发,来定向的提高甜菜的经济学产量,为通过基因工程的方法来提高农作物的产量提供新的思路。
本研究成功构建了含有甘薯的甘薯贮藏蛋白基因根部特异性启动子的植物表达载体 pCAMBIA2301-SP1-VvSUC11-SP2-VvSUC12;并首次将VvSUC11和VvSUC12基因转化到甜菜中使其表达,来研究其能否提高甜菜的含糖量,为利用蔗糖转运蛋白来提高农作物的有效的经济学产量奠定坚实理论和应用基础。建立了高效的甜菜遗传转化体系,为通过基因工程的方法来改良甜菜的品质提供方便。
REFERENCES
[1] Kühn C, Barker L, Bürkle L, et al. Update on sucrose transport in higher plants. J Exp Bot, 1999, 50: 935−953.
[2] Buchanan BB, Gruissem W, Jones RL. Biochemistry & Molecular Biology of Plants. Rockville: American Society of Plant Physiologists, 2000: 748−776.
[3] Williams LE, Lemoine R, Sauer N. Sugar transporters in higher plants-a diversity of roles and complex regulation. Trends Plant Sci, 2000, 5(7): 283−290.
[4] Barker L, Kühn C, Weise A, et al. SUT2, a putative sucrose sensor in sieve elements.Plant Cell, 2000, 12(7): 1153−1164.
[5] Riesmeier JW, Willmitzer L, Frommer WB. Isolation and characterization of a sucrose carrier cDNA from spinach by functional expression in yeast. EMBO J, 1992, 11(13): 4705−4713.
[6] Lalonde S, Boles E, Hellmann H, et al. The dual function of sugar carriers: transport and sugar sensing. Plant Cell, 1999, 11(4): 707−726.
[7] Davies C, Wolf T, Robinson SP. Three putative sucrose transporters are differentially expressed in grapevine tissues. Plant Sci, 1999, 147(2): 93−100.
[8] Manning K, Davies C, Bowan HC, et a1. Functionalcharacterization of two ripening-related sucrose transporters from grape berries. Ann Bot, 2001, 87(1): 125−129.
[9] Chen S, Zeng L, Chen SW, et a1. Differentiated expression of VvSUC12 and VvSUC27 in embryogenic and nonembryogenic calli of Vitis vinifera L. Chin J Biotech, 2010, 26(4): 530−537.陈思, 曾磊, 陈尚武, 等. 蔗糖转运蛋白基因 VvSUC12和VvSUC27在葡萄胚性和非胚性愈伤组织中的差异表达. 生物工程学报, 2010, 26(4): 530−537.
[10] Zhang YL, Meng QY, Zhu HL, et al. Functional characterization of a LAHC sucrose transporter isolated from grape berries in yeast. Plant Growth Regul, 2008, 54(1): 71−79.
[11] Zhang YW. Preliminary studies of sucrose transporter function in improving the yield of sugar of sugar beet [D]. Shihezi: Shihezi University, 2009.张彦伟. 蔗糖转运蛋白基因在提高甜菜含糖量中的初步研究[D]. 石河子: 石河子大学, 2009.
[12] Hattori T, Nakamura K. Genes coding for the major tuberous root protein of sweet potato: identification of putative regulatory sequence in the 5’upstream region. Plant Mol Biol, 1988, 11(4): 417−426.
[13] Ohta S, Hattori T, Morikami A, et al. High-level expression of a sweet potato sporamin gene promoter: β-glucuroidase (GUS) fusion gene in the stems of transgenic tobacco plants is conferred by multiple cell type-specific regulatory elements. Mol Gen Genet, 1991, 225(3): 369−378.
[14] Kühn C, Hajirezaei MR, Fernie AR, et al. The sucrose transporter StSUT1 localizes to sieve elements in potato tuber phloem and influences tuber physiology and development. Plant Physiol, 2003, 131(1): 102−113.
[15] Weise A, Barker L, Kühn C, et al. A new subfamily of sucrose transporters, SUT4, with low affinity/high capacity is localized in enucleate sieve elements of plants. Plant Cell, 2000, 12(8): 1345−1355.
[16] Schulze W, Weise A, Frommer WB, et al. Function of the cytosolic N-terminus of sucrose transporter AtSUT2 in substrate affinity. FEBS Lett, 2000, 485(2/3): 189−194.
[17] Meyer S, Melzer M, Truernit E, et al. AtSUC3, a gene encoding a new Arabidopsis sucrose transporter, is expressed in cells adjacent to the vascular tissue and in a carpel cell layer. Plant J, 2000, 24(6): 869−882.
[18] Lemoine R. Sucrose transporters in plants: update on function and structure. BBA Biomembranes, 2000, 1465(1/2): 246−262.
[19] Veenhoff LM, Heuberger EHML, Poolman B. The lactose transport protein is a cooperative dimer with two sugar translocation pathways. EMBO J, 2001, 20(12): 3056−3062.
[20] Reinders A, Schulze W, Kühn C, et al. Protein-protein interactions between sucrose transporters of difierent affinities colocalized in the same enucleate sieve element. Plant Cell, 2002, 14(7): 1567−1577.
