日本七鳃鳗Arg-Gly-Asp毒素蛋白Lj-RGD3野生型与RGD全缺失突变体Lj-112的抗血管新生作用
2011-02-09王继红张亚前吕莉刘欣李庆伟
王继红,张亚前,吕莉,刘欣,李庆伟
1 辽宁师范大学生命科学学院,大连 116029
2 辽宁省生物技术与分子药物研发重点实验室,大连 116029
3 大连医科大学药学院药理教研室,大连 116044
七 鳃 鳗 Lampetra japonica 属 圆 口 纲Cyclostomata、七鳃鳗目、七鳃鳗科、七鳃鳗属,是迄今发现的最古老的无颌脊椎动物[1]。其为海洋洄游性鱼类,成体在海洋中用吸盘附在其他鱼体上吸食血肉而营半寄生生活。由于日本七鳃鳗可使被其所吸附的鱼血流不止,所以可以断定七鳃鳗口腔腺分泌物中具有抗凝血成分,其基因为独有的特化基因。鉴于此,本课题组从前期研究工作中发现了一条存在于七鳃鳗口腔腺的含有 3个 RGD (Arg-Gly-Asp)模体的毒素蛋白Lj-RGD3[2]。
RGD毒素蛋白为一类含 RGD (Arg-Gly-Asp)模体的来源于吸血或有毒生物唾液腺的分泌蛋白,其可凭借蛋白质一级结构上特有的RGD分子序列而成为细胞外基质与细胞整合素间结合的强效竞争性拮抗剂,进而通过封闭整合素细胞信号转导通路而起到抑制血小板聚集、抑制血管新生和抗肿瘤细胞增殖等作用。迄今为止已发现有4个不同物种来源的RGD毒素蛋白家族,这4大家族分别来源于蛇毒、吸血动物水蛭、蜱类及七鳃鳗唾液腺分泌物[2-9]。来源于七鳃鳗口腔腺的 Lj-RGD3蛋白是本课题组发现的世界上第 4大类 RGD毒素蛋白(GenBank Accession No. ACS71748.1)。前期实验证明,rLj-RGD3具有抗血管新生、抗肿瘤增殖及抗血小板聚集的功能,且这些功能皆以细胞表面表达的整合素为靶点,这说明Lj-RGD3是一种典型的RGD毒素蛋白[2,10]。
一级结构的分析与比对结果表明,Lj-RGD3除具有RGD毒素蛋白的RGD模体特征外,其在一级结构上与富含组氨酸糖蛋白 (Histidine-rich glycoprotein,HRG) 有同源性。富含组氨酸糖蛋白为发现于脊椎动物血液中的血浆糖蛋白,由肝脏合成并释放入血。其具有4个结构域:N端的N1-结构域、N2-结构域、C末端-Domain及富含组氨酸结构域。其中的富含组氨酸结构域能同时与众多配体结合而行使多种功能,比如:抗血管新生,可溶性免疫复合物抑制,加强巨噬细胞对凋亡细胞的清除,抗菌等生物学活性[11]。
鉴于 HRG也具有抗血管新生活性,本文对Lj-RGD3进行了3个RGD模体的全缺失突变 (命名为Lj-112),对作为RGD毒素肽的野生型Lj-RGD3与作为类HRG的突变体Lj-112的抗血管新生活性进行了比较,以确定Lj-RGD3结构与功能的关系。
1 材料与方法
1.1 材料和试剂
野生型成体七鳃鳗Lampetra japonica采自于中国黑龙江流域。
ECV304 (人脐静脉内皮细胞) 细胞购自武汉大学;pET23b空质粒及pET23b-RGD3重组质粒为本实验室保存;质粒提取试剂盒、IPTG购自购自宝生物大连公司;组氨酸亲和层析柱 (His·Bind Column)购自Novagen公司;胎牛血清购自德国PAA公司;碱性成纤维细胞生长因子 (Basicfibroblast growth factor,bFGF) 购自PEPROTECH INC;四甲基偶氮咪唑 (MTT)、细胞裂解液购自碧云天公司;ELISA试剂盒和Matrigel均购自美国BD公司;96孔板、Transwell细胞培养板购自 Corning Costar公司;6日龄鸡胚购自大连韩伟养鸡场。
1.2 生物信息学分析
采用 ExPASy系统软件对蛋白的氨基酸组成和等电点进行分析,采用UniProt blastp检索程序对蛋白进行序列比对。
1.3 目的基因的合成
野生型Lj-RGD3基因含有大量重复序列,无法进行基因的定点突变,故采用全基因序列合成方法。Lj-RGD3 3个RGD模体的全缺失突变基因由大连宝生物公司合成,合成后基因以NdeⅠ和HindⅢ为酶切位点构建至pET23b载体。
1.4 重组质粒转化
提取突变体阳性克隆质粒 pET23b-112,CaCl2法[12]转化至表达菌大肠杆菌 Escherichia coli BL21中。
1.5 蛋白的诱导表达及纯化鉴定
对转化后阳性菌进行 30 ℃过夜的异丙基-β-D-硫代吡喃半乳糖苷 (IPTG) 诱导表达,收集菌体经超声破碎及离心后,提取上清,采用 Novagen公司的组氨酸亲和层析柱对其进行纯化,以含甘油的Tricine-SDS-PAGE[13]电泳法进行蛋白质纯度鉴定。
1.6 rLj-RGD3野生型与突变体蛋白rLj-112之间部分生物学活性的比较
1.6.1 MTT法检测蛋白对细胞增殖的影响
将ECV304细胞接种于96孔板中,加入终浓度为30 pg/L的bFGF诱导细胞增殖24 h后,加入不同浓度的野生型Lj-RGD3与突变体Lj-112蛋白继续培养24 h,MTT法测定波长为490 nm下的光吸收值。
1.6.2 鸡绒毛尿囊膜 (CAM) 实验
采用6日龄鸡胚,bFGF诱导24 h后,以30 µL浓度为0.2 g/L的野生型rLj-RGD3、突变体rLj-112蛋白作用于鸡胚,同时以 30 µL的七鳃鳗rLj-GRIM19 (0.2 g/L)、PBS、洗脱液为阴性对照,24 h后观察血管的生长情况。
1.6.3 细胞迁移实验
采用Corning Costar公司的Transwell (8.0 µm pore size,polycarbonate filter,多聚碳酸盐膜) 细胞培养板来比较以 bFGF为趋化剂,各蛋白及对照组试剂对上室内ECV304细胞向下室迁移的影响。对迁移到Transwell下表面的细胞以Olympus显微镜观察,每个样片随机选取4个视野拍照并计数(计数软件为Dotcounter),将数据进行数学统计。
1.6.4 细胞浸润实验
将人工基质膜Matrigel铺在Transwell的膜上,利用 Matrigel和 Transwell模仿体内环境,同样以bFGF为趋化剂来检测两种蛋白对ECV304细胞浸润的影响。其余操作与细胞迁移实验相同。
1.6.5 酶联免疫分析 (ELISA) 法检测两种蛋白对整合素连接激酶ILK-1表达的影响
在 ECV304细胞中加入终浓度为30 pg/L的bFGF诱导24 h后,加入同等剂量的野生型rLj-RGD3及突变体 rLj-112,继续培养 24 h,裂解细胞,10 000×g离心3 min,取上清。按照试剂盒说明书采用ELISA法检测蛋白对ILK-1表达的影响。
1.7 统计方法
应用SPSS13.0统计软件采用方差分析对结果进行统计分析。
2 结果
2.1 野生型Lj-RGD3的序列比对及突变体Lj-112的cDNA序列合成
Lj-RGD3由118个氨基酸组成[10],其一级结构含有 17个组氨酸、17个精氨酸和 20个苏氨酸,ExPASy软件预测理论等电点为 10.01,属碱性蛋白。运用UniProt blastp程序对野生型Lj-RGD3进行序列比对,结果表明,Lj-RGD3与马来丝虫Brugia malayi的富含组氨酸糖蛋白HRG有40%序列一致性,与马来丝虫的TCRβ具有45%的序列一致性 (图1)。
由于HRG蛋白具有抗血管新生作用,本文对3个RGD模体全缺失后的Lj-RGD3基因进行了序列合成 (由于含有大量重复序列,无法直接做定点突变),合成序列克隆至pET23b载体 (图2~3)。突变体命名为Lj-112。
2.2 基因重组蛋白rLj-RGD3、rLj-112的 IPTG诱导表达、纯化及鉴定
Tricine的SDS-PAGE鉴定结果显示,亲和层析后获得了可溶性的rLj-RGD3和rLj-112纯化蛋白,二者纯度都在95%以上,分子量为15 kDa左右,这为进一步的生物学活性研究奠定了基础。由于rLj-RGD3和rLj-112都为碱性蛋白质,故其电泳行为受所带电荷影响而比预期位置滞后 (图4)。

图1 Lj-RGD3的UniProt blastp序列比对结果Fig. 1 Results of Lj-RGD3 NCBI blasting. HRGP: Histidine-rich glycoprotein, Brugia malayi (nematode worm); TCR β: T-cell receptor beta chain ANA 11, Brugia malayi (nematode worm). Identical residues are highlighted in grey.

图2 野生型Lj-RGD3的cDNA及其推导的氨基酸序列Fig. 2 cDNA and deduced amino acid sequence of Lj-RGD3.

图3 突变体Lj-112的cDNA及其推导的氨基酸序列Fig. 3 cDNA and deduced amino acid sequence of Lj-112.

图4 Tricine SDS-PAGE分析经亲和层析纯化的均质蛋白Fig. 4 Tricine SDS-PAGE of the homogeneous protein purified by affinity chromatography. 1: mutation protein Lj-112; 2: Lj-RGD3 toxin protein; 3: SpectraTM multicolor low range protein ladder.
2.3 野生型rLj-RGD3与突变体rLj-112抗血管新生活性比较
2.3.1 对bFGF诱导的ECV304细胞增殖的抑制作用
MTT结果显示,野生型rLj-RGD3与突变体蛋白rLj-112对bFGF诱导的ECV304的细胞增殖都呈剂量依赖性抑制,rLj-RGD3的半剂量效应 (Median infective dose,IC50) 为0.889 µmol/L,突变体rLj-112的IC50为0.160 µmol/L。结果表明,rLj-112对血管内皮细胞 ECV304增殖的抑制强度约为野生型rLj-RGD3的6倍 (图5)。
2.3.2 对bFGF诱导的鸡绒毛尿囊膜 (CAM) 血管新生的抑制作用
肿瘤的生长和转移与血管生成有密切的关系,鸡胚对抑制血管生成的药物比较敏感,是研究血管新生和抗血管形成的最佳体内模型之一。CAM血管新生实验结果显示,加入30 µL同等体积的PBS、七鳃鳗rLj-GRIM19 (6 µg)、蛋白纯化洗脱液的对照组血管新生旺盛,对血管新生无抑制作用;而加入30 µL (6 µg) 同等剂量的rLj-RGD3和rLj-112组的CAM 血管新生都遭到破坏,且突变体蛋白 rLj-112对CAM血管新生的抑制作用强于野生型rLj-RGD3 (图6)。
2.3.3 ECV304细胞的迁移实验

图5 野生型rLj-RGD3与突变体rLj-112对ECV304细胞增殖的抑制作用Fig. 5 Inhibition on ECV304 cells proliferation by rLj-RGD3 and rLj-112.

图6 野生型rLj-RGD3与突变体rLj-112对血管新生的抑制作用Fig. 6 rLj-RGD3 and rLj-112 to inhibit bFGF-induced angiogenesis in chick CAM assays. A window was opened on the egg shell and a methylcellulose disc containing 200 ng bFGF was implanted on CAMs of 6-days-old chick embryos. After 24 h of bFGF induction, 30 µL of PBS (A), 30 µL (6 µg) of rLj-GRIM19 (B), 30 µL of elution buffer (C), 30 µL (6 µg) of rLj-112 (D), 30 µL (6 µg) of rLj-RGD3(E) was applied to the embryos. 24 h later, CAM tissues were photographed with digital camera. The circles show the position of methylcellulose disc and the arrows show the discontinuous vessels.
血管新生高度依赖于内皮细胞的的迁移,以bFGF作为趋化剂,比较野生型rLj-RGD3及突变体蛋白rLj-112对ECV304细胞迁移的影响。结果表明,与对照组相比,同等剂量 (16 µg) 的野生型rLj-RGD3和突变体蛋白 rLj-112均可抑制 ECV304细胞的迁移,其迁移抑制率分别为50%和63%,突变体rLj-112对ECV304细胞迁移的抑制作用强于野生型 rLj-RGD3。阴性对照组小牛血清白蛋白 BSA及蛋白纯化洗脱液则对 ECV304细胞的迁移无影响(图7~8)。
2.3.4 ECV304细胞的浸润实验
浸润同样是血管新生的一个重要步骤,血管内皮细胞只有在穿透细胞外基质的情况下,才得以出芽的方式形成新的血管。利用人工基质膜 matrigel和Transwell模仿体内环境,可以有效地研究细胞的浸润行为。结果显示,PBS、BSA及洗脱缓冲液对照组对ECV304细胞的浸润无抑制作用,而野生型rLj-RGD3与突变体rLj-112后均可抑制ECV304细胞的浸润,且rLj-112的作用较强 (图9~10)。
2.3.5 ELISA法测定两种蛋白对ILK-1表达的影响
与只加入PBS的对照组相比,rLj-RGD3野生型与突变体蛋白 rLj-112均可抑制 bFGF诱导的ECV304 ILK-1的表达,且效果随抑制剂浓度增高而加强。相比之下,同剂量的rLj-112对ILK表达的抑制效果强于rLj-RGD3。BSA及蛋白纯化洗脱液则对整合素连接激酶 (ILK-1) 表达无抑制作用(图11)。

图7 野生型rLj-RGD3与突变体rLj-112抑制ECV304细胞向bFGF迁移Fig. 7 Inhibitory effects of rLj-RGD3 and rLj-112 on ECV304 cells migration towards bFGF. **P<0.01 versus PBS alone, n=8.

图8 野生型rLj-RGD3与突变体rLj-112对ECV304细胞向bFGF迁移的影响 (Olympus光学显微镜拍照,400×)Fig. 8 Inhibitory effects of rLj-RGD3 and rLj-112 on Ecv304 cells migration towards bFGF (Olympus light microscopy, 400×). ECV304 cells were treated with PBS (A), rLj-RGD3 (B) or rLj-112 (C) for 30 min, and then placed in the upper chamber of Transwell. bFGF (30 pg/L) was present as a chemoattractant which was added to the lower chamber. After 16 h incubation, cells were fixed in 4% paraformaldehyde. After removal of the nomigrated cells, the cells that migrated to the underside of filter membrane were photographed (400×) under Olympus light microscope.
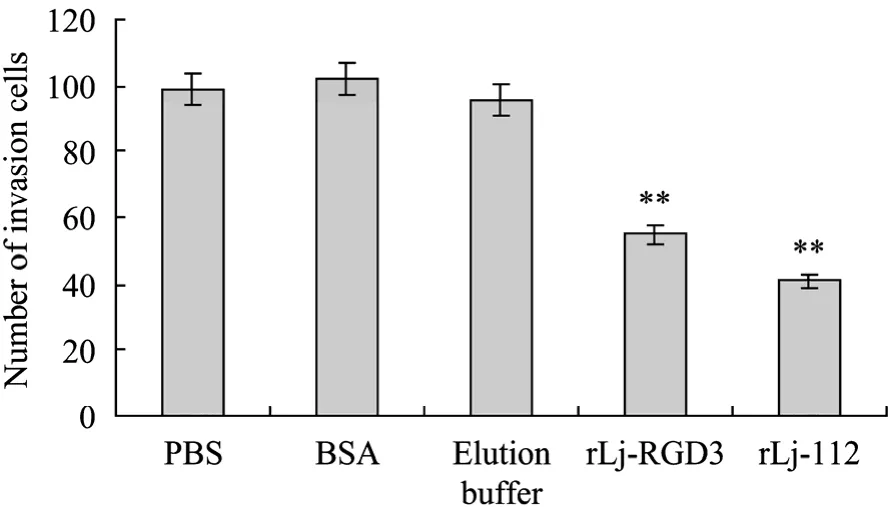
图9 野生型rLj-RGD3与突变体rLj-112抑制ECV304细胞的浸润Fig. 9 Inhibition of rLj-RGD3 and rLj-112 on ECV304 cells invasion through Matrigel. **P<0.01 versus PBS alone, n=8.

图10 野生型rLj-RGD3与突变体蛋白rLj-112对ECV304细胞浸润行为的影响 (Olympus光学显微镜拍照,400×)Fig. 10 Inhibitory effects of rLj-RGD3 and rLj-112 on ECV304 cells invasion through Matrigel (Olympus light microscopy, 400×). ECV304 cells were treated with PBS (A), rLj-RGD3 (B) or rLj-112 (C) for 30 min, and then placed in the upper chamber of containing filer membrane which has been coated with Matrigel. bFGF (30 pg/L) was present as a chemoattractant which was added to the lower chamber. After 16 h incubation, cells were fixed in 4% paraformaldehyde. After removal of the nomigrated cells, the cells that migrated to the underside of filter membrane were photographed (400×) under Olympus light microscope.

图11 野生型 rLj-RGD3与突变体rLj-112对ECV304中整合素连接激酶ILK-1表达的影响Fig. 11 Effects of ILK-1 expression on ECV304 cells by rLj-RGD3 and rLj-112. The black one is at presence of PBS, 1.2 µg of rLj-RGD3 or rLj-112 with ECV304 cells; the light one is at presence of PBS, 4.4 µg of rLj-RGD3 or rLj-112 with ECV304 cells. * P<0.05 versus PBS alone, n=3.
3 讨论
日本七鳃鳗成体营寄生生活,为吸血动物。其头部鳃下肌中有一对口腔腺,能分泌大量蛋白质。本实验室前期工作表明,七鳃鳗口腔腺天然分泌蛋白混合物及160 kDa的BGSP-1具有纤维蛋白原水解活性,具抗凝功能[13-14]。此外,口腔腺分泌蛋白提取物还具有抑制神经元细胞兴奋性功能[14]。对于吸血动物而言,宿主的凝血和对被吸食的痛感是寄生生活的障碍,而上述研究结果解释了七鳃鳗营寄生生活习性的生理基础。随着七鳃鳗口腔腺 cDNA文库的建立,本实验室又发现了一条具有抗血小板聚集功能的Lj-RGD3蛋白[2],这说明七鳃鳗抗凝血功能涉及不只一种蛋白。
日本七鳃鳗野生型Lj-RGD3是含有3个RGD模体的RGD毒素蛋白。迄今为止已发现有4个不同物种来源的RGD毒素蛋白家族,这4大家族分别来源于蛇毒、吸血动物水蛭、蜱类及七鳃鳗唾液腺分泌物[2]。来源于蛇毒的 RGD毒素蛋白也叫去整合素,是被研究得最为透彻也是最大的一族,依蛇种来源不同种类可达数十种[9,15-17];来源于水蛭唾液腺的RGD毒素蛋白到目前为止只发现2类:decorsin及ornatin[5-6];来源于蜱类的RGD毒素蛋白也有2种:variabilin及 savignygrin[7-8];来源于七鳃鳗口腔腺的 Lj-RGD3蛋白是本课题组发现的第4大类RGD毒素蛋白[2]。由Lj-RGD3一级结构分析可以看出,来自于蛇毒这一物种的去整合素之间同源性较高 (60%以上),而物种间的 RGD模体毒素除具有RGD模体和多对半胱氨酸的共性外,在一级结构上没有同源性[2]。
本实验室前期工作表明,rLj-RGD3具有抗血管新生、抗肿瘤增殖及抗血小板聚集的功能,且这些功能皆以细胞表面表达的整合素为靶点,这说明Lj-RGD3是一种典型的RGD毒素蛋白[2,10]。生物信息学分析表明,Lj-RGD3在一级结构上除了与其他物种的RGD毒素肽一级序列有RGD模体的共性外,同样与之没有同源性。然而,运用UniProt blastp进行序列比对后发现,Lj-RGD3因富含组氨酸而与马来丝虫Brugia malayi的富含组氨酸糖蛋白HRG有40%序列一致性,与马来丝虫的TCRβ具有45%的序列一致性。由于前期证实Lj-RGD3具抗血管新生功能,故本文测重于Lj-RGD3突变后的类HRG功能研究。有关其TCRβ的功能将另文报道。
富含组氨酸糖蛋白为发现于脊椎动物血液中的血浆糖蛋白,由肝脏合成并释放入血。其具有4个结构域:N端的 2个半胱氨酸蛋白酶抑制剂(Cystatin) 结构域、C末端结构域及中心富含组氨酸结构域。这其中的富含组氨酸结构域可与众多配体结合而行使多种功能,比如:抗血管新生、可溶性免疫复合物抑制、加强巨噬细胞对凋亡细胞的清除、抗菌等生物学活性。HRG配体包括Zn2+、原肌球蛋白、肝素和硫酸肝素、血纤维蛋白溶酶原、血纤维蛋白溶酶、纤维蛋白原、凝血酶感蛋白、IgG、FcgR及补体等。正是由于 HRG有如此众多配体,致使HRG可以与相当宽范围的细胞结合,这包括:内皮细胞、成纤维细胞、T细胞、巨噬细胞、红血球、血小板、类单核细胞株及坏死细胞[11]。
富含组氨酸的糖蛋白 (HRG) 可以有效地抑制血管新生,Vanwilddemeersch等[18]研究表明,HRG是通过其蛋白水解后释出来的His-rich结构域行使其血管新生抑制剂功能的。而来源于His-rich结构域的一个35个氨基酸残基的合成肽HRGP330和一个26个氨基酸残基的合成肽HRGP335在体内与体外均具有血管新生抑制活性。HRGP330和HRGP335是通过与血管内皮细胞表面的肝素/硫酸肝素结合而行使抗血管新生功能。Juarez等报道HRGP以His-rich结构域依赖方式抑制血管内皮细胞的管形成和增殖,HRGP335有抗内皮细胞趋化的作用[19]。
Lj-RGD3一级结构富含组氨酸残基,与HRG有同源性。将野生型的RGD3的3个RGD全部突变形成的突变体Lj-112可以说是一种类富含组氨酸糖蛋白。本文对RGD模体全缺失突变体Lj-112的抗血管新生活性进行了研究。正常的RGD毒素蛋白进行RGD模体缺失后,应该失去抗血管新生活性,而本文得到的研究结果表明,含组氨酸的RGD全缺失突变体Lj-112的抗血管新生功能却更加强大,其抑制ECV304细胞增殖、迁移、浸润和CAM血管新生的功能均强于野生型Lj-RGD3,这表明Lj-112是以类HRG的形式行使的抗血管新生功能。尽管两种蛋白对整合素连接激酶 ILK-1的表达均有下调作用,但可以推测Lj-RGD3与Lj-112是以不同机制行使功能的。本实验室前期工作表明Lj-RGD3是以整合素为作用靶点的;而由于已有研究证实HRG可通过结合肝素/硫酸肝素位点阻止bFGF的信号转导从而下调ILK的表达[20-21],所以可以推测Lj-112有可能是以ECV304细胞表面的肝素/硫酸肝素为靶点,这有待于进一步证实。本研究还表明,Lj-RGD3在 RGD模体存在的情况下,是优先与Integrin结合的,其与HRG同源的特性在RGD模体存在的条件下,并未使野生型 Lj-RGD3抗血管新生功能得到协同增强。而七鳃鳗的Lj-RGD3则可能会通过mRNA剪切或蛋白翻译后剪切去掉RGD模体后,以截然不同的方式行使功能,七鳃鳗cDNA数据库中存在的大量HRG序列有可能是这种推测的证据,这还有待于进一步研究。
血管生成在胚胎血管形成、伤口愈合和器官的再生中都起到关键的作用,而肿瘤的增长和迁移依赖于血管新生,内皮细胞的浸润和迁移可以调节肿瘤的增殖[22]。抑制肿瘤的血管新生是治疗癌症的重要手段。野生型Lj-RGD3与突变体蛋白Lj-112对血管新生均具有抑制作用,突变体蛋白Lj-112显示出了比野生型Lj-RGD3更有效的抑制作用,而且二者的作用靶点并不一致,这为以Lj-RGD3为原型的抗肿瘤药物研发提供了多种可能,具有广阔的应用前景。
REFERENCES
[1] Gao Q, Pang Y, Wu Y, et al. Expressed sequence tags (ESTs) analysis of the oral gland of Lampetra japonica. J Genet Genomic, 2005, 32(10): 1045−1052.
[2] Wang JH, Han XX, Yang HS, et al. A novel RGD-toxin protein, Lj-RGD3, from the buccal gland secretion of Lampetra japonica impacts diverse biological activities. Biochimie, 2010, 92(10): 1387−1396.
[3] Kini RM, Chow G. Exogenous inhibitors of platelet aggregation from animal sources, Thromb Haemost, 2001, 85(1): 179−181.
[4] Kini RM, Evans HJ. Structural domains in venom proteins: evidence that metalloproteinases and nonenzymatic platelet aggregation inhibitors (disintegrins) from snake venoms are derived by proteolysis from a common precursor. Toxicon, 1992, 30(3): 265−293.
[5] Krezel AM, Ulmer JS, Wagner G, et al. Recombinant decorsin: dynamics of the RGD recognition site. Protein Sci, 2000, 9(8): 1428−1438.
[6] Mazur P, Henzel WJ, Seymour JL, et al. Ornatins: potent glycoprotein IIb-IIIa antagonists and platelet aggregation inhibitors from the leech Placobdella ornata. Eur J Biochem, 1991, 202(3): 1073−1082.
[7] Wang X, Coons LB, Taylor DB, et al. Variabilin, a novel RGD-containing antagonist of glycoprotein IIb-IIIa and platelet aggregation inhibitor from the hard tick Dermacentor variabilis. J Biol Chem, 1996, 271(30): 17785−17790.
[8] Mans BJ, Louw AI, Neitz AW, et al. A platelet aggregation inhibitor from the soft tick Ornithodoros savignyi, presents the RGD integrin recognition motif on the Kunitz-BPTI fold. J Biol Chem, 2002, 277(24): 21371−21378.
[9] Wang JH, Wu Y, Ren F, et al. Cloning and characterization of Adinbitor, a novel disintegrin from the snake venom of Agkistrodon halys brevicaudus stejneger. Acta Biochim Biophys Sin, 2004, 36(6): 425−429.王继红, 吴毓, 任凤, 等. 白眉蝮蛇去整合素 Adinbitor的分子克隆及其部分生物学活性. 生物化学与生物物理学报, 2004, 36(6): 425−429.
[10] Zhang PQ, Wang JH, Liu X, et al. Expression and bioactivity effects to Hela of recombinant toxin protein rLj-RGD3 from Lampetra japonica. Chin J Biotech, 2009, 25(5): 686−694.张丕桥, 王继红, 刘欣, 等. 重组七鳃鳗细胞毒素蛋白rLj-RGD3表达及对Hela细胞活性的影响. 生物工程学报, 2009, 25(5): 686−694.
[11] Blank M, Shoenfeld Y. Histidine-rich glycoprotein modulation of immune/autoimmune, vascular, and coagulation systems. Clin Rev Allergy Immunol, 2008, 34(3): 307−312.
[12] Sambrook J, Fritsch EF, Maniatis T. Molecular Cloning: A Laboratory Manual. 2nd ed. New York: Cold Spring Harbor Laboratory Press, 1989.
[13] Xiao R, Li QW, Perrett S, et al. Characterisation of the fibrinogenolytic properties of the buccal gland secretion from Lampetra japonica. Biochimie, 2007, 89(3): 383−392.
[14] Chi S, Xiao R, Li QW, et al. Suppression of neuronal excitability by the secretion of the lamprey (Lampetra japonica) provides a mechanism for its evolutionary stability. Pflugers Arch, 2009, 458(3): 537−545.
[15] Yeh CH, Peng HC, Yang RS, et al. Rhodostomin, a snake venom disintegrin, inhibits angiogenesis elicited by basic fibroblast growth factor and suppresses tumor growth by a selective alpha (v) beta (3) blockade of endothelial cells. Mol Pharmacol, 2001, 59(5): 1333−1342.
[16] Kang IC, Lee YD, Kim DS. A novel disintegrin salmosin inhibits tumor angiogenesis. Cancer Res, 1999, 59(15): 3754−3760.
[17] Fernandez JH, Silva CA, Assakura MT, et al. Molecular cloning, functional expression, and molecular modeling of bothrostatin, a new highly active disintegrin from Bothrops jararaca venom. Biochem Biophys Res Commun, 2005, 329(2): 457−464.
[18] Vanwildemeersch M, Olsson AK, Gottfridsson E, et al. The anti-angiogenic His/Pro-rich fragment of histidinerich glycoprotein binds to endothelial cell heparan sulfate in a Zn2+-dependent manner. J Biol Chem, 2006, 281(15): 10298−10304.
[19] Juarez JC, Guan X, Shipulina NV, et al. Histidineproline-rich glycoprotein has potent antiangiogenic activity mediated through the histidine-proline-rich domain. Cancer Res, 2002, 62(18): 5344−5350.
[20] Lee C, Dixelius J, Thulin A, et al. Signal transduction in endothelial cells by the angiogenesis inhibitor histidine-rich glycoprotein targets focal adhesions. Exp Cell Res, 2006, 312(13): 2547−2556.
[21] Lee C, Bongcam-Rudloff E, Sollner C, et al. Type 3 cystatins; fetuins, kininogen and histidine-rich glycoprotein. Front Biosci, 2009, 14: 2911−2922.
[22] Auguste P, Lemiere S, Larrieu-Lahargue F, et al. Molecular mechanisms of tumor vascularization. Crit Rev Oncol Hematol, 2005, 54(1): 53−61.
