基于硫醇自组装的肌红蛋白单克隆抗体金膜固相载体的构建
2011-02-09雷博曲炳郡杨华张向颖刘芳
雷博,曲炳郡,杨华,张向颖,刘芳
1 清华大学微电子学研究所,北京 100084
2 北京市肝病研究所,北京 100069
心肌梗塞发病死亡率高,严重危害身体健康。肌红蛋白 (Mb) 是人体横纹肌组织所特有的一种蛋白质,在正常人血清的含量甚微,约为60 µg/L。当心肌和骨骼肌受损时,从受损的肌细胞释放出来,浓度升高。研究表明,心肌梗塞患者的血清 Mb浓度在发病早期 (6~24 h) 达到100~300 µg/L,在发病后期 (48 h后) Mb浓度下降到60 µg/L[1]。大量的临床实验表明,Mb作为心肌梗塞的早期诊断指标,具有较高的灵敏度,但由于骨骼肌受损后 Mb浓度同样会升高,故特异性不强,Mb与其他指标 (cTnI、CK-MB) 联合,可提高心肌梗塞诊断的特异性[2-3]。
检测 Mb的方法主要有酶联免疫法 (ELISA)、荧光标记法、化学发光法等。这些方法依靠体积庞大、价格昂贵的光学检测系统;检测时间长,需要数小时以上;由于存在人工操作,批内和批间差异显著。这些因素限制了心肌梗塞早期诊断的快速、高效和准确进行。近年来,一种新型的磁电阻生物传感器成为研究热点,这种传感器通过在生物分子上标记磁球,用磁传感器来间接检测生物分子。由于应用了微流体技术、磁电子技术、微加工技术和生物技术,该传感器的灵敏度可达到 pg/L水平、样本体积仅为几个 µL,检测时间缩短到半小时以内、全程操作自动化,比传统的检测方法有重大提高。美国的海军实验室、斯坦福大学,以及中国的清华大学、电子科技大学等国内外机构开展了此项研究[4-8]。这种生物传感器有望应用于心肌梗塞早期诊断,显著提高诊断水平。
将抗体固定在载体表面是实现传感器对抗原检测的关键一步,现有固定方法分为物理吸附法和化学偶联法[9]。物理吸附法利用载体和抗体之间的电荷作用、疏水作用、范德华力等作用将抗体固定在载体上。目前广泛采用的 ELISA、荧光标记等方法都是使用物理吸附法,但存在抗体吸附不牢固、非特异性等问题。化学偶联法通过化学键将抗体固定在载体上,在固定前需要通过化学方法修饰载体,常见的修饰试剂有戊二醛、琼脂糖、硫醇和聚赖氨酸等[10-12]。化学偶联法比物理吸附法能固定的抗体多并且牢固,有可能大大提高检测灵敏度,且大大减少了因物理吸附而导致的非特异反应,因而有更好的特异性。本研究采用了化学偶联的方法。
自组装膜具有分子生长致密度高、生长条件简单的特点,已应用于抗体在生物传感器表面的固定。硫原子和贵金属 (如Au、Ag和Pt) 具有很强的相互作用力,各种含硫分子,如二硫化物 (R-SS-R)、硫化物和硫醇类,可在贵金属表面形成高度有序且密切排列的自组装膜[13-17]。
本研究室前期已经制备了磁电阻生物传感器的芯片[8],传感器的表面是一层金膜,厚度为60 nm,需要进一步研究如何将肌红蛋白抗体 (MbAb) 偶联在传感器表面。文献[18]报道了在磁电阻生物传感器上利用硫醇自组装固定抗体的方法,但没有对固定过程进行优化。本研究着重于固定过程的优化,用硫醇自组装的方法构建 Mb单克隆抗体的金膜固相载体,借助辣根过氧化物酶 (HRP) 标记的IgG和BCA试剂盒测定偶联在固相载体上的MbAb量和偶联效率,并测定已偶联抗体的载体对不同浓度抗原的免疫活性。
1 材料与方法
1.1 试剂和仪器
Mb抗原 (MbAg)、MbAb (Hytest公司),HRP标记山羊抗小鼠IgG、HRP标记山羊抗人IgG (鼎国昌盛生物技术公司),牛血清白蛋白 (BSA) (Roche公司),巯基11酸 (化学式C11H22O2S)、巯基16酸(化学式C16H32O2S)、巯基11醇 (化学式C11H24OS) (Sigma公司),显色液 (万泰生物药业公司),BCA试剂盒 (博奥森生物技术公司),其余试剂 (国产,分析纯),酶标板 (Costar公司),酶标仪Model 680 (BIO-RAD公司),清华大学物理系 NanoScope Ⅲ型原子力显微镜 (AFM),清华大学分析中心 PHI Quantera SXM型X射线光电子能谱仪 (XPS),清华-富士康纳米中心蒸发仪。
1.2 MbAb金膜载体的制备
1.2.1 金膜载体制备
4英寸硅片蒸发薄膜Cr (10 nm)/Au (60 nm),切割成4 mm×4 mm的正方形。依次用无水乙醇和去离子水超声清洗5 min。
1.2.2 金膜载体生长硫醇自组装膜
用无水乙醇配置羧基硫醇 (巯基11酸或巯基16酸) 和羟基硫醇 (巯基 11醇) 一定浓度的混合溶液。将金膜硅片放入酶标孔中,每孔加入100 µL溶液,置于烘箱 (温度可设)、室温 (25 ℃) 或冰箱(−20 ℃或4 ℃) 中,一定时间后取出,再依次用无水乙醇、乙酸/无水乙醇 (10%,V/V)、无水乙醇漂洗。硫醇的硫原子和金膜的金原子形成金/硫共价键,硫醇分子的羧基和羟基裸露在另一端,形成一层混合自组装膜。
1.2.3 硫醇自组装膜的AFM和XPS分析
已生长硫醇自组装膜的金膜硅片在 AFM 和XPS下观测。AFM的观察范围为1 µm×1 µm,使用敲击模式。XPS分析全谱和硫元素的S2p谱。
1.2.4 金膜载体羧基活化
加入EDC·HCl的乙磺酸 (MES) (0.1 mol/L,pH 6.0) 溶液,EDC·HCl的浓度为4 g/L,避光,室温水浴反应30 min,用磷酸盐缓冲溶液 (PBS,0.01 mol/L,pH 7.4) 洗 5次。硫醇的羧基和EDC·HCl发生反应。
1.2.5 抗体偶联和偶联效率的测定
加入一定浓度的MbAb的PBS溶液,室温水浴反应一定时间。反应结束后吸取剩余液体,用已知浓度的MbAb作为标准液,加入BCA工作液,用酶标仪测量OD562值,计算偶联效率。计算公式如下:

1.2.6 金膜载体封闭
加入BSA浓度为5 g/L的PBS溶液,37 ℃水浴1 h,用磷酸盐吐温 (PBST) 溶液 (PBS溶液加入0.5% Tween-20,V/V) 洗5次。
1.2.7 抗体偶联量的测定
加入工作浓度的HRP标记的山羊抗小鼠IgG,37 ℃水浴反应1 h,PBST洗5次,加入TMB底物显色8 min,以2 mol/L H2SO4终止反应,在450 nm波长处测量OD值。以未固定MbAb的金膜硅片作为阴性对照。
1.2.8 偶联抗体免疫活性测定
将一定浓度的MbAb偶联在金膜硅片上,放入已封闭的酶标孔中,配置 7组浓度的肌红蛋白抗原溶液 (30、75、120、165、210、255、300 µg/L),作为阳性对照,PBS溶液作为阴性对照,37 ℃水浴反应1 h,PBST洗5次,加入工作浓度的HRP标记的山羊抗人IgG,37 ℃水浴反应1 h,加入TMB底物显色8 min,以2 mol/L H2SO4终止反应,在450 nm波长处测量OD值。
1.2.9 统计学方法
全部数据经过SPSS 11.5统计软件分析,差异的显著性用线性回归分析检验,P<0.05为差异有统计学意义。
2 结果
MbAb在金膜载体上固定的反应过程如图 1所示,包括硫醇自组装、EDC活化和抗体偶联3个步骤。硫醇的生长温度、浓度、生长时间、硫醇种类;MbAb浓度和MbAb的偶联时间等因素影响MbAb的固定效果。
2.1 硫醇生长温度的影响
不同硫醇生长温度的抗体偶联量见图 2。R=0.910,P=0.004<0.05,差异有统计学意义。固定在金膜载体上的MbAb数量随温度升高先增大后减小,在80 ℃达到峰值。
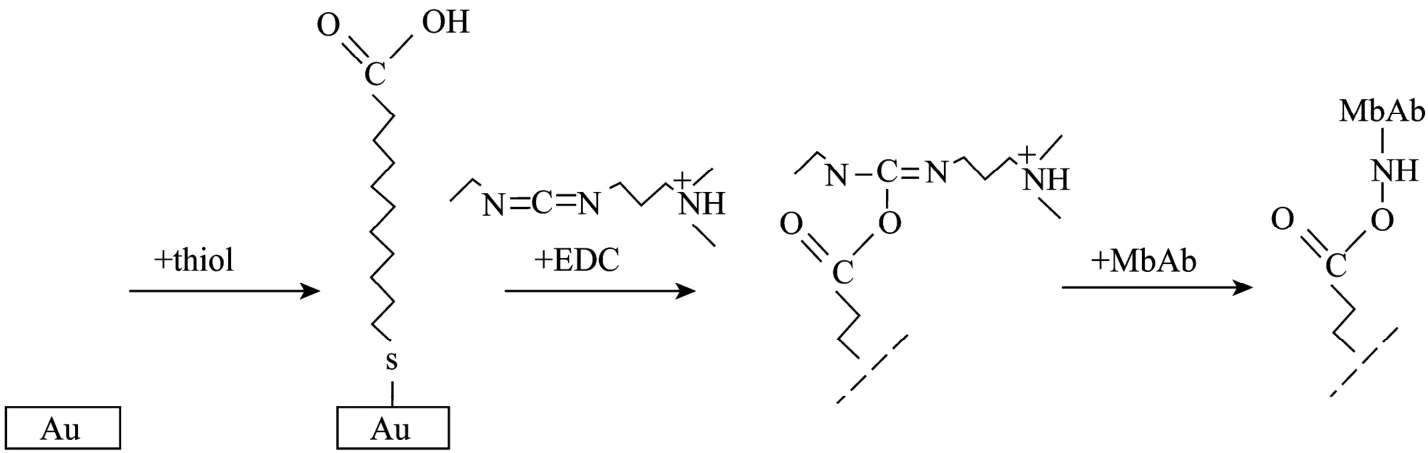
图1 金膜上固定MbAb的化学反应过程Fig. 1 Chemical reaction process of immobilizing MbAb on gold.
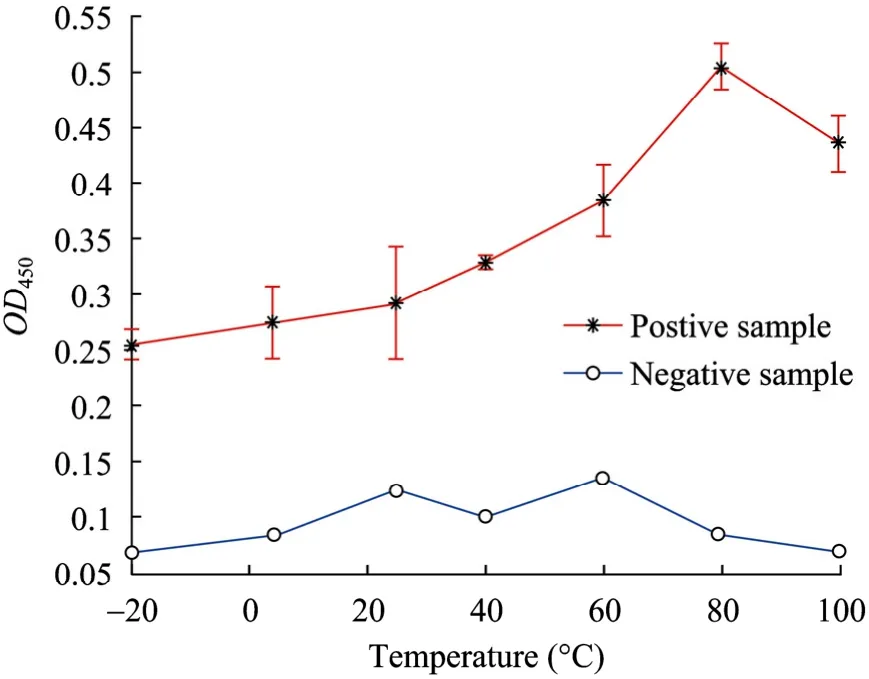
图2 不同硫醇生长温度的抗体偶联量Fig. 2 Antibody immobilized quantity at different growing temperature of thiol.
2.2 硫醇种类的影响
4组溶液:①巯基11酸;②巯基16酸;③巯基11酸和巯基11醇;④巯基16酸和巯基11醇。①②的硫醇浓度为0.5 mmol/L,③④的两种混合硫醇的浓度均为0.5 mmol/L。表1表明,巯基16酸和巯基11醇作为硫醇溶液时,固定的MbAb抗体量最大。
2.3 硫醇浓度的影响
以50 mmol/L的巯基16酸和巯基11醇为起始浓度,5倍连续稀释,分为7组。图3表明,硫醇浓度增大,固定的MbAb数量增大,后续实验选择50 mmol/L的硫醇浓度。R=0.919,P=0.003<0.05,差异有统计学意义。
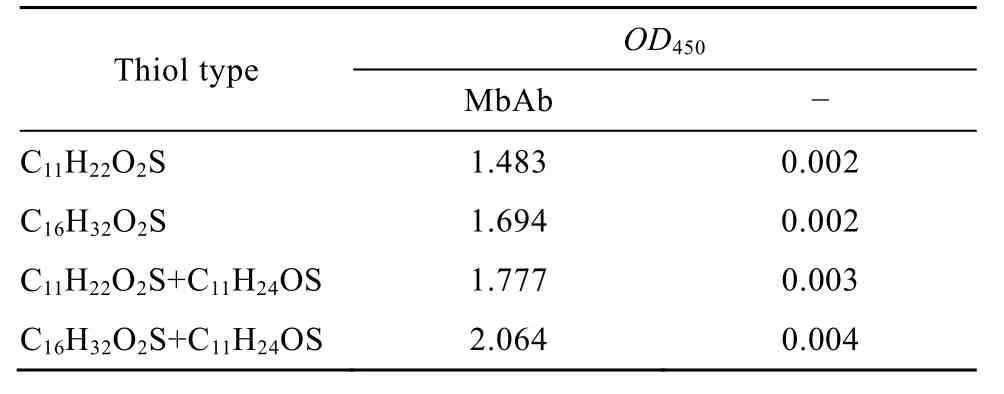
表1 硫醇种类对MbAb固定的影响Table 1 Effect of thiol type on MbAb immobilization

图3 不同硫醇浓度的抗体偶联量Fig. 3 Antibody immobilized quantity at different thiol concentration.
2.4 硫醇生长时间影响
图4表明,偶联效率在1~3 h增加较快,在3~12 h增加较慢,故选择3 h作为硫醇的生长时间。R=0.849,P=0.151>0.05,差异没有统计学意义。
2.5 待偶联的抗体浓度的影响

图4 不同硫醇生长时间的偶联效率Fig. 4 Coupling efficiency at different thiol growing time.

图5 不同待偶联抗体浓度对偶联的影响Fig. 5 Effect of coupling at different antibody concentration.
图5表明,偶联效率随着待偶联的抗体浓度增大而减少;已偶联的抗体浓度随着待偶联的抗体浓度增大先增大再减小,在60~80 mg/L达到峰值。图 5的偶联效率的统计分析表明,R=0.930,P=0.007<0.05,差异有统计学意义。
2.6 抗体偶联时间的影响
图6表明,偶联效率在 1~3 h增加很快,在3~15 h增加缓慢。选择优化后的偶联时间为3 h。R=0.675,P=0.325>0.05,差异没有统计学意义。
2.7 硫醇自组装膜的AFM分析结果
2.2 节中的②和④两组硫醇自组装膜 (未固定MbAb) 在AFM下观察,结果如图7所示。从截面图看,两种硫醇混合物 (巯基16酸和巯基11醇) 的自组装膜的平整度优于一种硫醇 (巯基16酸) 的自组装膜的平整度。
2.8 硫醇自组装膜的XPS分析结果
图8是巯基11酸自组装膜的金膜载体的XPS分析结果。溶液浓度为 0.5 mmol/L,反应温度为60 ℃,反应时间为3 h,尚未固定MbAb。硫元素在碳、氧、硫三种元素的原子数的百分含量为6.14%,根据巯基11酸的化学式计算,硫原子数的百分含量为7.14%,二者接近,说明金膜表面结合有巯基11酸。S2p谱表现为单峰曲线。
2.9 金膜载体上MbAb的免疫活性测定
图9是优化实验条件后的金膜载体上的 MbAb的免疫活性测定结果。在血清 Mb浓度为正常值(30~75 µg/L) 和异常值 (100~300 µg/L) 时,载体都有较好的免疫反应。线性回归分析表明,R=0.985,P<0.01,差异有统计学意义。测定表明,偶联效率平均值为31.4%,标准差为7.3%。

图6 不同偶联时间的偶联效率Fig. 6 Coupling efficiency at different coupling time.
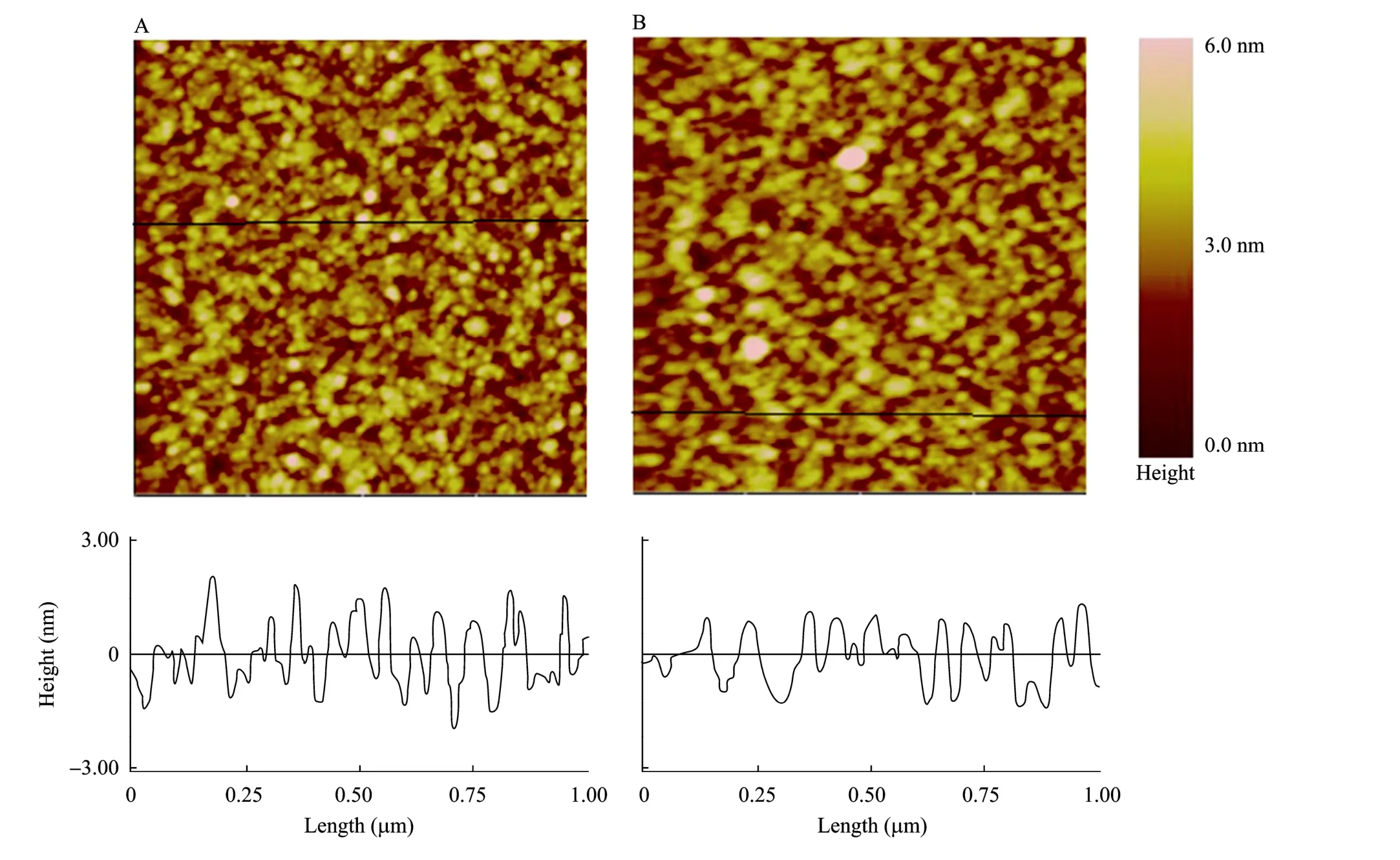
图7 硫醇自组装膜的原子力显微镜观察结果Fig. 7 Atomic force microscopy observation of thiol SAMs. The upper figures are the top view. The lower figures are the section view. (A) Observation result of homogeneous thiol (mercapto hexadecanoic acid, C16H32O2S). (B) Observation result of mixed thiol (mercapto hexadecanoic acid C16H32O2S and mercapto undecanol C11H24OS).
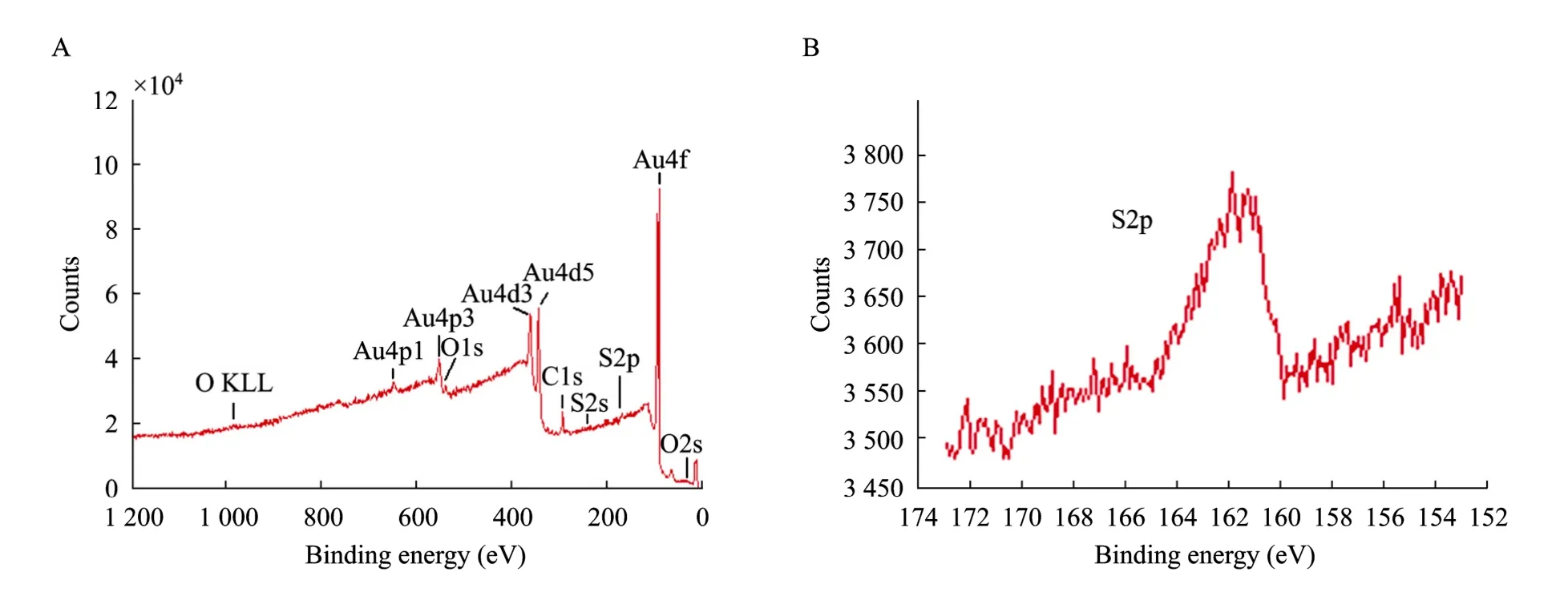
图8 硫醇 (巯基11酸) 自组装膜的X射线光电子能谱观察结果Fig. 8 X-ray photoelectron spectroscopy observation of thiol SAMs of mecapto undercanoic acid (C11H22O2S). (A) The whole energy spectrum of the sample. (B) The subtle energy spectrum S2p of sulfur element of the sample.

图9 偶联 MbAb的金膜载体对不同浓度抗原的免疫活性Fig. 9 Immunocompetence of MbAb immobilized on gold film for antigen of different concentration.
3 讨论
硫醇生长温度实验表明,80 ℃是硫醇自组装膜生长的最佳温度,但 80 ℃时溶剂乙醇蒸发速度加快,导致在自组装膜生长完成前溶剂乙醇已经蒸发完毕,并且高温可能损坏传感器,故在后续实验中选择60 ℃作为硫醇自组装膜的生长温度。
温度影响硫醇自组装膜生长,其机理解释如下:硫醇分子在金膜表面有金/硫共价键形成、断裂;物理吸附和物理解吸附 4个子过程,这 4个子过程共同决定了自组装膜的密度,不同温度范围起决定作用的子过程不同。Chandekar等[19]研究了巯基16酸/金自组装膜的热稳定性,将生长好的自组装膜样品放置在25 ℃ ~240℃的真空加热箱中。结果表明,110 ℃时,部分金硫键发生断裂,但物理解吸附作用微弱,金/硫键可能再次成键;超过150 ℃后,大部分金/硫键断裂,同时物理解吸附作用增强,金硫键断裂后无法再次成键,150 ℃是巯基16酸/金自组装膜稳定的极限温度。本文的研究结果 (图2) 表明,100 ℃时比80 ℃时偶联在金膜载体上的抗体量减小,高温导致自组装膜金/硫共价键断裂,这与文献[19]结果一致。Li等[14]研究结果表明,70 ℃时,硫醇/金自组装膜的致密度比−18 ℃和22 ℃更高,更多的蛋白质被固定。综上所述,在较低温度范围 (−20 ℃~80 ℃),硫原子和金原子随着温度升高,内能增大而成键几率增大,成键过程起主要作用,自组装膜密度增大;而在高温范围 (80 ℃ ~240℃),金/硫共价键断裂起主要作用,自组装膜密度减小。
硫醇种类实验表明,巯基酸和巯基醇的混合溶液固定抗体的效果好于单一巯基酸溶液的固定效果;巯基16酸的固定效果好于巯基11酸的固定效果。故选择巯基16酸和巯基11醇作为组合。
硫醇种类影响抗体固定效果从本质上是因为硫醇分子的官能团和碳链长度的影响。含羟基和羧基官能团的混合硫醇,羧基电离后,裸露的氧原子会争夺羟基的氢原子,形成氢键,因此,含羟基硫醇的自组装膜的结构排布更有序,更容易在EDC的催化下和抗体反应。Nikin等[15]认为,混合硫醇比单一硫醇有更好的固定效果,是由于混合硫醇的输水性作用更强。文献[17]表明,混合硫醇的两种分子数比为1∶1时,自组装膜的致密度最高,固定的蛋白质最多。另一方面,当硫醇分子的碳链增长时,更多的硫醇分子的碳链保持直立状态[14],末端羧基暴露在外部,和EDC的反应几率增大。
待偶联的抗体浓度实验表明,偶联效率随待偶联的抗体浓度的增大而降低 (图 5),这是因为金膜表面的硫醇密度有限,所能固定的抗体量有限;另一个原因是抗体溶液浓度增大,溶液中的抗体分子撞击已偶联的抗体分子,破坏酰胺键,导致偶联失效。在10~80 mg/L的范围内,抗体浓度增大,接近所能固定的抗体量的极限。抗体浓度为100 mg/L时比80 mg/L时固定的抗体量减小,可能因为抗体分子的撞击作用进一步增强,导致所能固定的抗体量进一步下降。虽然80 mg/L时固定的MbAb数量最大,但考虑到试剂成本因素,选择优化后的浓度为40 mg/L。
对硫醇自组装膜的XPS分析表明,硫元素的S2p能谱只有一个峰,这和参考文献[14]中硫元素的 S2p能谱一致。如果有2个峰出现,则有部分硫醇分子物理吸附在金膜表面,不是共价键结合。
含羧基的硫醇分子在EDC的催化下,和抗体的赖氨酸残基 (含氨基) 发生反应,将抗体固定在金膜表面,反应位点决定于抗体的赖氨酸残基的位置。文献报道[11-12],聚赖氨酸和戊二醛对蛋白质的偶联效率高于硫醇,这是由于聚赖氨酸有双官能团 (氨基和羧基),而戊二醛有2个醛基,都可以和抗体发生偶联。Xie等[20]报道了戊二醛作为偶联剂在氨基化玻璃上偶联丙肝单克隆抗体,偶联效率达到85%。然而,硫醇偶联的抗体的反应活性高于聚赖氨酸和戊二醛[12],即抗体的反应活性较高,这可能与偶联试剂的分子结构不同有关,更长的碳链有利于抗体和抗原结合。
抗体固定在金膜固相载体上后,需要加入封闭剂,以封闭已经活化而未偶联抗体的羧基,减少非特异性反应,降低假阳性率。封闭液通常用含赖氨酸较多的封闭剂,选用5 g/L的BSA溶液。
总之,本研究通过硫醇自组装的方法构建了肌红蛋白单克隆抗体的金膜固相载体,优化了实验条件,测定了偶联抗体的免疫活性,对于面向心肌梗塞诊断的磁电阻生物传感器的后续研究有重要参考价值。
REFERENCES
[1] He ZF, Liu YB, Lu CF, et al. Dynamic change of serum myogobin in acute myocardial infarction with animal and clinic experiment. J Jiamusi Med Coll, 1996, 19(6): 40−42.贺兆发, 刘云宝, 陆春风, 等. 急性心肌梗塞时血清肌红蛋白动态变化的动物及临床实验研究. 佳木斯医学院学报, 1996, 19(6): 40−42.
[2] Zhang YJ, Li MR, Gao XY, et al. Application of myoglobin and carbonic anhydrase in the early diagnosis of acute myocardial infarction. J Tianjin Med Univ, 2003, 9(2): 169−176.张艳君, 刘明润, 高向耘, 等. 血清肌红蛋白和碳酸酐酶测定在急性心肌梗塞早期诊断中的应用. 天津医科大学学报, 2003, 9(2): 169−176.
[3] Zhang YB, Shi JW. Significance of combined detection of cTnI, Mb and CK-MB in the diagnosis of acute myocardial infarction clinical. Shaanxi Med J, 2007, 36(3): 326−328.张玉碧, 史建伟. cTnI、Mb和CK-MB联合检测在急性心肌梗死诊断中的临床意义. 陕西医学杂志, 2007, 36(3): 326−328.
[4] Wu C, Lan ZW, Yu Z, et al. Research development of spin valve giant magnetic resistance biosensors with magnetic labels. Trans Mic Tech, 2007, 26(11): 31−34.吴畅, 兰中文, 余忠, 等. 磁标记自旋阀巨磁阻生物传感器的研究现状. 传感器与微系统, 2007, 26(11): 31−34.
[5] Gaster RS, Hall DA, Nielsen CH, et al. Matrix-insensitive protein assays push the limits of biosensors in medicine. Nat Med, 2009, 15(11): 1327−1333.
[6] Mark AC, Osterfeld SJ, Yu H, et al. Sensitive giant magnetoresistive-based immunoassay for multiplex mycotoxin detection. Biosens Bioelectron, 2010, 25(7): 1635−1639.
[7] Koets M, van der Wijk T, van Eemeren JTWM, et al. Rapid DNA multi-analyte immunoassay on a magneto-resistance biosensor. Biosens Bioelectron, 2009, 24(7): 1893−1898.
[8] Zhang CQ, Zhou F, Qu BJ, et al. Study of a novel biosensor based on GMR effect. Mic Tech, 2007, 44(7): 373−375.张超奇, 周非, 曲炳郡, 等. 基于GMR效应的新型生物传感器研究. 微纳电子技术, 2007, 44(7): 373−375.
[9] Guilleaume B, Buneβ A, Schmidt C, et al. Systematic comparison of surface coatings for protein microarrays. Proteomics, 2005, 5(18): 4705−4712.
[10] Yan JF, Wu M, Cheng H, et al. Technology advances in construction process of antibody immobilization of antibody microarray. Chin J Cell Mol Immunol, 2007, 23(7): 684−686.闫静辉, 吴萌, 程华, 等. 抗体微阵列构建过程中抗体定位固定技术研究进展. 细胞与分子免疫学杂志, 2007, 23(7): 684−686.
[11] Zhou WW, Lian J, Hu KJ, et al. Effect of surface chemical properties of a silicon chip on antibody immobilization. Acta Phys Chim Sin, 2010, 26(10): 2821−2827.周稳稳, 廉洁, 胡科家, 等. 硅基芯片表面化学性质对蛋白质固定化的影响. 物理化学学报, 2010, 26(10): 2821−2827.
[12] Zhang CX, Mei Q, Gu Y, et al. Surface modifications of glass slides used for protein microarray. Chin J Lab Med, 2003, 26(4): 219−221.张春秀, 梅茜, 顾莹, 等. 制备蛋白质芯片的玻璃表面修饰方法比较. 中华检验医学杂志, 2003, 26(4): 219−221.
[13] Choi S, Yang YM, Chae J. Surface plasmon resonance protein sensor using Vorman effect. Biosens Bioelectron, 2008, 24(4): 893−899.
[14] Li LY, Chen SF, Jiang SY. Protein adsorption on alkanethiolate self-assembled monalayers: nanoscale surface structural and chemical effects. Langmuir, 2003, 19(7): 2974−2982.
[15] Nikin P, Martyn CD, Mark H, et al. Immobilization of protein molecules onto homogeneous and mixed carboxylate-terminated self-assembled monolayers. Langmuir, 1997, 13(24): 6485−6490.
[16] Millone MAD, Hamoudi H, Rodríguez L, et al. Self-assembly of alkanedithiols on Au(111) from solution: effect of chain length and self-assembly conditions. Langmuir, 2009, 25(22): 12945−12953.
[17] Qian T, Xu CH, Shi SQ, et al. Formation and characterization of protein patterns on the surfaces with different properties. Syn Met, 2004, 147(1/3): 247−252.
[18] de Palma R, Reekmans G, Liu CX, et al. Magnetic bead sensing platform for the detection of proteins. Anal Chem, 2007, 79(22): 8669−8677.
[19] Chandekar A, Sengupta SK, Whitten JE. Thermal stability of thiol and silane monolayers: a comparative study. Appl Surf Sci, 2010, 256(9): 2742−2749.
[20] Xie L, Guan YP, Ge Y, et al. Preparation and properties of SiO2tubes immobilized antibody for HCAg detection. Chin J Biotech, 2010, 26(4): 545−549.谢立, 官月平, 戈莹, 等. 用于丙型肝炎病毒抗原测定的SiO2载体的制备及其性质分析. 生物工程学报, 2010, 26(4): 545−549.
