可溶性人类白细胞抗原F和分化簇8α同二聚体的表达、纯化与相互作用
2011-02-09罗开华樊峥李宏滨刘一苇
罗开华,樊峥,李宏滨,刘一苇
中国科学院微生物研究所,北京 100101
主要组织相容性抗原复合物Ⅰ类分子 (Major histocompatibility complex class Ⅰ,MHC Ⅰ) 分为典型 MHC Ⅰ类分子 (MHC Ⅰa) 和非典型MHC Ⅰ类分子 (MHC Ⅰb)[1-2]。MHC Ⅰa分子表达在大多数体细胞表面,它们将抗原多肽呈递给 T细胞参与天然免疫反应。MHC Ⅰb分子的功能与免疫调节相关,主要通过与免疫抑制受体的相互作用来调节T细胞活性。在人体中,MHC Ⅰb主要分为3类基因:HLA-E、HLA-F和HLA-G[3-5]。
HLA-E在机体组织中广泛表达,它结合的多肽大部分来自其他MHC分子的前导序列。HLA-E通过与NK细胞和T细胞亚群表面表达的CD94/NKG2受体相互作用产生免疫抑制效应[6-10]。HLA-G 是一种在母婴绒毛膜外滋养层细胞 (EVTs) 表面大量表达的基因,它通过与免疫细胞表面表达的免疫球蛋白样转录分子2 (Immunoglobulin-like transcript 2,ILT2) 和ILT4抑制受体相互作用从而诱导母婴免疫耐受[11-13]。与其他的 MHC Ⅰ类分子相比,HLA-F基因在灵长类动物中是高度保守的,因此 HLA-F可能在免疫系统中具有重要功能[14-15]。绝大多数MHCⅠ类分子与 β2-微球蛋白 (β2-microglobulin,β2m) 和抗原多肽形成 MHC∶β2m∶多肽的三元复合物,抗原多肽是T细胞受体 (T cell receptor,TCR)的结合识别部位,特异的抗原多肽将诱导特异性免疫反应。HLA-F与β2m形成一个二元复合物,并不结合抗原多肽,因此HLA-F不能引起T细胞针对特定抗原的免疫反应[16-17]。虽然 HLA-F被证明与ILT2、ILT4和开放构象的MHC具有相互作用,但其功能仍然未被完全阐明[18]。
CD8α的二元复合物CD8αα是免疫共受体分子,MHC Ⅰ类分子只有同时结合TCR和CD8αα才能激活 T细胞产生免疫反应[19]。MHC Ⅰ类分子的三元复合物能够与CD8αα结合,而HLA-F是否与CD8αα相互作用尚未见文献报道。本研究对HLA-F和CD8α基因序列进行同义突变,重组后的基因以蛋白包涵体形式表达,通过稀释法复性后用凝胶过滤层析和离子交换法纯化,通过凝胶过滤层析和Native-PAGE研究HLA-F与CD8αα相互作用。
1 材料与方法
1.1 N端序列突变及突变序列扩增
从质粒载体中扩增出不含信号序列和跨膜结构域的HLA-F序列 (成熟蛋白1-280aa) 和CD8α (成熟蛋白1-114aa) 及全长β2m序列。携带HLA-F基因全序列的 pOTB7载体和含全序列的 β2m、CD8α的pCMV-SPORT6质粒购于Proteintech公司。预实验结果表明,直接将HLA-F与CD8α编码序列重组进入pET21a (Invitrogen,美国) 质粒无法获得目的蛋白的大量表达。分析发现HLA-F和CD8α序列的N端编码区含有大肠杆菌稀有密码子。稀有密码子对大肠杆菌表达具有重要影响,突变稀有密码子能显著提高外源蛋白的表达水平[20]。按图1所示,设计N端同义突变引物,PCR扩增出突变序列,将突变后的序列重组到pET21a质粒中,筛选阳性克隆并测序。
1.2 目的蛋白的表达及细胞破碎
分别将携带HLA-F、CD8α及β2m的pET21a质粒转化大肠杆菌 BL21感受态细胞。挑取平板上的单菌落接种于5 mL含氨苄青霉素 (Amp) 的LB 培养基中,过夜培养后接种于500 mL含Amp的LB进行摇瓶培养,37 ℃振荡3 h后加入IPTG (德国,Merck) 至终浓度为0.001 mol/L,诱导表达15 h后取样,SDS-PAGE 检测。4 000 r/min离心10 min收集菌体,超声破碎后 12 000 r/min离心 10 min,SDS-PAGE检测目的蛋白表达量及在上清和沉淀中的分布。

图1 CD8α和HLA-F基因N端突变前后序列比对结果Fig. 1 Sequences alignment figure of CD8α and HLA-F with their N terminal mutation.
1.3 包涵体的提取与溶解
SDS-PAGE检测发现目的蛋白均以包涵体形式表达。分别将 HLA-F、CD8α及 β2m诱导表达后的菌液4 000 r/min离心10 min收集菌体,加入50 mL PBS (pH 7.4,137 mmol/L NaCl,2.7 mmol/L KCl,4.3 mmol/L Na2HPO4,1.4 mmol/L KH2PO4) 吹打重悬离心沉淀物。超声破碎 (400 W 100次),12 000 r/min离心 10 min收集沉淀。用包涵体洗涤液 (0.5% Triton-100,50 mmol/L Tris (pH 8.0),300 mmol/L NaCl,10 mmol/L EDTA,10 mmol/L二硫苏糖醇) 反复洗涤纯化颗粒沉淀物。称量包涵体沉淀,用包涵体溶解液溶解沉淀 (pH 8.0,6 mol/L盐酸胍,10%甘油,50 mmol/L Tris,100 mmol/L NaCl,10 mmol/L EDTA,10 mmol/L二硫苏糖醇) 使包涵体蛋白浓度达到30 g/L。SDS-PAGE检测和分析提取的包涵体蛋白。
1.4 包涵体蛋白复性
溶解的HLA-F、β2m和CD8α包涵体蛋白分别采用稀释法复性。把120 mg β2m滴入500 mL复性缓冲液 (pH 8.0,400 mmol/L L-精氨酸,100 mmol/L Tris,2 mmol/L EDTA,0.5 mmol/L氧化型谷胱甘肽,5 mmol/L 还原型谷胱甘肽),4 ℃搅拌1 h后滴入360 mg的HLA-F。搅拌12 h后静置24 h,将复性液用切向流系统 (Millipore,法国) 浓缩,随后用截留分子量5 kDa的超滤离心管离心浓缩。
1.5 复性蛋白的纯化
浓缩后的蛋白复性缓冲液在超滤离心管中置换成分子筛缓冲液 (pH 8.0,10 mmol Tris,150 mmol NaCl,1 mmol/L EDTA)。换液后的HLA-F,CD8αα溶液分别经Superdex200凝胶层析柱 (GE,美国) 纯化。收集分离的蛋白在超滤离心管中浓缩后换成离子交换缓冲液 (10 mmol Tris) 通过Q XL离子交换层析柱 (GE,美国) 进一步纯化。
1.6 HLA-F与CD8αα相互作用
离子交换分离产物超滤浓缩后置换成分子筛缓冲液,凝胶过滤层析分别分析HLA-F和CD8αα。回收过滤产物浓缩至500 µL,将HLA-F和CD8αα混匀,静置15 min后用凝胶柱层析分析。HLA-F、CD8αα及HLA-F/CD8αα混合物凝胶过滤层析图采用UNICORN软件 (GE,美国) 分析和比较。将离子交换纯化浓缩后的 HLA-F和 CD8αα按1∶1比例混合静置 15 min,10% Native-PAGE (pH 8.8) 120 V电泳约 2.5 h,采用考马斯亮蓝对Native胶染色。
2 结果与分析
2.1 序列扩增及PCR突变结果
从质粒载体中成功扩增出 HLA-F (831 bp)、CD8α (342 bp)、β2m (300 bp) 片段。用突变引物扩增CD8α直接得到突变产物,HLA-F突变引物PCR出现了 3条条带,回收测序后发现分子量最大的条带是正确突变产物,将正确突变产物扩增后与突变PCR产物对比电泳如图2所示。
对PCR验证阳性克隆结果测序后发现目的基因序列成功重组进入pET21a质粒。
2.2 目的蛋白的成功表达
携带重组pET21a质粒的大肠杆菌BL21菌株经IPTG诱导后,目的蛋白得到成功表达。如图3所示,IPTG诱导前后目的蛋白表达量出现了显著变化。除β2m外HLA-F和CD8α在IPTG诱导前都无目的蛋白表达。
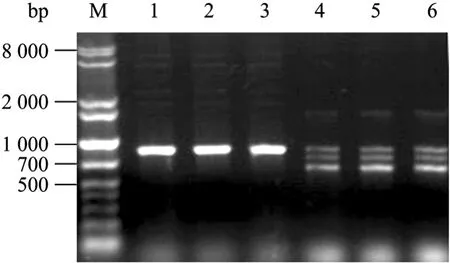
图2 HLA-F突变引物PCRFig. 2 The PCR amplification figure of HLA-F with mutated primer. First PCR amplified out three bands, correct sequence was amplified from longer sequence after sequencing. 1−3: correct sequence; 4−6: first step PCR result.
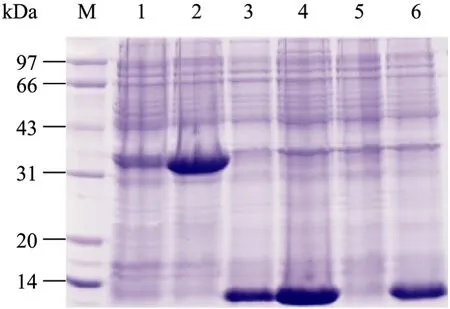
图3 IPTG诱导前后HLA-F、β2m和CD8α蛋白电泳图Fig. 3 The expression of HLA-F, CD8α and β2m were induced by IPTG. 1: HLA-F before IPTG added; 2: HLA-F after IPTG added; 3: β2m before IPTG added; 4: β2m after IPTG added; 5: CD8α before IPTG added; 6: CD8α after IPTG added.
2.3 包涵体蛋白的提取结果
包涵体蛋白电泳结果 (图 4) 显示成功提取了目的蛋白。由图中可以看出尽管经过了反复洗涤纯化,包涵体电泳条带仍含有大量的菌体蛋白。
2.4 HLA-F、CD8αα纯化及相互作用结果
分子筛纯化和离子交换纯化结果显示蛋白复性成功。如图5显示产物以单峰洗脱,SDS-PAGE也证明得到了纯度较高的HLA-F和CD8αα,其中左图33 kDa处为 HLA-F,11 kDa处为 β2m;右图为CD8αα,分子量为13 kDa。相对于HLA-F,CD8αα带电荷较少,在盐浓度较低条件洗脱。
HLA-F、CD8αα与HLA-F/CD8αα混合物凝胶过滤层析结果如图6所示。
如果HLA-F和CD8αα发生相互作用,则新形成的 HLA-F/CD8αα复合物在凝胶层析时保留时间将缩短。混合物的色谱图将会出现复合物色谱峰或者原来HLA-F色谱峰向左偏移,而柱上保留较长的CD8αα峰将不会出现明显的变化。以纯化的CD8αα和混合物中CD8αα峰的相对位置之差作为内参,第一个色谱峰相对于HLA-F的峰出现了0.5 mL的偏移。由此推测HLA-F与CD8αα可能具有相互作用。

图4 CD8α、HLA-F与β2m包涵体蛋白电泳图Fig. 4 The SDS-PAGE figure of CD8α, HLA-F and β2m inclusion body proteins. 1: CD8α iinclusion body; 2: HLA-F inclusion body; 3: β2m inclusion body.

图5 CD8αα与HLA-F的离子交换纯化结果Fig. 5 The purification of HLA-F and CD8αα. left: ion exchange figure of HLA-F; right: ion exchange figure of CD8αα.
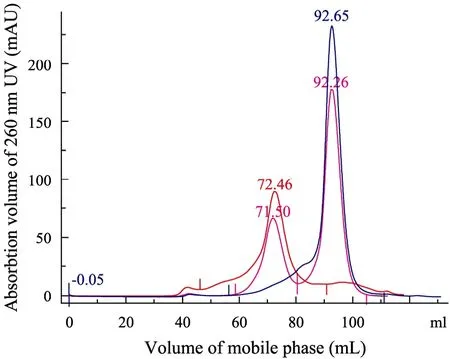
图6 HLA-F、CD8αα以及HLA-F/CD8αα凝胶过滤层析结果比较图Fig. 6 The Gel-Filtration figure of HLA-F, CD8αα and HLA-F/CD8αα. Peak 72.46 mL is of HLA-F; peak 92.65 mL is CD8αα; peak 71.50 mL and 92.26 mL are the peaks of HLA-F/ CD8αα mixture. CD8αα peak move from 92.65 mL to 92.26 mL while the HLA-F peak move from 72.46 mL to 71.50 mL. Taking CD8αα peak as internal reference, the retention time of HLA-F becomes shorter after mixed with CD8αα.
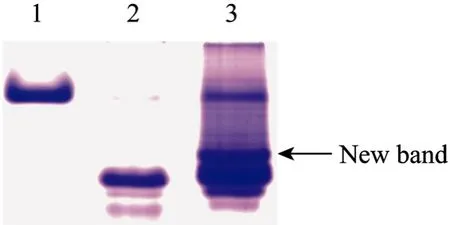
图7 HLA-F、CD8αα以及HLA-F/CD8αα的非变性蛋白电泳图Fig. 7 The Native-PAGE figure of CD8αα, HLA-F and CD8αα/HLA-F. Purified CD8αα and HLA-F were mixed at the ratio of 1:1. Native-PAGE was performed in 10% gel at pH 8.8. 1: CD8αα; 2: HLA-F; 3: mixture of CD8αα and HLA-F. There is a new band appear in mixture lane.
另外,通过Native-PAGE检测,进一步验证了上述推测。如图7所示,在pH 8.8 的Native胶上CD8αα所带电荷少,电泳速度较HLA-F慢,混合物在HLA-F与CD8αα条带之间位置处出现了新的条带。新出现的条带可能是由HLA-F与CD8αα相互作用产生的复合物。
3 讨论
稀有密码子对外源基因在大肠杆菌体的表达具有重大的影响,尤其是序列N端稀有密码子会抑制外源蛋白的表达。这可能由于核糖体无法在稀有密码子区域引发蛋白合成有关,也有可能与mRNA的二级结构有关[21]。这个特点可能是原核生物对外源核酸序列的一种自我保护机制。本实验对基因N端序列稀有密码子进行突变后显著提高了外源蛋白在大肠杆菌的表达水平。
溶解包涵体时,包涵体的溶解性与所用变性剂的强度具有十分显著的关系,之所以采用盐酸胍作为变性剂是因为之前的实验表明:尿素不能完全溶解CD8α包涵体,所得的包涵体溶解液混浊。盐酸胍变性能力较尿素强能够完全溶解包涵体沉淀。此外pH值和变性剂浓度对包涵体的溶解有较大影响[21]。同样,pH值对蛋白复性也有很大的影响。CD8α复性过程中需要严格控制pH,因为复性液的pH接近CD8α的等电点 (pI=8.43),浓缩和换液过程必须缓慢进行,溶液pH的快速变化容易导致复性蛋白发生絮凝和沉淀。
凝胶过滤层析分析HLA-F与CD8αα相互作用时,混合物的峰扣除了内参后偏移量不大。分析认为可能是由于superdex 200分子筛柱对4~7 kDa蛋白质分子的分辨率有限,故偏移的幅度较小。Native-PAGE胶图中,混合物电泳条带出现弥散,一方面是由于上样量偏大所致;另一方面可能由于蛋白结合是动态平衡的过程,复合物在电泳过程发生部分解离,解离的CD8αα移动变慢使复合物条带上方出现弥散。HLA-F条带变化也证明了这个推测,由复合条带十分靠近 HLA-F,解离的 HLA-F使HLA-F条带变浓。
HLA-F与其他MHC分子的关键不同点在于它与β2m形成二元复合物,MHC结合的多肽参与细胞免疫识别过程。抗原多肽被 T细胞受体 (TCR) 识别而引发特异的免疫反应,其中CD8αα参与该识别过程。本研究发现HLA-F与CD8αα可能具有相互作用,没有结合抗原多肽HLA-F与CD8αα发生相互作用必然会影响CD8αα与其他结合多肽的MHC分子的结合,从而影响抗原多肽的呈递。从本研究的实验结果推测HLA-F可能参与免疫T细胞TCR识别抗原的调节过程。此结论需要进一步深入研究和量化分析。
REFERENCES
[1] Geraghty DE, Koller BH, Orr HT. A human major histocompatibility complex class I gene that encodes a protein with a shortened cytoplasmic segment. Proc Natl Acad Sci USA, 1987, 84(24): 9145−9149.
[2] Pamer E, Cresswell P. Mechanisms of MHC class I-restricted antigen processing. Annu Rev Immunol, 1998, 16: 323−358.
[3] Bjorkman PJ, Parham P. Structure, function and diversity of class I major histocompatibility complex molecules. Annu Rev Biochem, 1990, 59: 253−288.
[4] Geraghty DE. Structure of the HLA class I region and expression of its resident genes. Curr Opin Immunol, 1993, 5(1): 3−7.
[5] O'Callaghan CA, Bell JI. Structure and function of the human MHC class Ib molecules HLA-E, HLA-F and HLA-G. Immunol Rev, 1998, 163(1): 129−138.
[6] Braud V, Jones EY, McMichael A. The human major histocompatibility complex class Ib molecule HLA-E binds signal sequence-derived peptides with primary anchor residues at positions 2 and 9. Eur J Immunol, 1997, 27(5): 1164−1169.
[7] Li J, Goldstein I, Glickman-Nir E, et al. Induction of TCR Vbeta-specific CD8+ CTLs by TCR Vbeta-derived peptides bound to HLA-E. J Immunol, 2001, 167(7): 3800−3808.
[8] Lee N, Goodlett DR, Ishitani A, et al. HLA-E surface expression depends on binding of TAP-dependent peptides derived from certain HLA class I signal sequences. J Immunol, 1998, 160(10): 4951−4960.
[9] Braud VM, Allan DSJ, O'Callaghan CA, et al. HLA-E binds to natural killer cell receptors CD94/NKG2A, B and C. Nature, 1998, 391(6669): 795−799.
[10] Lee N, Llano M, Carretero M, et al. HLA-E is a major ligand for the natural killer inhibitory receptor CD94/NKG2A. Proc Natl Acad Sci USA, 1998, 95(9): 5199−5204.
[11] Le Bouteiller P, Blaschitz A. The functionality of HLA-G is emerging. Immunol Rev, 1999, 167(1): 233−244.
[12] Rouas-Freiss N, Marchal RE, Kirszenbaum M, et al. The α1domain of HLA-G1 and HLA-G2 inhibits cytotoxicity induced by natural killer cells: is HLA-G the public ligand for natural killer cell inhibitory receptors? Proc Natl Acad Sci USA, 1997, 94(10): 5249−5254.
[13] Le Gal FA, Riteau B, Sdlick C, et al. HLA-G-mediated inhibition of antigen-specific cytotoxic T lymphocytes. Int Immunol, 1999, 11(8): 1351−1356.
[14] Shiina T, Tamiya G, Oka A, et al. Molecular dynamics of MHC genesis unraveled by sequence analysis of the 1,796,938-bp HLA class I region. Proc Natl Acad Sci USA, 1999, 96(23): 13282−13287.
[15] Geraghty DE, Wei XH, Orr HT, et al. Human leukocyte antigen F (HLA-F). An expressed HLA gene composed of a class I coding sequence linked to a novel transcribed repetitive element. J Exp Med, 1990, 171(1): 1−18.
[16] Wainwright SD, Biro PA, Holmes CH. HLA-F is a predominantly empty, intracellular, TAP-associated MHC class Ib protein with a restricted expression pattern. J Immunol, 2000, 164(1): 319−328.
[17] Goodridge JP, Burian A, Lee N, et al. HLA-F complex without peptide binds to MHC class I protein in the open conformer form. J Immunol, 2010, 184(11): 6199−6208.
[18] Lepin EJ, Bastin JM, Allan DS, et al. Functional characterization of HLA-F and binding of HLA-F tetramers to ILT2 and ILT4 receptors. Eur J Immunol, 2000, 30(12): 3552−3561.
[19] Cole1 DK and Gao GF. CD8: Adhesion molecule, co-receptor and immuno-modulator. Cell Mol Immunol, 2004, 1(2): 81−88.
[20] Shi CB, Lü AG, Wu WF, et al. SEA rare codon modified to improve protein expression. Chin J Biotech, 2002, 18(4): 477−480.时成波, 吕安国, 吴文芳, 等. 改造稀有密码子提高 SEA蛋白表达量. 生物工程学报, 2002, 18(4): 477−480.
[21] Liu LB, Liu Y, He HQ, et al. The Changes of rare codon and mRNA structure accelerate expression of qa-3 in Escherichia coli. Chin J Biotech, 2006, 22(2): 199−203.刘礼兵, 刘云, 何华庆, 等. qa-3稀有密码子和 mRNA结构改造及其在大肠杆菌中的高效表达. 生物工程学报, 2006, 22(2): 199−203.
