酿酒酵母Sup35朊蛋白结构域的自组装机理及其应用的研究进展
2011-02-09印文何进喻子牛王阶平
印文,何进,喻子牛,王阶平
华中农业大学农业微生物学国家重点实验室 微生物农药国家工程研究中心,武汉 430070
酿酒酵母Sup35朊蛋白结构域的自组装机理及其应用的研究进展
印文,何进,喻子牛,王阶平
华中农业大学农业微生物学国家重点实验室 微生物农药国家工程研究中心,武汉 430070
Sup35是酿酒酵母的翻译终止因子,其朊蛋白结构域在体内外都能形成淀粉样蛋白纤维。由于其高度有序的交叉β-片层构象与其他物种中的淀粉样蛋白纤维相似,因此,Sup35的分子自组装机理的研究可以作为蛋白质错误折叠性疾病及朊病毒生物学等相关研究的理想模型。而 Sup35朊蛋白结构域自组装成纳米线的能力在生物技术和纳米材料等方面已得到广泛的应用。
Sup35,朊蛋白结构域,自组装,酿酒酵母
真菌中的朊蛋白 (Prion) 是一类特殊的蛋白性传染因子 (Proteinaceus infection particle),它们在体内外都能形成淀粉样蛋白纤维。目前,在酿酒酵母Saccharomyces cerevisiae中发现且得到深入研究的朊蛋白有 Ure2p、Sup35p、Rnq1p、Swi1p和New1p[4],这些朊蛋白都能以非孟德尔方式在子细胞中遗传与传播,且对酿酒酵母的生理活动起到表观遗传学的调控作用[5]。Sup35p是目前研究最为深入的真菌朊蛋白,文中主要就最近几年有关Sup35朊蛋白结构域的自组装机理及其应用的研究进展进行叙述,而 Sup35朊蛋白的毒性、生理功能、遗传与传播等内容不在论述范围内。
1 Sup35的朊蛋白结构域
Sup35全长685个氨基酸,根据编码框内3个甲硫氨酸 (Met 1、124和254) 将其分为3部分:氨基端结构域 (N,1-123)、富含带电荷氨基酸的中部结构域 (M,234-253) 和羧基端结构域 (C,254-685)[6](图1A,1C)。在Sup35蛋白正确折叠时,其 C结构域可以执行翻译终止因子的功能;但在错误折叠后,Sup35蛋白聚集成淀粉样蛋白纤维,其C结构域的功能丧失,由NM结构域决定其朊蛋白行为[6]。
在Sup35的朊蛋白结构域 (NM) 中,N结构域是其形成朊蛋白的主要区域,M 结构域可能与Sup35的溶解度及保持其单体状态有关[7]。N结构域富含不带电荷的极性氨基酸,特别是谷氨酰胺(Gln) 和天冬酰胺 (Asn),包括有部分重叠的聚集(Aggregation) 和传播 (Propagation) 2个元件 (图1B)。聚集元件是Sup35的分子自组装和形成朊蛋白的关键区域。其中,7-13的GNNQQNY 7肽是Sup35的分子自组装的核心片段,该 7肽在体外就具有聚集成淀粉样蛋白纤维的能力,已被广泛用于研究朊蛋白的自组装机理[8-9]。传播元件包含5个重复序列 R1~R5,片段删除及点突变实验表明,这些重复序列与Sup35p朊蛋白在子细胞中的传播密切相关[10-11]。例如,R2中的第 1位甘氨酸 (G) 突变为天冬氨酸 (D) 后,突变体仍具有聚集能力,但在大多数菌株中不能有效地传播[11]。
2 Sup35朊蛋白结构域的自组装机理
2.1 自组装的基本过程
研究表明,Sup35p从头 (de novo) 自组装的基本过程包括:诱导、聚集、成核和成纤维等步骤,可划分为速度较慢的迟滞期及随后的快速组装期(图2A)。首先,Sup35的朊蛋白结构域 (NM) 快速从单体 (约占总 NM的 90%) 向寡聚体 (约 10%)转变 (图2A,step 1);在构象可变的寡聚体内,NM单体逐渐发生重排 (step 2) 并形成淀粉样寡聚体的中间体 (step 3);中间体快速转变为纤维构象,形成朊蛋白的核 (Seed/nucleus) (step 4);NM单体靠近朊蛋白核并转变构象,沿核的长轴向 2个方向不断延伸,从而形成具有交叉 β-片层构象的淀粉样蛋白纤维 (step 5)[12]。
2.2 单体的寡聚化
由单体到寡聚体是Sup35形成淀粉样蛋白纤维的早期限速步骤。天然的NM单体中,N结构域主要以被压缩的形式存在,而且其构象在多种多样的瞬时中间体之间快速转变 (时间为20~300 ns),而M结构域的构象较伸展;当只存在N结构域时,它们不经过迟滞期而立即组装成淀粉样纤维,表明带电荷的M结构域有利于N结构域维持单体状态[7]。
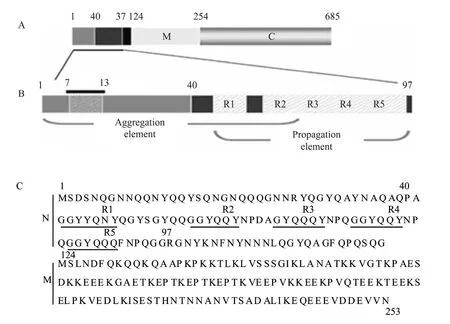
图1 Sup35及其朊蛋白结构域的组成[6]Fig. 1 Structure of Sup35 and its prion domain[6].
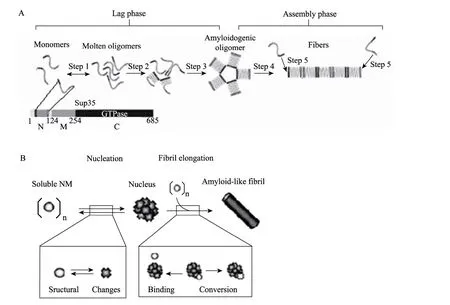
图2 Sup35p朊蛋白结构域的自组装模型[12-13]Fig. 2 Model of Sup35 prion domain self-assembly[12-13].
单体的二聚化反应起始于 N3残基之间的接触[8];随着寡聚体中单体数量的增加,即使是从二聚体到三聚体,寡聚体的稳定性显著增强;单个β-片层的稳定通过骨架与骨架、侧链与侧链之间的氢键实现;而紧邻的β-片层之间没有氢键和疏水相互作用,它们通过N2、Q4和N6的侧链形成干的极性配位拉链 (Dry polar steric zipper) 而将彼此牢牢抓住,这些位点的突变导致寡聚体的稳定性丧失[14]。二聚体的平行 β-片层构象没有反平行 β-片层稳定,但从二聚体到三聚体、四聚体的过程中,新加入的 β-片层更多的采用平行堆叠方式[15],这与已知的GNNQQNY晶体结构信息相一致[16]。
2.3 成核与纤维的生长
大量的研究表明,Sup35p淀粉样蛋白纤维的生长是通过朊蛋白核 (Seed/nucleus) 捕获单体,经构象转变后向核的两端不断延伸 (图2B)。朊蛋白核主要有3种来源:从头组装而成[17];由Hsp104从成熟的淀粉样蛋白纤维切割而成的小片段[18];其他淀粉样蛋白纤维提供的核,即交叉成核(Cross-seeding)[19-21]。成核后的纤维生长过程存在 2个限速步骤:可溶性蛋白单体与核结合,并形成变性剂敏感的中间体;由核介导的单体的构象转变而使纤维得到延伸[22]。
3 Sup35朊蛋白结构域的应用
3.1 Sup35淀粉样蛋白纤维的功能化
研究表明,淀粉样蛋白纤维的直径通常在10~30 nm (图3-A),从材料学的角度它属于纳米线(Nanowire),因而具有纳米材料的独特属性[23-27]。将具有特定功能的酶、抗体/抗原、吸附重金属离子的蛋白及其他功能的蛋白质与具有自组装成纳米线能力的蛋白质或结构域融合,就可以将这些蛋白质高浓度地展示在纳米线的表面,从而使纳米线功能化,获得新型的纳米材料、传感器等。
中国科学院武汉病毒研究所的张先恩研究小组在Sup35纳米线的功能化方面进行了大量的富有成效的尝试[25-27]。他们将Sup351-61片段分别与蛋白G和甲基对硫磷水解酶 (Methyl-parathion hydrolase,MPH) 融合,通过体外自组装获得 MPH对蛋白 G的比例很高的纳米线,建立的鼠疫耶尔森氏菌Yersinia pestis F1抗原检测体系的灵敏度提高了100倍[26];随后,他们在此基础上,通过引入生物素-链亲和素系统,将F1抗原的检测灵敏度提高了2 000~4 000倍[27]。他们还将Sup351-61片段与对pH值敏感的绿色荧光蛋白突变体E2GFP及MPH进行融合表达,获得新型纳米线材料 (图3B),以此材料为基础的生物传感器对甲基对硫磷农药的检测灵敏度可以提高10 000倍[25]。

图3 Sup35自组装成的纳米线 (A) 及其功能化 (B)[24-25]Fig. 3 The nanowire self-assembled by Sup35 and its functionaliztion. (A) Transmission electron micrographs of Sup35 prion fibers[24]. (B) Self-assembly of the nanowire fluorescent biosensor Sup351-61-E2GFP-MPH[25].
3.2 作为淀粉样蛋白聚集的研究模型
在大肠杆菌中,酵母Sup35的NM结构域能形成具有感染性的朊蛋白,而且酵母的另一个朊蛋白New1能起到在酵母细胞内相同的促进 Sup35向朊蛋白转变的功能[28]。Li等发现在果蝇中表达 Sup35的N结构域可以抑制 Poly (Q) 的毒性 (Sup35朊蛋白在酵母中增强其毒性),N结构域中的重复序列是发挥抑制作用所必需的,他们的结果提示,Sup35N可以在多细胞环境中以反式作用因子的方式调节具有Poly (Q) 结构域的致病性朊蛋白的聚集行为[29]。在哺乳动物的神经细胞胞浆中表达Sup35的NM结构域,它们是以可溶性形式存在,但在培养基中添加在大肠杆菌中形成的Sup35NM纤维后,可溶性Sup35NM就可以聚集成淀粉样蛋白纤维而具有朊蛋白效应,而且朊蛋白可以在表达了 Sup35NM 的神经细胞之间传播[31]。通过 GPI (Glycosylphosphatidylinisotol) 将 Sup35NM 锚定到神经细胞的细胞膜可以促进朊蛋白在细胞之间的传播[30]。由此可见,酵母Sup35已在大肠杆菌、果蝇和哺乳动物细胞中异源表达,并都能有效地形成淀粉样蛋白纤维,呈现出朊蛋白效应,因此,Sup35可以作为研究人类的蛋白质错误折叠性疾病的发病机制、朊病毒生物学等的理想模型[28-31]。
Sup35形成的朊蛋白还可以用于朊病毒、蛋白质错误折叠性疾病的预防与治疗药物的筛选和评价模型[12,32]。例如,Roberts等发现表没食子儿茶素没食子酸酯 (Epigallocatechin-3-gallate,EGCG) 能直接抑制Sup35形成朊蛋白,其活性具有菌株特异性,即有些酵母菌株具有EGCG抗性,但 4,5-4-甲氧基二邻苯二甲酰亚胺 (4,5-bis-(4-methoxyanilino) phthalimide) 与 EGCG协同作用后,可以抑制所有菌株中 Sup35朊蛋白的形成,因此这 2种药物联合使用有望应用于蛋白质错误折叠性疾病的预防与治疗[12]。
3.3 其他应用
Ivanov等将Sup35NM结构域与HIV-1病毒的核心蛋白Gag-p55融合,使原来在酿酒酵母中表达量极低的Gag-p55获得了高效表达,获得的融合蛋白具有热、碱和变性剂 (SDS) 的抗性,而且Gag-p55具有完全的抗原活性;Sup35融合后有利于不溶性的和不稳定的蛋白质在酿酒酵母中的异源表达与纯化,他们成功表达了不溶性的 A型肉毒外毒素的L-链[33]。
苏云金芽胞杆菌Bacillus thuringiensis在形成芽胞的同时,其具有杀虫活性的杀虫晶体蛋白会组装成伴胞晶体,但目前伴胞晶体的组装机制尚不清楚。本课题组将Sup351-61片段分别与不同大小的杀虫晶体蛋白融合,主要进行两方面的探索:(1) 在大肠杆菌中表达并纯化,通过Sup35的自组装,将杀虫晶体蛋白高浓度地展示在纳米线表面后能否提高其杀虫活性?(2) 在苏云金芽胞杆菌无晶体突变株中表达融合蛋白,Sup35的自组装是否会干扰伴胞晶体的组装?这些研究将为苏云金芽胞杆菌的相关功能基因的改造及揭示伴胞晶体的组装机制提供新的思路,目前已取得了一定的成果 (待发表)。
4 展望
酿酒酵母的翻译终止因子Sup35的朊蛋白结构域在体内外都能形成淀粉样蛋白纤维,而且其构象与其他物种 (如哺乳动物) 淀粉样蛋白纤维相同,都为高度有序的交叉β-片层构象。而阿尔茨海默症、亨廷顿氏症、帕金森氏症及传染性海绵状脑病等蛋白质错误折叠性疾病与体内淀粉样蛋白聚集物的形成密切相关,目前可以运用的预防与治疗药物非常有限[1-2]。研究证实,酵母Sup35异源表达后都能有效地形成淀粉样蛋白纤维,因此,Sup35是相关疾病的发病机制及其药物筛选与评价的理想模型[12,28-33]。
从材料学角度看,Sup35形成的淀粉样蛋白纤维属于纳米线,如果把有关的功能基因与具有自组装成纳米线能力的朊蛋白结构域融合,就可以将相关蛋白质或酶高浓度地展示在纳米线的表面[23]。功能化的纳米线将有望在研制新一代电路、新功能材料及临床检测与诊断等生物技术与纳米科技方面得到广泛应用[25-27]。
终上所述,Sup35分子自组装机理的研究在人类蛋白质错误折叠性疾病及朊病毒生物学等方面具有重大的理论意义,而且Sup35自组装成纳米线的能力在生物技术和纳米材料等方面有望得到更广泛的应用。
REFERENCES
[1] Chiti F, Dobson CM. Protein misfolding, functional amyloid, and human disease. Ann Rev Biochem, 2006, 75: 333−366.
[2] Chaudhuri TK, Paul S. Protein-misfolding diseases and chaperone-based therapeutic approaches. FEBS J, 2006, 273(7): 1331−1349.
[3] Fowler DM, Koulov AV, Balch WE, et al. Functional amyloid-from bacteria to humans. Trends Biochem Sci, 2007, 32(5): 217−224.
[4] Mathur V, Taneja V, Sun YD, et al. Analyzing the birth and propagation of two distinct prions, [PSI+] and [Het-s]y, in yeast. Mol Biol Cell, 2010, 21(9): 1449−1461.
[5] Saifitdinova AF, Nizhnikov AA, Lada AG, et al. [NSI+]: a novel non-Mendelian nonsense suppressor determinant in Saccharomyces cerevisiae. Curr Genet, 2010, 56(5): 467−478.
[6] Tuite MF, Cox BS. The genetic control of the formation and propagation of the [PSI+] prion of yeast. Prion, 2007, 2(1): 101−109.
[7] Mukhopadhyay S, Krishnan R, Lemke EA, et al. A natively unfolded yeast prion monomer adopts an ensemble of collapsed and rapidly fluctuating structures. Proc Natl Acad Sci USA, 2007, 104(8): 2649−2654.
[8] Reddy AS, Chopra M, de Pablo JJ. GNNQQNY--investigation of early steps during amyloid formation. Biophys J, 2010, 98(6): 1038−1045.
[9] Meli M, Morra G, Colombo G. Investigating the mechanism of peptide aggregation: insights from mixed monte carlo-molecular dynamics simulations. Biophys J, 2008, 94(11): 4414−4426.
[10] Shkundina IS, Kushnirov VV, Tuite MF, et al. The role of the N-terminal oligopeptide repeats of the yeast Sup35 prion protein in propagation and transmission of prion variants. Genetics, 2006, 172(2): 827−835.
[11] Derkatch IL, Bradley ME, Zhou P, et al. The PNM2 mutation in the prion protein domain of SUP35 has distinct effects on different variants of the [PSI+] prion in yeast. Curr Genet, 1999, 35(2): 59−67.
[12] Roberts BE, Duennwald ML, Wang H, et al. A synergistic small-molecule combination directly eradicates diverse prion strain structures. Nat Chem Biol, 2009, 5(12): 936−946.
[13] Suhre MH, Hess S, Golser AV, et al. Influence of divalent copper, manganese and zinc ions on fibril nucleation and elongation of the amyloid-like yeast prion determinant Sup35p-NM. J Inorg Biochem, 2009, 103(12): 1711−1720. [14] Zheng J, Ma BY, Tsai CJ, et al. Structural stability and dynamics of an amyloid- forming peptide GNNQQNY from the yeast prion Sup-35. Biophys J, 2006, 91(3): 824-833.
[15] Zhang ZQ, Chen H, Bai HJ, et al. Molecular dynamics simulations on the oligomer-formation process of the GNNQQNY peptide from yeast prion protein Sup35. Biophys J, 2007, 93(5): 1484−1492.
[16] Nelson R, Sawaya MR, Balbirnie M, et al. Structure of the cross-β spine of amyloid-like fibrils. Nature, 2005, 435(7043): 773−778.
[17] Glover JR, Kowal AS, Schirmer EC, et al. Self-seeded fibers formed by Sup35, the protein determinant of [PSI+], a heritable prion-like factor of S. cerevisiae. Cell, 1997, 89(5): 811−819.
[18] Kryndushkin DS, Alexandrov IM, Ter-Avanesyan MD, et al. Yeast [PSI+] prion aggregates are formed by small Sup35 polymers fragmented by Hsp104. J Biol Chem, 2003, 278(49): 49636−49643.
[19] Osherovich LZ, Weissman JS. Multiple Gln/Asn-rich prion domains confer susceptibility to induction of the yeast [PSI+] prion. Cell, 2001, 106(2): 183−194.
[20] Derkatch IL, Uptain SM, Outeiro TF, et al. Effects of Q/N-rich, polyQ, and non-polyQ amyloids on the de novo formation of the [PSI+] prion in yeast and aggregation of Sup35 in vitro. Proc Natl Acad Sci USA, 2004, 101(35): 12934−12939.
[21] Choe YJ, Ryu Y, Kim HJ, et al. Increased [PSI+] appearance by fusion of Rnq1 with the prion domain of Sup35 in Saccharomyces cerevisiae. Eukaryot Cell, 2009, 8(7): 968−976.
[22] Scheibel T, Bloom J, Lindquist SL. The elongation of yeast prion fibers involves separable steps of association and conversion. Proc Natl Acad Sci USA, 2004, 101(8): 2287−2292.
[23] Baldwin AJ, Bader R, Christodoulou J, et al. Cytochrome display on amyloid fibrils. J Am Chem Soc, 2006, 128(7): 2162−2163.
[24] Feng BY, Toyama BH, Wille H, et al. Small-molecule aggregates inhibit amyloid polymerization. Nat Chem Biol, 2008, 4(3): 197−199.
[25] Leng Y, Wei HP, Zhang ZP, et al. Integration of a fluorescent molecular biosensor into self-assembled protein nanowires: a large sensitivity enhancement. Angew Chem Int Ed Engl, 2010, 49(40): 7243−7246.
[26] Men D, Guo YC, Zhang ZP, et al. Seeding-induced self-assembling protein nanowires dramatically increase the sensitivity of immunoassays. Nano Lett, 2009, 9(6): 2246−2250.
[27] Men D, Zhang ZP, Guo YC, et al. An auto-biotinylated bifunctional protein nanowire for ultra-sensitive molecular biosensing. Biosens Bioelectron, 2010, 26(4): 1137−1141.
[28] Garrity SJ, Sivanathan V, Dong JJ, et al. Conversion of a yeast prion protein to an infectious form in bacteria. Proc Natl Acad Sci USA, 2010, 107(23): 10596−10601.
[29] Li LB, Xu KX, Bonini NM. Suppression of polyglutamine toxicity by the yeast Sup35 prion domain in Drosophila. J Biol Chem, 2007, 282(52): 37694−37701.
[30] Speare JO, Offerdahl DK, Hasenkrug A, et al. GPI anchoring facilitates propagation and spread of misfolded Sup35 aggregates in mammalian cells. EMBO J, 2010, 29(4): 782−794.
[31] Krammer C, Kryndushkin D, Suhre MH, et al. The yeast Sup35NM domain propagates as a prion in mammalian cells. Proc Natl Acad Sci USA, 2009, 106(2): 462−467.
[32] Feng BY, Toyama BH, Wille H, et al. Small-molecule aggregates inhibit amyloid polymerization. Nat Chem Biol, 2008, 4(3): 197−199.
[33] Ivanov PA, Lewitin EI, Shevelev BI, et al. Sup35p yeast prion-like protein as an adapter for production of the Gag-p55 antigen of HIV-1 and the L-chain of botulinum neurotoxin in Saccharomyces cerevisiae. Res Microbiol, 2001, 152(1): 27−35.
Mechanism and application of molecular self-assembly in Sup35 prion domain of Saccharomyces cerevisiae
Wen Yin, Jin He, Ziniu Yu, and Jieping Wang
State Key Laboratory of Agricultural Microbiology, National Engineering Research Center of Microbial Pesticides, Huazhong Agricultural University, Wuhan 430070, China
Sup35 in its native state is a translation termination factor in Saccharomyces cerevisiae. The prion domain of Sup35p can form amyloid-like proteinaceous fibrils in vitro and in vivo. Furthermore, the in-register cross β-sheet structure of Sup35p amyloid fibrils is similar to those formed in other species. Therefore, studies on mechanism of Sup35p self-assembly can be an appropriate model to study protein misfolding-related diseases and prion biology. Because of its ability to self-assemble into nanowires, the prion domain of Sup35p has been widely used in biotechnology and nanotechnology.
Sup35, prion domain, self-assembly, Saccharomyces cerevisiae
淀粉样蛋白 (Amyloids) 是一类高度有序的蛋白性纤维 (Proteinaceous fibers),广泛存在于细菌、真菌和哺乳动物。它们的共同特征是:由天然的 α-螺旋和 β-片层混合构象转变成交叉 β-片层 (Crossβ-sheet) 构象;对化学及热变性、蛋白酶具有极强的抗性;易与刚果红和硫黄素 T等染料结合[1]。在哺乳动物中,淀粉样蛋白的形成往往会引起阿尔茨海 默 症 (Alzheimer disease)、 亨 廷 顿 氏 症(Huntington′s disease)、帕金森氏症 (Parkinson′s disease) 及传染性海绵状脑病 (Transmissible spongiform encephalopathies) 等蛋白质错误折叠性疾病[1-2]。有些淀粉样蛋白参与正常的生理功能,在细菌、真菌、无脊椎动物和哺乳动物中都存在功能性淀粉样蛋白[3]。
April 7, 2011; Accepted: May 16, 2011
Supported by:National Natural Science Foundation of China (No. 30930004).
Jieping Wang. Tel: +86-27-87280670; E-mail: wangjieping2011@163.com
国家自然科学基金 (No. 30930004) 资助。
