毕赤酵母中表达透明颤菌血红蛋白提高重组脂肪酶的表达
2011-02-09汪小锋孙永川申旭光柯锋徐莉刘云闫云君
汪小锋,孙永川,申旭光,柯锋,徐莉,刘云,闫云君
华中科技大学生命科学与技术学院 教育部分子生物物理重点实验室,武汉 430074
巴斯德毕赤酵母Pichia pastoris具有强启动子、可对表达的蛋白进行翻译后加工与修饰、易于高密度发酵和纯化等优点[1],是近年来广泛报道的能高效表达各种外源蛋白的表达系统,目前已有600多种蛋白在毕赤酵母中成功实现了表达[2]。为了提高重组蛋白的体积生产率,工业上通常进行高细胞密度发酵[3]。毕赤酵母高细胞密度发酵过程需要消耗大量的氧气,通常会造成供氧限制。而氧气在发酵液中的溶解度较低,且随着发酵液中生物量和消泡剂的增加,其溶解度和传质效率还会逐步降低[4],因此溶氧控制是毕赤酵母高密度发酵过程中影响重组蛋白表达的重要因素。在大规模发酵过程中由于大的发酵罐存在体积大、死角较多,罐内各部位溶氧分布不均,导致低氧问题十分突出[5],因此利用分子生物学方法改善重组毕赤酵母在低氧条件下的蛋白表达水平意义十分重大。
透明颤菌血红蛋白 (Vitreoscilla hemoglobin,VHb) 是一种专性好氧的革兰氏阴性丝状菌在低氧环境中产生的一种分子量约为15.8 kDa的可溶性蛋白,具有较高的氧吸附和解离速率常数[6],已在多种宿主中成功表达并促进细胞生长和提高代谢物产率[7]。在毕赤酵母中共表达目的蛋白和VHb是改善高密度发酵过程中溶氧限制的一种有效方式。在氧供应正常的情况下,β-半乳糖苷酶与VHb在毕赤酵母中共表达对细胞生长没有明显促进作用,但重组菌中 β-半乳糖苷酶的表达量提高了 4倍[3]。此外,有研究表明,VHb在毕赤酵母中的表达不仅能提高氧的利用率和 S-腺苷甲硫氨酸的产率,还能促进ATP合成,增强甲醇代谢活性[4]。PsADH2启动子是一种来源于树干毕赤酵母的乙醇脱氢酶2 (PsADH2)基因的低氧诱导型启动子,能在氧气限制条件下被激活。该启动子应用于毕赤酵母中表达VHb能在低氧条件下改善重组细胞的生长[8],提高重组植酸酶的表达量[5]。
YlLip2是一种重要的微生物脂肪酶,具有较高的水解、酯化和转酯活力,在酯合成、生物柴油制备和对映体拆分等领域具有广阔的应用前景[9-10]。YlLip2已在毕赤酵母中成功实现了高水平的表达[10-12],但高密度发酵过程中VHb与脂肪酶共表达的研究尚未见有文献报道。本研究中,首先将YlLip2基因 (lip2) 克隆到pPIC9K载体中,电转化毕赤酵母菌株GS115,得到重组菌株GS115/9Klip2。利用重叠PCR的方法将PsADH2启动子和终止子与VHb基因 (vgb) 融合后单独或与lip2基因共同整合到诱导型的 pPICZαA 表达载体中,电转化GS115/9Klip2菌株,实现VHb的胞内表达与YlLip2的分泌表达。同时,在溶氧限制条件下对重组菌株的细胞生长和脂肪酶的表达水平进行了探讨。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
pPIC9K-Lip2H和pMD-VHb质粒均为本实验室构建并保存。P. pastoris GS115 (his4)、pPIC9K、 pPICZαA和E. coli Top10均购自Invitrogen公司。pMD18-T simple载体购自日本 TaKaRa公司。Pichia stipitis CBS 6054由杭州师范大学李海峰博士馈赠。
1.1.2 试剂及仪器
胰蛋白胨、酵母提取物购自Oxoid公司;YNB (无氨基酸) 购自BD公司;限制性内切酶、T4 DNA连接酶、高保真 PrimerSTAR HS DNA聚合酶、DNA凝胶回收试剂盒等购自TaKaRa公司;DNA凝胶回收试剂盒购自OMGE公司;BCA蛋白定量检测试剂盒购自北京索莱宝科技有限公司;所有化学试剂均购自上海国药集团化学试剂有限公司;10 L搅拌式发酵罐 (BIOTECH-10JGZ) 购自上海保兴生物设备工程有限公司;GenePulserⅡ电穿孔仪购自Bio-RAD公司;高速离心机和PCR仪均购自德国Eppendorf公司;高压细胞破碎仪购自英国Constant Systems公司。
1.1.3 引物与培养基
根据NCBI公布的DNA序列设计引物 (表1),所有普通 PCR引物均由上海生物工程公司合成。基因测序由上海桑尼生物科技有限公司完成。YPD、YPDS、BMGY、BMMY、MD、MM等培养基参考Invitrogen公司的毕赤酵母表达手册。酶活力检测采用BMMY-罗丹明B-橄榄油平板 (100 mL的BMMY培养基中加入1 mL橄榄油乳化液和400 μL的0.1%的罗丹明B);10 L发酵罐上采用修饰的FM22培养基[13](g/L):KH2PO4,42.9;(NH4)2SO4,5;CaSO4,0.6;K2SO4,14.3;MgSO4·7H2O 11.7;柠檬酸,1.9;甘油,40 g和 2.0 mL/L的微量元素储液PTM4[13]。发酵罐补料培养基:甘油 50% (W/V,含 4 mL/L PTM4);甲醇 100% (含 4 mL/L PTM4)。

表1 本文中所用到的引物Table 1 The Primers used in this study
1.2 方法
1.2.1 重组质粒的构建与转化
以 pPIC9K-Lip2H的质粒 DNA为模板,利用lip2-F1和lip2-R1为引物扩增lip2基因,PCR产物加A后连接pMD18-T simple载体,形成的pMD-lip2质粒用于转化E. coli Top10,筛选阳性克隆子并通过测序确认插入基因的正确性。测序正确的pMD-lip2质粒经双酶切、胶回收后的目的基因片段插入到pPIC9K的EcoR Ⅰ/Not Ⅰ位点之间形成pPIC9K-lip2质粒;重组质粒pPIC9K-lip2经Sal Ⅰ线性化后,取10 μg与80 μL的GS115感受态细胞混合,在电转参数为1 500 V、25 μF、200 Ω的条件下转化,得到GS115/9Klip2菌株。重组菌株的表型鉴定和高拷贝筛选参考Invitrogen公司的毕赤酵母表达手册。将高 G418抗性的 Mut+型克隆子转移到 BMMY-罗丹明B-橄榄油平板上,28 ℃培养3 d后,挑取水解圈较大的克隆子进行 PCR验证和酶活力筛选。脂肪酶活力最高的重组菌株将进行下一步的有关研究。
以树干毕赤酵母基因组 DNA为模板,分别以ADH2-P1/P2和 ADH2-T1/T2为引物扩增 PsADH2启动子和终止子。以pMD-VHb质粒DNA为模板,以VHb-M1和VHb-M2为引物扩增vgb基因片段,通过重叠PCR的方法将PsADH2启动子和终止子与 vgb基因融合成一个完整的基因 PVT。PVT经BamHⅠ酶切后胶回收的片段插入到 pPICZαA载体中得到pPICZPVT。以pPIC9K-lip2的质粒DNA为模板,以lip2-F2和lip2-R2为引物扩增lip2基因,PCR产物经EcoRⅠ/XbaⅠ双酶切、胶回收后,整合到pPICZPVT载体中形成pPICZPVT-lip2质粒。通过测序验证重组质粒 pPICZPVT和 pPICZPVT-lip2构建成功。重组质粒经 BstXⅠ线性化后电转化GS115/9Klip2,得到重组菌株 GS115/9Klip2-pZPVT和GS115/9Klip2-pZPVTlip2。采用YPDS-Zeocin抗性平板筛选高拷贝克隆子。将高Zeocin抗性的克隆子转移到BMMY-罗丹明B-橄榄油平板上,28 ℃培养3 d后,挑取水解圈较大的克隆子进行PCR验证和酶活力筛选。
1.2.2 高产菌株的筛选与摇瓶发酵
随机挑取 60个水解圈较大的克隆子接种于装有50 mL BMGY培养基的500 mL摇瓶中,30 ℃、220 r/min下培养16~18 h,当吸光度OD600=4~6时,离心收集菌体后转移到50 mL的BMMY培养基中,28 ℃、220 r/min下继续诱导培养,每隔24 h添加1.5% (V/V) 的甲醇,并取样检测生物量和发酵液上清的酶活力。对筛选到的高脂肪酶活力的重组菌株进行发酵pH和甲醇添加量的优化,为发酵罐中高密度发酵提供一定的参考。
1.2.3 分批补料培养
将−80 ℃保存的克隆子接种到30 mL的YPD培养基中,培养16 h后转接到装有400 mL BMGY培养基的2 L摇瓶中,培养18~20 h,当OD600=4~6时,以10%的接种量接入到起始装液量为4 L FM22培养基的发酵罐中,进行分批补料培养。菌体生长阶段和诱导阶段温度分别设定为29 ℃和25 ℃,搅拌速度500~800 r/min,DO维持在10%~25%之间,通气量维持在4~12 L/min,流加28%的氨水和 30%的磷酸自动控制pH,菌体生长阶段和诱导阶段分别为6.0和6.5。当甘油耗尽后,补加400 mL 50%的甘油;当DO再次上升后,流加100%甲醇至罐中的甲醇的浓度为 0.5%,0~6 h流加速度为1.5~3.5 mL/(L·h),6~24 h,逐渐提高流加速度到6~8 mL/(L·h),并一直维持该速度至发酵结束,发酵过程中根据 DO的波动适当调节甲醇流速。每隔一段时间取样测定菌体湿重、酶活力和蛋白质含量。
1.2.4 生物量和重组菌株遗传稳定性的测定
取5 mL发酵液至预先已称重的离心管中,4 ℃下8 000 r/min离心10 min,用无菌水洗涤细胞2次,4 ℃、8 000 r/min离心10 min,弃上清后称重,计算细胞湿重 (WCW)。取发酵罐中培养160 h的发酵液1 mL用无菌水适当稀释,取80 μL稀释液涂布在YPD平板上,待平板上有菌落形成,用牙签挑取100个单克隆到固体YPD-G418-Zeocin选择培养基上,菌斑出现后统计双抗平板上的菌斑数量,计算工程菌种质粒的丢失率,重复操作3次。
1.2.5 VHb活力的检测
VHb活性检测采用 CO-差光谱法[8]。10 mL发酵液在5 000 r/min离心5 min后,细胞重悬于100 mmol/L的 Tris-HCl缓冲液 (pH 7.5,包含50 mmol/L NaCl),高压细胞破碎后,4 ℃、8 000 r/min离心10 min,取3 mL上清用缓冲液稀释1倍并加入连二亚硫酸钠至终浓度为 2.5 mg/mL,通入 CO气体室温避光孵育3 min,用美谱达1800PC紫外可见分光光度计在400~500 nm波段扫描得到CO-差示光谱图。
1.2.6 脂肪酶活力测定与蛋白质分析
脂肪酶活性测定采用碱式滴定法[12]。操作步骤如下:酶活力测定以橄榄油乳化液 (橄榄油∶PVA=1∶3,V/V) 为底物,底物4 mL、Tris-HCl (pH 8.0,50 mmol/L) 5 mL和适当稀释的发酵上清液1 mL组成10 mL反应体系,40 ℃水浴反应10 min后加入15 mL终止液 (乙醇∶丙酮=1∶1,V/V) 终止反应。酶催化水解产生的脂肪酸通过0.05 mol/L NaOH滴定测得,加两滴0.5%酚酞指示滴定终点。在40 ℃、pH 8.0的条件下,脂肪酶每分钟水解橄榄油产生1 μmol游离脂肪酸所需的酶量定义为一个活力单位 (U)。蛋白浓度测定采用BCA蛋白浓度定量检测试剂盒。SDS-PAGE检测目的蛋白的分子量和表达水平,蛋白质染色采用考马斯亮蓝R-250。
TaqMan实时荧光定量PCR法检测毕赤酵母基因组中lip2基因的拷贝数由广州吉坤生物技术有限公司完成。毕赤酵母GAP基因的标准品、lip2基因和GAP基因的引物、探针均由广州达安基因公司提供。阳性重组质粒 pPICZαA-lip2和 pPIC3.5K-vgb作为标准品质粒,重组菌株的基因组 DNA作为模板,均由本实验室提供。
2 结果与分析
2.1 表达载体的构建
去自身信号肽的lip2基因的PCR扩增产物长度为906 bp,PsADH2启动子和终止子与vgb基因通过重叠PCR的方法融合成全长为1 383 bp的完整基因PVT,经过测序验证正确后分别插入到 pPIC9K和pPICZαA 载体中,得到重组质粒 pPIC9K-lip2和pPICZPVT。再将以lip2-F2和lip2-R2为引物扩增得到 lip2基因插入到 pPICZPVT中,获得重组质粒pPICZPVT-lip2。通过PCR和测序证实所有的重组质粒构建正确。
2.2 高产菌株的筛选与摇瓶发酵
重组质粒pPIC9K-lip2电转化毕赤酵母GS115后得到重组菌株GS115/9Klip2。从BMMY-罗丹明B-橄榄油平板上随机挑选 60个水解圈较大的Mut+型克隆子进行摇瓶发酵。以 BMMY为诱导培养基培养96 h,筛选到一株最高脂肪酶水解活力为1 200 U/mL的克隆子GS115/9Klip2 58#。以该工程菌为基础,考察了发酵pH和甲醇添加量对YlLip2表达量的影响 (图1)。每24 h甲醇添加量为1.5% (V/V) 时,YlLip2的表达量最高 (图1A);脂肪酶的表达量随初始诱导pH的增加而增加,当pH为 6.5时达到最高,过高和过低的 pH都不利于 YlLip2的表达 (图 1B)。因此,后续的实验中诱导 pH采用 6.5,每 24 h甲醇添加量为 1.5% (V/V)。
pPICZPVT-lip2和 pPICZPVT经BstXⅠ线性化后转化 GS115/9Klip2 58#宿主,得到重组菌株GS115/9Klip2-pZPVT和GS115/9Klip2- pZPVTlip2。空载质粒pPICZαA转化GS115/9Klip2 58#宿主得到一株阳性克隆子 GS115/9Klip2-ZαA 9#作为对照菌株。以BMMY为诱导培养基培养96 h,重组菌株GS115/9Klip2-pZPVT和GS115/9Klip2-pZPVTlip2中的最高脂肪酶活力的克隆子28#和49#的YlLip2水解活力分别达到1 500 U/mL和4 000 U/mL。

图1 不同的甲醇浓度和诱导pH对YlLip2产酶的影响Fig. 1 Effects of different methanol concentration (A) and induction pH values (B) on YlLip2 production.
2.3 VHb和YlLip2在毕赤酵母中的表达
提高摇瓶装液量和降低转速,创造 DO限制性条件,从而使低氧压力启动子能启动 vgb基因的表达。为了考察DO限制性条件下VHb和YlLip2在毕赤酵母中的表达情况,对 4个重组菌株(GS115/9Klip2 58#,GS115/9Klip2-ZαA 9#,GS115/ 9Klip2-pZPVT 28#,GS115/9Klip2-pZPVTlip2 49#)在摇瓶中的发酵条件进行了研究,发酵条件为:装液量100 mL/500 mL,转速150 r/min,诱导时间96 h。由于低氧压力启动子启动vgb表达效率不高,VHb在胞内的表达量不高,因此一般采用CO-差式光谱法检测VHb是否实现功能表达。由图2可知,VHb+细胞 (GS115/9Klip2-pZPVT 28#) 在420 nm附近有典型的特征吸收峰,而 VHb–细胞 (GS115/ 9Klip2 58#) 在420 nm处没有特征吸收峰,说明胞内表达出了具有生物活性的VHb蛋白。
对以上菌株在 DO限制性发酵条件下的发酵液上清和细胞破碎液进行SDS-PAGE分析 (图3)。表达了VHb的重组菌株的发酵液上清中均有一条明显的分子量大约为38 kDa的蛋白,与Y. lipolytica野生菌产生的YlLip2的分子量大小相当。
在低氧条件下,对照菌株 GS115/9Klip2 58#和GS115/9Klip2-ZαA 9#的表达量都很低,而 GS115/ 9Klip2-pZPVT 28#和GS115/9Klip2-pZPVTlip2 49#表达量较高。
记录两组产妇麻醉起效时间、至胎儿娩出时间,针刺法测定两组产妇最高阻滞平面,用VAS法评价两组患者镇痛指数,分数越高,镇痛效果越好。
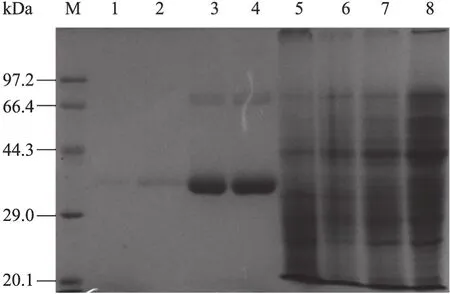
图3 SDS-PAGE分析YlLip2在毕赤酵母中的表达Fig. 3 SDS-PAGE analysis of YlLip2 expressed in P. pastoris. M: protein marker; 1−4: 4 μL of culture supernatant of GS115/9Klip2 58#, GS115/9Klip2-ZαA 9#, GS115/9Klip2-pZPVT 28#, GS115/9Klip2-pZPVTlip2 49#; 5−8: 5 μL cell homogenates of GS115/9Klip2 58#, GS115/9Klip2-ZαA 9#, GS115/9Klip2-pZPVT 28#, GS115/9Klip2-pZPVTlip2 49#.
2.4 VHb对重组细胞的生长和 YlLip2表达的影响
考察了摇瓶中VHb的表达对VHb+转化子和对照菌株生长和YlLip2表达的影响。由图4可知,VHb的表达对重组菌的生长没有明显促进作用,但能提高YlLip2的表达量。VHb+细胞中YlLip2的表达量与VHb–细胞和对照菌株GS115/9Klip2-ZαA 9#相比分别提高了25%和36%。GS115/9Klip2-pZPVTlip2 49#转化子中YlLip2的表达量与VHb+细胞相比得到了显著提高。TaqMan实时荧光定量PCR检测发现GS115/9Klip2-pZPVTlip2 49#转化子基因组中lip2基因有8个拷贝,而VHb+细胞的基因组中只有4个拷贝,因此拷贝数的增加导致了YlLip2的表达量进一步提高。
2.5 VHb对高密度发酵生产YlLip2的影响
为了考察低氧条件下VHb的表达对高密度发酵生产YlLip2的影响,DO和转速采取串级控制以维持DO在10%~25%之间。由图5可知,在高密度发酵过程中,VHb的表达不仅促进了 VHb+细胞的生长,也显著提高了YlLip2在VHb+细胞中的表达量。
经过 153 h的培养,VHb+细胞分泌表达的YlLip2活力达到最大,为15 900 U/mL,是VHb–细胞的 1.83倍。同时对 VHb+转化子 GS115/9Klip2-pZPVTlip2 49#在低氧条件下的高密度发酵过程进行了研究 (图 6),结果发现YlLip2的表达量得到了进一步的提高,经过143 h的培养,YlLip2最高活力达到33 900 U/mL,总蛋白质含量最高达到6.79 g/L。另外,考察了GS115/9Klip2-pZPVTlip2 49#菌株在不同DO限制性条件下表达YlLip2的水平 (图7),发现在溶氧受限的情况下该工程菌也能获得较高的表达量,但随着溶氧浓度的降低,YlLip2的表达量也随之降低。
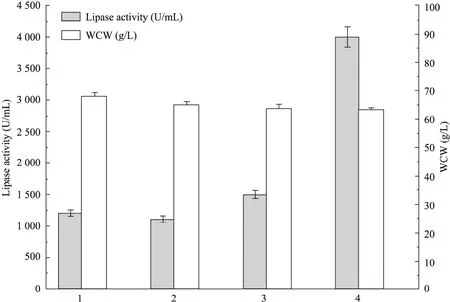
图4 甲醇诱导96 h后VHb+转化子和对照菌株生物量和脂肪酶活力的对比Fig. 4 Comparison of biomass and lipase activity between VHb+ transformants and control strains after 96 h methanol induction. 1: GS115/9Klip2 58#; 2: GS115/9Klip2-ZαA 9#; 3: GS115/9Klip2-pZPVT 28#; 4: GS115/9Klip2-pZPVTlip2 49#. WCW: wet cell weight.
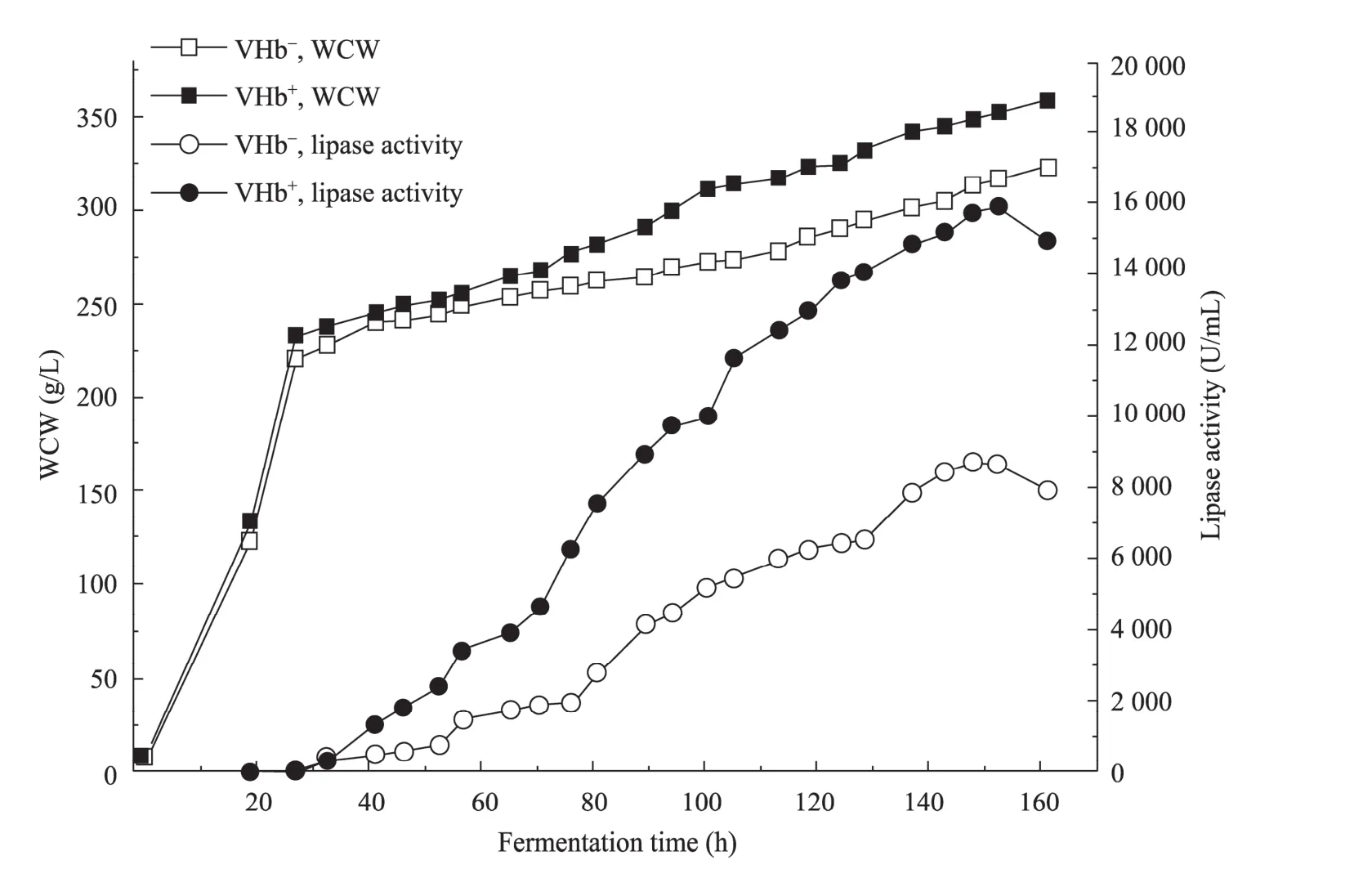
图5 VHb+和VHb−细胞在DO受限的高密度发酵过程中细胞生长和脂肪酶活力的对比Fig. 5 Comparison of cell growth and lipase activity between VHb+ and VHb− cells under limiting DO condition during high cell density fermentation. WCW: wet cell weight.
3 讨论
YlLip2是目前已报道的脂肪酶中蛋白表达量较高的脂肪酶之一,具有十分广阔的应用前景。为了降低该脂肪酶的生产和应用成本,加快其产业化,许多研究致力于通过分子生物学的方法和发酵过程优化策略提高其表达量[10-11,14-15]。传统的诱变育种和同源表达已有效提高了YlLip2的表达量[14-15],脂肪酶最高的活力达到10 000 U/mL[15]。由于Y. lipolytica基因组中有多个脂肪酶基因[11],尽管分泌到胞外的脂肪酶主要是YlLip2,但用野生菌株生产很难保证得到的脂肪酶是单一脂肪酶。毕赤酵母表达系统是近年来应用十分广泛的表达系统,在毕赤酵母中异源表达YlLip2能获得更高的表达量,并且能得到纯度较高的单一脂肪酶,发酵工艺控制较为简单,总的生产成本也相对较低。当采用橄榄油为底物的碱滴定法测定脂肪酶活力时,Yu等[12]报道毕赤酵母中表达重组的YlLip2的最高活力为11 000 U/mL。本研究中获得的GS115/9Klip2-pZPVTlip2 49#转化子的最高酶活力达到33 900 U/mL,明显高于Yu等[11-12]和 Turki等[15]的报道,并且该工程菌的遗传稳定性较好,经过 196 h的培养,重组质粒保存率为99.7%。
毕赤酵母高密度发酵大量表达外源蛋白时通常会引起溶氧的限制,若发酵罐的供氧不足就会直接导致细胞生长缓慢,甲醇及其代谢副产物的积累,最终导致蛋白表达量的下降。改善溶氧限制的方法很多,主要包括提高搅拌转速、通气量、罐压、调节甲醇补料速率、降低温度、降低发酵液粘度、通空气与纯氧的混合气、培养基中添加氧载体等[16]。但以上方法都不能从根本上解决溶氧限制的问题,也无法解决大规模发酵罐中由于溶氧分布不均而导致的低氧问题,并且会间接增加发酵过程的成本。因此,在工程菌中引入透明颤菌血红蛋白共表达的方法,能有效提高重组细胞对氧的利用率、促进细胞生长、改善细胞的表达量、降低发酵过程的动力成本。应用AOX1强启动子表达VHb有效促进了外源蛋白的表达[3-4],但应用低氧压力启动子 PsADH2表达VHb也能改善重组细胞的生长[8],提高外源蛋白的表达量[5],并且对改善重组细胞的呼吸代谢具有其独特性。细胞在溶氧正常的情况下VHb不表达,不影响重组细胞的正常代谢,在低氧的情况下启动VHb的表达,可提高细胞对氧的利用、改善细胞的生长,进而提高外源蛋白的表达。但 DO限制性条件下VHb对重组细胞摄氧的改善作用也是有限的,一定的范围内 (5%~20%) 对重组细胞表达外源蛋白不会产生较大的影响,但过低的溶氧浓度依然会对VHb+细胞产生不利的影响 (图7)。

图6 GS115/9Klip2-pZPVTlip2 49#菌株在10 L发酵罐中生产YlLip2的脂肪酶活力、生物量和总蛋白浓度的过程变化曲线Fig. 6 Time course of lipase activity, biomass and total protein concentration during the production of YlLip2 using GS115/ 9Klip2-pZPVTlip2 49# strain in a 10-L fermentor. WCW: wet cell weight.
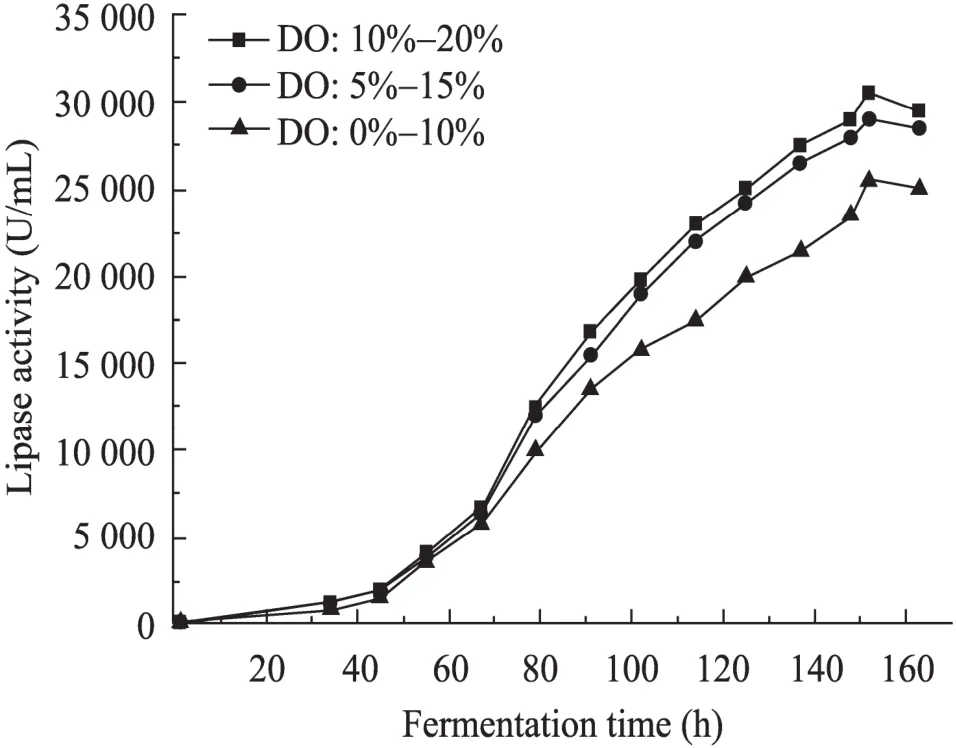
图7 不同 DO限制性条件对 GS115/9Klip2-pZPVTlip2 49#菌株表达YlLip2的影响Fig. 7 Effect of different limiting DO levels on YlLip2 production by GS115/9Klip2-pZPVTlip2 49# strain.
本研究中成功构建了VHb的胞内表达和YlLip2胞外分泌表达的重组工程菌株,vgb和 lip2基因的表达分别通过PsADH2和AOX1启动子调控。在摇瓶发酵中,VHb在低氧条件下的表达对重组菌的生长没有明显的促进作用,但使YlLip2的表达量提高了大约25%。这与VHb同植酸酶在P. pastoris中的共表达对细胞生长无明显影响,而植酸酶的表达量得到提高的结果相类似[5]。摇瓶中溶氧测定困难,无法获知摇瓶中溶氧的限制程度,可能是由于摇瓶中氧的浓度过低导致 VHb+细胞的生长也受到一定抑制。10 L发酵罐中的实验证实了低氧条件下VHb的表达改善了VHb+细胞的生长,提高了YlLip2的表达量,因此有效改善了发酵罐中溶氧的限制,也间接降低了发酵过程的动力成本。本研究中获得的一株含有 8个 lip2基因拷贝的 VHb+转化子GS115/9Klip2-pZPVTlip2 49#,在低氧的高密度发酵过程中YlLip2的最高活力达到33 900 U/mL,明显高于Yu等[10-11]在溶氧正常条件下单独表达lip2基因获得的YlLip2的表达量,为该脂肪酶的大规模工业化生产和应用奠定了基础。因此,基于以上结果,我们认为PsADH2启动子调控下的vgb基因与其他工业酶基因在毕赤酵母中的共表达将能促进细胞生长、提高外源蛋白的表达量,这种策略具有重要的应用前景。
REFERENCES
[1] Li PZ, Anumanthan A, Gao XG, et al. Expression of recombinant proteins in Pichia pastoris. Appl Biochem Biotechnol, 2007, 142(2): 105−124.
[2] Zhang AL, Luo JX, Zhang TY, et al. Recent advances on the GAP promoter derived expression system of Pichia pastoris. Mol Biol Rep, 2009, 36(6): 1611−1619.
[3] Wu JM, Hsu TA, Lee CK. Expression of the gene coding for bacterial hemoglobin improves β-galactosidase production in a recombinant Pichia pastoris. Biotechnol Lett, 2003, 25(17): 1457−1462.
[4] Chen HX, Chu J, Zhang SL, et al. Intracellular expression of Vitreoscilla hemoglobin improves S-adenosylmethionine production in a recombinant Pichia pastoris. Appl Microbiol Biotechnol, 2007, 74(6): 1205−1212.
[5] Tang HG, Huang HQ, Luo HY, et al. Expression of bacterial hemoglobin with a low O2-induced promoter improves recombinant phytase production in Pichia pastoris. J Agri Sci Tech, 2008, 10(3): 84−89.唐辉桂, 黄火清, 罗会颖, 等. 利用透明颤菌血红蛋白在低氧条件下提高毕赤酵母中植酸酶的表达. 中国农业科技导报, 2008, 10(3): 84−89.
[6] Zhang L, Li YJ, Wang ZN, et al. Recent developments and future prospects of Vitreoscilla hemoglobin application in metabolic engineering. Biotechnol Adv, 2007, 25(2): 123−136.
[7] Wei XX, Chen GQ. Applications of the VHb gene vgb for improved microbial fermentation processes. Methods Enzymol, 2008, 436: 273−287.
[8] Chien LJ, Lee CK. Expression of bacterial hemoglobin in the yeast, Pichia pastoris, with a low O2-induced promoter. Biotechnol Lett, 2005, 27(19): 1491−1497.
[9] Liu WS, Zhao HY, Jia B, et al. Surface display of active lipase in Saccharomyces cerevisiae using Cwp2 as an anchor protein. Biotechnol Lett, 2010, 32(2): 255−260.
[10] Yu MR, Wen S, Tan TW. Enhancing production of Yarrowia lipolytica lipase Lip2 in Pichia pastoris. Eng Life Sci, 2010, 10(5): 458−464.
[11] Yu MR, Lange S, Richter S, et al. High-level expression of extracellular lipase Lip2 from Yarrowia lipolytica in Pichia pastoris and its purification and characterization. Protein Expr Purif, 2007, 53(2): 255−263.
[12] Wang XF, Shen XG, Zhao HY, et al. High-level expression and purification of Yarrowia lipolytica lipase Lip2 with six hisditine tags in Pichia pastoris. China Biotechnol, 2011, 31(4): 53−59.汪小锋, 申旭光, 赵鹤云, 等. 带His-tag的解脂耶氏酵母脂肪酶 Lip2在毕赤酵母中的表达及纯化. 中国生物工程杂志, 2011, 31(4): 53−59.
[13] Plantz BA, Sinha J, Villarete L, et al. Pichia pastoris fermentation optimization: energy state and testing a growth-associated model. Appl Microbiol Biotechnol, 2006, 72(2): 297−305.
[14] Fickers P, Fudalej F, Nicaud JM, et al. Selection of new over-producing derivatives for the improvement of extracellular lipase production by the non-conventional yeast Yarrowia lipolytica. J Biotechnol, 2005, 115(4): 379−386.
[15] Turki S, Ayed A, Chalghoumi N, et al. An enhanced process for the production of a highly purified extracellular lipase in the non-conventional yeast Yarrowia lipolytica. Appl Biochem Biotechnol, 2010, 160(5): 1371−1385.
[16] Lin JH. High density fermentation control of Pichia pastoris. China Biotechnol, 2009, 29(5): 120−125.林俊涵. 毕赤酵母高密度发酵工艺的研究. 中国生物工程杂志, 2009, 29(5): 120−125.
