基于人工神经网络-遗传算法的樟芝发酵培养基优化
2011-02-09陆震鸣何喆许泓瑜史劲松许正宏
陆震鸣,何喆,许泓瑜,史劲松,许正宏
1 江南大学医药学院 制药工程研究室,无锡 214122
2 江南大学医药学院 生物活性制品加工工程研究室,无锡 214122
樟芝Antrodia camphorata,又名牛樟菇、牛樟芝,是一种生长于台湾牛樟树 Cinnamomum kanehirai腐朽内壁的药用丝状真菌[1]。研究表明,樟芝具有抗肿瘤、保肝、抗炎症、调节免疫等良好生物活性[2]。由于樟芝自然产量极低,子实体人工栽培技术尚未产业化,导致近年来樟芝子实体十分昂贵,所以采用生物技术方法液态培养获得樟芝发酵产物是目前的主要方法。有学者以生物量或活性物质产量为指标对樟芝的发酵条件进行了优化[3-5],但是不同研究报道的樟芝发酵条件及产量性状相差较大。发酵规模的不同、菌种和接种方法的差异以及发酵条件和发酵过程控制策略的差异等可能是造成不同研究结果差异明显的主要原因。
丝状真菌的发酵过程具有影响因素较多、高度非线性和复杂性等特征[6]。人工神经网络 (ANN) 为研究非线性问题提供了强有力的解决办法。与回归方程需要预先给定函数不同,ANN是以实验数据为基础经过有限次的迭代计算而获得的一个反映实验数据内在联系的数学模型,具有极强的非线性处理能力。遗传算法 (GA) 是借鉴生物界自然选择和群体进化机制形成一种全局寻优算法,通过 GA可以对 ANN模型进行全局性的训练,最终得到最佳方案。ANN-GA技术在故障诊断、生物行为模仿、废水处理等多个行业都已有应用报道[7],但在丝状药食用真菌发酵研究领域尚未见应用报道。
本研究以樟芝模式菌株 Antrodia camphorata ATCC 200183为研究对象,考察了樟芝孢子萌发生长及菌球形成的过程。同时采用旋转中心组合实验设计 (RCCD) 考察了孢子浓度培养基组成对樟芝生物量的显著影响。进一步比较了ANN和响应面法 (RSM) 对樟芝发酵过程的建模效果,并用 GA对ANN模型进行结果寻优,从而获得最优培养基组成。
1 材料与方法
1.1 材料
1.1.1 菌种
樟芝Antrodia camphorata ATCC 200183,本实验室保藏。
1.1.2 培养基
斜面培养基:马铃薯200 g/L,葡萄糖20 g/L,琼脂20 g/L,pH自然。
发酵培养基:葡萄糖浓度、蛋白胨浓度和黄豆粉浓度按照实验设计值,MgSO41.5 g/L,KH2PO43.0 g/L,pH 4.5。
1.1.3 仪器
BX60型光学显微镜,日本 Olympus公司;冷冻干燥机,美国Labconco公司;2135型组织切片机,德国 Leica公司;DHZ-DA型恒温摇床,太仓市实验设备厂。
1.2 方法
1.2.1 樟芝发酵方法
孢子接种物的制备:用接种铲将樟芝菌丝体从PDA斜面上转接入PDA平板,26 ℃培养21 d。取10 mL无菌发酵培养基将平板上的樟芝孢子洗下,采用血球计数板计数并稀释后作为种子液用于发酵实验[8]。
发酵方法:500 mL三角摇瓶中装100 mL发酵培养基,灭菌后接入一定数量的樟芝孢子,100 r/min、26 ℃培养8 d。
1.2.2 生物量测定方法
发酵结束的樟芝发酵产物用 6层纱布过滤得到菌球,经去离子水洗涤后进行冷冻干燥,称重并计算生物量。
1.2.3 形态观察
发酵过程中,采用光学显微镜对发酵液中樟芝的不同形态进行观察。樟芝菌球内部结构观察采用切片方法:菌球从发酵产物中分离后用4 ℃的生理盐水进行漂洗,取一定数量的樟芝菌球于10%甲醛溶液中固定 24 h后用乙醇进行脱水并包埋于石蜡块中。然后用组织切片机将其切成5 μm薄片,薄片采用H&E染料染色。H&E染色步骤如下:溶解蜡(二甲苯洗3次,每次3 min;无水乙醇洗3次,每次3 min;95%乙醇洗2次,每次3 min;70%乙醇洗2次,每次3 min);Haematoxylin染色3 min;水洗10 min;Eosin染色1 min;70%乙醇洗1次,3 s;95%乙醇洗2次,每次3 s;无水乙醇洗2次,每次3 s; 二甲苯洗3次,每次3 s;盖片、阴干后以光学显微镜观察。
1.2.4 RCCD实验设计
前期单因素实验研究结果表明碳源、氮源、碳氮比和孢子接种浓度是影响樟芝生物量的显著因素。为了确定樟芝发酵的最佳培养基组成,本实验选用四因素三水平的旋转中心组合实验设计,实验设计表和实验结果见表1。
1.2.5 RSM模型的建立
采用Design Expert 7.1.0软件对表1中的实验数据进行回归分析,并通过最小二乘法拟合二次多项方程,建立二次回归模型[9]。该模型方程为:

其中Y为响应值 (生物量),β0、βi、βii和βij为方程系数,Xi和Xj为自变量编码值。多项式模型方程拟合的精度和泛化能力由回归系数R2表征。
1.2.6 ANN模型的建立
采用反向传播 (BP) 方法建立ANN模型。模型中含有输入层、隐含层和输出层,以表 1中樟芝孢子浓度和发酵培养基中葡萄糖、蛋白胨、黄豆粉的浓度为输入值,以发酵终止时樟芝生物量为输出值。隐含层和输出层的传递函数分别为 tansig函数和purelin函数,同时用trainbr算法训练网络,当均方误差 (MSE) 达到1×10−3时,网络停止训练。
为了评价模型的拟合能力和预测能力,分别计算所建立模型的均方根误差 (RMSE)、方差 (R2) 和预测标准误差 (SEP)[10]:

1.2.7 GA优化
本实验采用浮点编码的方式对发酵过程中孢子浓度、葡萄糖含量、蛋白胨含量和黄豆粉含量 4个因素在其各自取值范围内进行ANN模拟推算,并以模型拟合值作为遗传算法的适应性函数,进行选择、变异、交换操作。樟芝生物量越高,则适应度越高。程序通过MATLAB 7.6软件和其附带的GA遗传算法工具箱编写完成。
2 结果与分析
2.1 发酵过程中樟芝形态的观察
樟芝在摇瓶培养过程中的形态变化过程见图1。圆柱状的樟芝孢子 (2 μm×5~10 μm) (图1A) 接入新鲜培养基后开始萌发并形成丝状菌丝 (图1B),菌丝不断生长并相互缠绕形成蓬松的菌丝团 (图1C)。菌丝团进一步形成菌球 (直径0.5~2.0 mm) (图1D),随后以菌球的形式在摇瓶中至发酵结束。通过切片观察发现,菌球内外两层的菌丝密度不同,内层的菌丝较外层疏松 (图 1E),这可能是由于菌球内部传质、传氧受限所致[11]。樟芝发酵过程中孢子、菌丝、菌丝团、菌球的形态变化过程以及菌球内部的不均匀性都说明了樟芝发酵体系的复杂性,对其过程的建模需要采用RSM、ANN等非线性处理工具。

表1 RCCD实验设计表与实验结果Table 1 Design matrix and results obtained in RCCD

图1 发酵过程中樟芝的不同形态Fig. 1 Different morphological forms of Antrodia camphorata in submerged culture. (A) Spore. (B) Mycelia. (C) Mycelium regiment. (D) Pellets. (E) Section of Antrodia camphorata pellets.
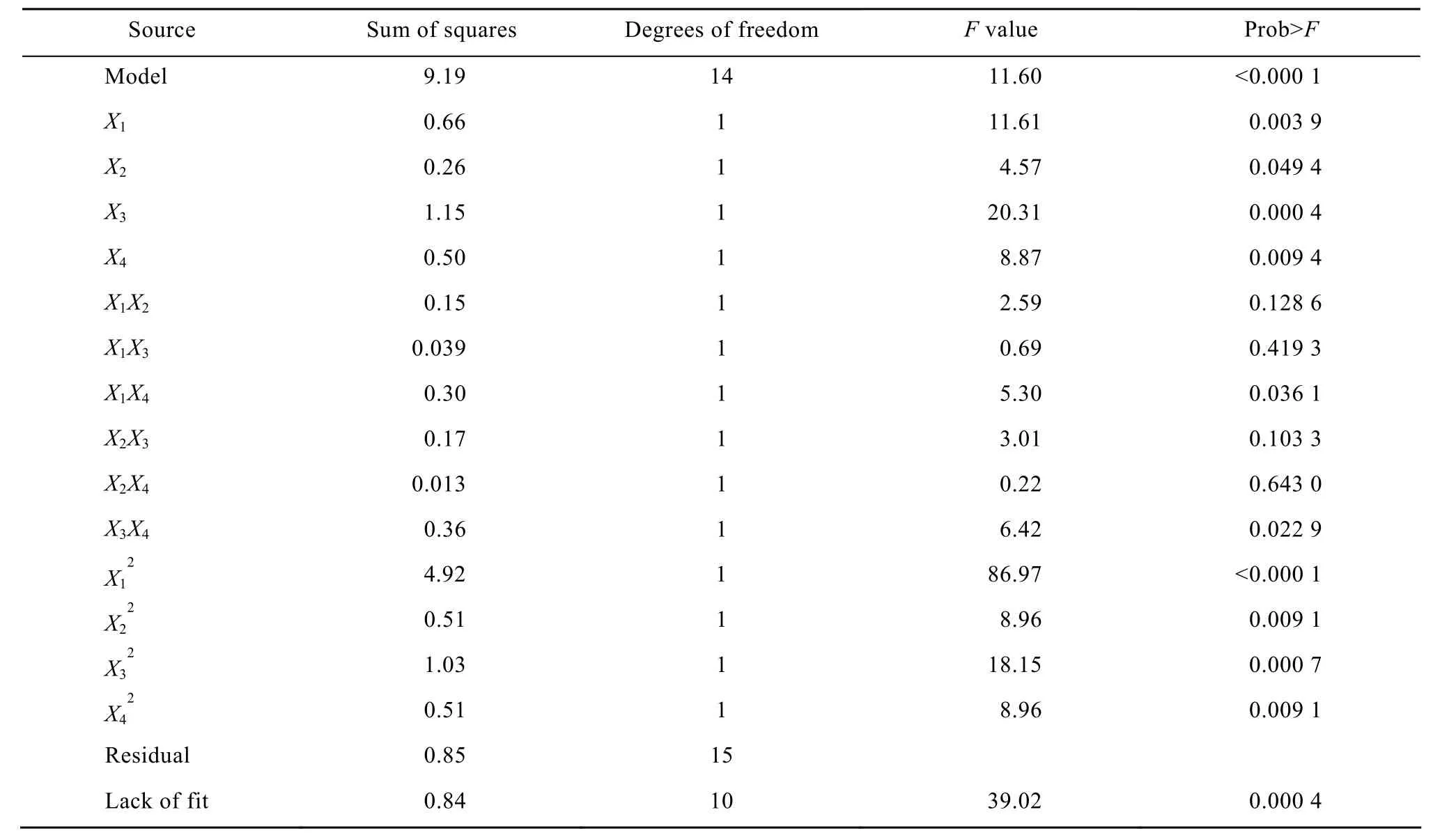
表2 二次模型的方差分析结果Table 2 ANOVA of the fitted quadratic model
2.2 响应面分析
利用Design-Expert软件对表1中的实验数据进行多元回归拟合,表 2为回归分析结果。回归方差分析显著性检验表明,该模型回归显著 (R2= 0.915 6),说明回归方程能够用于表1中实验数据的拟合。“lack of fit”值为0.000 4,说明模型预测值与实际值不拟合的概率为显著,因此二次模型可能难以充分描述樟芝的发酵过程。“Prob>F”值小于0.05说明该项在95%的置信区间内显著。本研究中,X1、X2、X3、X4、X12、X14、X24、X34、X12、X22、X32、X42是显著项,获得回归方程为:
Y=5.68–0.17X1+0.10X2+0.22X3+0.14X4+0.14X1X4+0.15X3X4–0.42X12–0.14X22–0.19X32–0.14X42。
2.3 人工神经网络建模
以表1中的实验数据作为BP神经网络的训练样本,根据实验因素的个数和优化指标的个数设计神经网络的结果,然后用实验数据对神经网络进行训练。为防止过拟合情况发生,在满足训练精度的情况下,中间隐层节点数目尽可能少选,本实验选择的隐含层节点数为 6。隐含层和输出层的传递函数分别为tansig函数和purelin函数,同时用trainbr算法训练网络,当均方误差达到1×10−3时,网络停止训练。实验结果表明,样本训练能较快地达到收敛(图2)。模型模拟结果与实验值的拟合度较好 (图3),两者之间的相对误差在 5%以内,说明建立的神经网络性能良好,不需要再添加训练样本。
2.4 RSM模型和ANN模型的比较
为了对建立的ANN模型和RSM模型进行比较,分别计算两种模型的RMSE、R2和SEP。结果表明ANN模型的 RMSE、R2和 SEP分别为 0.03、0.99和0.53%,而RSM模型的RMSE、R2和SEP分别为0.20、0.91和 4.06%。通常较高的RMSE和R2说明模型对实验数据拟合能力较好,而SEP越低则说明模型具有越好的预测能力和外推能力。与RSM模型相比,本实验中ANN模型对樟芝发酵过程的实验数据拟合的较好,并且具有更好的模型预测能力和外推能力。这可能是由于RSM模型建立的数学回归模型属于二次多项式,因此拟合能力有限,无法很好地反映樟芝发酵过程中各因素与指标之间的高度非线性关系。而ANN模型不需要像回归方程那样要预先给定函数,而是以实验数据为基础经过有限次的迭代计算而获得的一个反映实验数据内在联系的数学模型,具有极强的非线性处理能力。因此,本实验最终采用ANN模型作为GA优化的适度值函数,用于求出各个因素的最佳组合。
2.5 遗传算法优化
遗传算法是借鉴生物界自然选择和群体进化机制所形成的一种随机搜索算法,它以其高效、自适应及全局搜索的优势在很多领域中得到应用。它的搜索面广,寻优速度快,得到的结果能以较大概率接近全局最优解[12]。因此,通过遗传算法可以对ANN模型进行全局性的训练,最终得到最佳方案。本实验中,遗传算法寻优过程见图4。经过61次优化计算,遗传算法得到的樟芝生物量理论最大值为:6.2 g/L,并获得发酵最佳接种量及培养基组成:孢子浓度1.76×105个/mL,葡萄糖29.1 g/L,蛋白胨9.4 g/L,黄豆粉2.8 g/L。在该培养条件下,经过3次重复实验得到樟芝的生物量为 (6.1±0.2) g/L,说明ANN-GA预测的培养基组成起到了较好的实验效果。
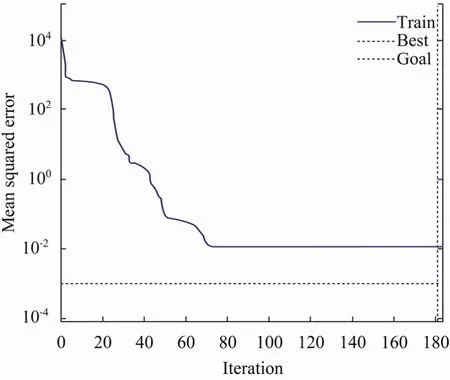
图2 BP神经网络训练过程Fig. 2 Training course of BP neural network.

图3 实验生物量和RSM、ANN模型预测生物量的比较Fig. 3 Comparison of experimental biomass and predicted biomass by RSM and ANN.

图4 遗传算法中最优适度值和平均适度值的变化过程Fig. 4 Evolution of the best and mean fitness in the GA.
3 结论
樟芝在生长过程中形态变化的多样性说明其发酵过程的复杂性和非线性。在本文所研究的体系中,成功应用ANN-GA方法描述了樟芝发酵培养基与生物量的关系,并由此模型预测了最佳生物量及培养基配方。ANN-GA方法不仅能有效地提高生物量,显著地降低培养基成本,而且可大大减少繁琐的实验工作量及缩短研究周期,这也为优化其他丝状真菌等的复杂非线性发酵过程提供了方法借鉴。
REFERENCES
[1] Wu SH, Ryvarden L, Chang TT. Antrodia camphorata (“niu-chang-chih”), new combination of a medicinal fungus in Taiwan. Bot Bull Acad Sin, 1997, 38: 273−275.
[2] Ao ZH, Xu ZH, Lu ZM, et al. Niuchangchih (Antrodia camphorata) and its potential in treating liver diseases. J Ethnopharmacol, 2009, 121(2): 194−212.
[3] Yang FC, Huang HC, Yang MJ. The influence of environmental conditions on the mycelial growth of Antrodia cinnamomea in submerged cultures. Enzyme Microb Technol, 2003, 33(4): 395−402.
[4] Chang CY, Lee CL, Pan TM. Statistical optimization of medium components for the production of Antrodia cinnamomea AC0623 in submerged cultures. Appl Microbiol Biotechnol, 2006, 72(4): 654−661.
[5] Lin ES, Chen YH. Factors affecting mycelial biomass and exopolysaccharide production in submerged cultivation of Antrodia cinnamomea using complex media. Biores Technol, 2007, 98(13): 2511−2517.
[6] Singh V, Khan M, Khan S, et al. Optimization of actinomycin V production by Streptomyces triostinicus using artificial neural network and genetic algorithm. Appl Microbiol Biotechnol, 2009, 82(2): 379−385.
[7] Almeida JS. Predictive non-linear modeling of complex data by artificial neural networks. Curr Opin Biotechnol, 2002, 13(1): 72−76.
[8] Sun MH, Liu XZ. Carbon requirements of some nematophagous, entomopathogenic and mycoparasitic Hyphomycetes as fungal biocontrol agents. Mycopathologia, 2006, 161(5): 295−305.
[9] Kumar P, Satyanarayana T. Optimization of culture variables for improving glucoamylase production by alginate-entrapped Thermomucor indicae-seudaticae using statistical methods. Bioresource Technol, 2007, 98(6): 1252−1259.
[10] Wang X, Xu P, Yuan Y, et al. Modeling for gellan gum production by Sphingomonas paucimobilis ATCC 31461 in a simplified medium. Appl Environ Microbiol, 2006, 72(5): 3367−3374
[11] Xu Q, Huang H, Li S, et al. Strategy of pellet formation of filamentous fungi in submerged fermentation. Food Sci Technol, 2009, 34(2): 13−17.徐晴, 黄和, 李霜, 等. 深层发酵中丝状真菌菌球形态控制的策略. 食品科技, 2009, 34(2): 13−17.
[12] Wang Y, Piao MZ, Sun YH. Genetic algorithm for fermentation kinetics of submerged fermentation by Morchella. Chin J Biotech, 2008, 24(8): 1454−1457.王莹, 朴美子, 孙永海. 基于遗传算法的羊肚菌液体发酵动力学模型的建立. 生物工程学报, 2008, 24(8): 1454−1457.
