甲醇浓度对毕赤酵母表达重组人复合α干扰素分离纯化得率的影响
2011-02-09吴丹储炬王永红庄英萍张嗣良
吴丹,储炬,王永红,庄英萍,张嗣良
1 江南大学食品科学与技术国家重点实验室,无锡 214122
2 华东理工大学生物反应器国家重点实验室,上海 200237
重组人复合 α干扰素 (cIFN) 是一种氨基酸序列重组的非天然存在的Ⅰ型α干扰素。是由Amgen公司的研究者对当时已知的13种人α干扰素的序列进行比较研究,把出现频率最高的氨基酸分配到各个相应的位置上,并对个别氨基酸进行了修改,得到了由166个氨基酸组成的复合α干扰素[1]。复合α干扰素集中了各种天然干扰素的优点,具有更强、更广谱的抗病毒作用,体外生物活性实验证明,cIFN的生物活性是其他两种常用干扰素 (IFN-α2a、IFN-α2b) 的5~10倍[2]。毕赤酵母表达系统是一种比较理想的真核微生物表达系统,兼有原核细胞的可操纵性和真核细胞的翻译后加工的双重优点,用其表达的重组蛋白更接近天然蛋白的构象,是外源基因表达的理想宿主[3]。另外毕赤酵母自身分泌的蛋白 (背景蛋白) 非常少,能以很高的纯度 (30%~80 %的胞外总蛋白) 表达分泌重组蛋白[4],这样能简化分离纯化工艺,对工业化生产十分有利。
甲醇既作为诱导剂诱导毕赤酵母表达外源蛋白,还同时作为碳源为酵母生长提供能量,因此甲醇的控制对外源蛋白的表达影响很大。目前有关甲醇影响酵母表达的研究主要集中在如何控制酵母生长和增加外源蛋白表达量上,如混合碳源流加[5],控制比生长速率流加[6],控制一定甲醇浓度流加[7]等。毕赤酵母表达蛋白时也会有信号肽加工不完全、形成聚合体、蛋白降解等特征导致目的蛋白表达的不均一性[8],造成目的蛋白的减少及后期分离纯化的困难。已有研究表明毕赤酵母表达重组人复合 α干扰素中pH[9]、诱导温度[10]等环境因素影响毕赤酵母胞外表达外源蛋白时发酵液中重组蛋白质稳定性,但是甲醇浓度影响酵母表达外源蛋白的稳定性鲜见报道。本课题组采用毕赤酵母工程菌在复合培养基中表达重组人复合α干扰素cIFN时,遇到不同的甲醇浓度下 cIFN的分离纯化得率差别非常大的现象。本文对这种现象进行了分析,发现在不同甲醇浓度下 cIFN的存在状态有很大的变化,较高甲醇浓度时大量的cIFN聚合会造成cIFN单体减少。本文着重分析了不同甲醇浓度和 cIFN稳定性之间的关系。
1 材料与方法
1.1 材料
1.1.1 菌株
毕赤酵母工程菌 Pichia pastoris GS115/ pPIC9-cIFN (R164S)。遗传表型Mut+his+,启动子为PAOX1,载体 pPIC9K,信号肽序列来自酿酒酵母Saccharomyces cerevisiae的α-MF,外源基因为编码重组人复合α干扰素的基因,载体呈线型整合在染色体上,该菌种由北京军事医学科学院刘志敏教授提供。
1.1.2 主要试剂
复合干扰素标品干复津购自美国Amgen公司,鼠抗人α干扰素单抗购自Abcam公司,羊抗鼠过氧辣根化酶购自华美生物工程公司,酵母提取物购自Oxiod公司,胰蛋白胨购自日本制药株式会社,酵母基本氮源 (YNB) 购自 Difco公司,疏水填料Phenyl-Sepharose FF、阴离子交换色谱填料 DEAE Sephadex A-25匍聚糖凝胶和离子交换色谱填料Sephacyal-HR200购自美国Amersham公司。其他化学试剂均为分析纯,购自国药集团化学试剂公司。
1.2 培养方法
1.2.1 种子培养方法
挑取YPG平板上的新鲜Pichia pastoris GS115/ pPIC9-cIFN (R164S) 单菌落,接入含有 50 mL BMGY种子培养基的500 mL三角瓶中,于30 ℃、220 r/min培养至OD为6~8时,将50 mL种子培养液全部接入5 L发酵罐中 (含1.8 L的复合培养基见1.2.3)。
1.2.2 5 L罐发酵培养
甘油生长期和过渡期温度控制30 ℃,pH为5.4,通过调节搅拌转速200~900 r/min之间来维持溶解氧(DO) 在 30%以上。当基础料中的甘油耗尽后,此时DO急剧上升,开始流加浓度为50%甘油,并以维持DO在40%为依据控制甘油补料速率,当细胞干重 (DCW) 到达30后停止补甘油。进入甲醇诱导期后,以在线甲醇电极 (华东理工大学,中国上海)监控发酵液中的甲醇残留浓度来控制甲醇流加速率,分别以 0.25%、0.5%、0.75%三个甲醇浓度进行研究。诱导期间维持DO>20%,当溶氧过低时通入富氧空气。通过氨水和酵母生长自身产酸控制甲醇诱导期的pH,诱导温度为25 ℃。
1.2.3 发酵培养基
复合培养基:酵母提取物 10 g/L,蛋白胨20 g/L,YNB 13.4 g/L,甘油28 g/L,消泡剂 289 0.2 g/L溶入0.1 mol/L (pH 6.0) 的磷酸缓冲液中。添加 1 mmol/L PMSF (Phenylmethanesulfonyl fluoride) 的丝氨酸蛋白酶抑制剂。
补料:50%的甘油,100%甲醇,分别加入PTM112 mL于每升补料溶液中。
1.3 分析方法
1.3.1 cIFN的分离纯化
先用 30%饱和度硫酸铵沉淀发酵液上清中的cIFN,沉淀离心后重新溶于 0.8 mol/L的硫酸铵(pH 8.3) 上样 Phenyl-Sepharose FF疏水柱,用0.5 mol/L 硫酸铵洗脱后透析,样品浓缩后上样DEAE Sephadex A-25阴离子交换柱,采用0.3 mol/L NaCl洗脱,收集含目的蛋白洗脱峰,浓缩后采用 Sephacyal-HR200分子筛柱层析进行最后脱盐纯化。
1.3.2 菌体浓度
取1 mL发酵液,12 000 r/min离心10 min,去上清液,用0.1 mol/L稀盐酸洗涤2次,离心后吸干表面水分称其湿重,80 ℃烘干至恒重称其干重。
1.3.3 目的蛋白cIFN浓度测定
将蛋白还原电泳结果经扫描输入计算机,以干复津为标准品,采用TotalLab v1.11凝胶图像处理软件分析,根据还原电泳条带染色强度进行定量分析。
1.3.4 蛋白电泳
凝胶配方和电泳操作过程参照《蛋白质电泳实验技术》[11]方法进行。还原电泳浓缩胶浓度为5%,分离胶浓度为15%;天然电泳浓缩胶浓度为3%,分离胶浓度为6%,考马斯亮蓝染色。
1.3.5 cIFN免疫印迹 (Western blotting)
电泳后的凝胶不进行染色,直接将上面的蛋白转到硝酸纤维膜上,先用50 mmol/L Tris-HCl (pH 7.6) 缓冲液洗涤,再用5%的脱脂奶粉 (PBST稀释,PBST:0.01 mol/L PBS+0.05% Tween,pH 7.5) 作为封闭液封闭,再用含有1∶1 000的鼠抗人α干扰素单抗室温反应2 h,洗涤后用含有1∶500羊抗鼠过氧辣根化酶室温反应2 h,洗涤后最后用新鲜制备的底物二氨基联苯胺溶液 (DAB溶液) 显色5 min,用去离子水冲洗终止显色反应。
1.3.6 生物活性测定
生物活性测定:采用细胞病变抑制法[12],采用WISH细胞/VSV系统测定。
2 结果
2.1 不同浓度甲醇诱导下细胞生长和表达情况分析
采用补料分批发酵控制策略,当细胞干重(DCW) 到达 30左右开始进入甲醇诱导期。用甲醇电极维持发酵液中甲醇浓度在 0.25%、0.5%和0.75%三个值来控制甲醇的流加。由于甲醇用来诱导和同时提供碳源,因此甲醇浓度越高细胞生长越快 (图1A)。酵母对cIFN的表达量也显示出类似的趋势,甲醇的浓度越高,表达水平越高,诱导66 h后0.25%、0.5%和0.75%甲醇浓度对应的cIFN表达水平分别为1.66、1.87和2.06 g/L。图1可以看出利用毕赤酵母高效表达 cIFN时重组蛋白的分泌同细胞的生长紧密相连,细胞生长则cIFN含量增加,细胞停止生长时cIFN含量也保持不变,这在甲醇浓度为 0.75%时表现尤为明显。当然甲醇浓度也并非越高越好,超过一定浓度反而对细胞造成毒害作用。在本研究中,如果单从表达量来看,0.75%甲醇浓度似乎是表达cIFN的最佳甲醇浓度。
2.2 不同浓度甲醇诱导下cIFN分离纯化分析
毕赤酵母分泌性表达外源蛋白的优势之一就是其自身内源性蛋白很少分泌到发酵液中,这非常有利于后期重组蛋白的分离纯化工作。然而在本研究中很奇怪的是,诱导66 h后在0.75%高甲醇浓度下虽然cIFN表达量最高,但是其分离纯化的得率却非常低,反之,虽然0.25%的低甲醇浓度下cIFN表达量有所下降,但是其得率很高,最终获得的cIFN纯品反而要大大高于0.75%的甲醇浓度所诱导 (表1)。分析表 1数据,发现在高甲醇浓度下,疏水层析这一步损失很大,得率只有 25.2%,相比之下低甲醇浓度的这一步得率则达到 87.5%。只有在高甲醇浓度诱导下发酵液中 cIFN的性质改变才可能导致这种较大的纯化损失。为了进一步验证这种可能性,我们又继续分析了各自发酵液的cIFN生物活性,结果发现高甲醇浓度诱导下发酵液中 cIFN比活仅为低甲醇浓度下的七分之一 (表 2)。这些研究结果显示,虽然在0.75%甲醇浓度下cIFN表达量最高,但是其发酵液比活最低,有可能在高甲醇浓度下cIFN不是以单体状态存在,考虑到前人发现在较高温度下诱导容易产生cIFN聚合体[10],我们推测在高甲醇浓度条件下发酵液中 cIFN也可能大部分以聚合体形式存在。
2.3 不同浓度甲醇诱导下cIFN稳定性分析
2.3.1 共价聚合情况分析
从图2非还原和还原SDS-PAGE电泳免疫印迹比较,在非还原条件下泳道 1~3均可以看到 cIFN聚合体,只是各自的聚合程度有很大差别。代表0.75%高甲醇浓度诱导的泳道1有低聚体、三聚体、二聚体和单体,代表0.5%甲醇浓度诱导的泳道2可以看出明显的二聚体和三聚体,而代表 0.25%低甲醇浓度诱导的泳道 3中只能看到微量的二聚体。由此可见,不同诱导甲醇浓度对cIFN的稳定性有很大影响,高甲醇浓度下cIFN不稳定,容易形成各种聚aAmmonium sulfate precipitation;bPhenyl-Sepharose FF chromatography;cDEAE Sephadex A-25 chromatography;dSephacyal-HR200 chromatography;ePurified cIFN per liter supernatant.合体,而低甲醇浓度下cIFN稳定性明显要好。将同样的样品进行还原SDS-PAGE电泳分析,从泳道4~6可以看出经过还原电泳后所有在非还原状态下存在的聚合体均消失。非还原电泳只能打开由疏水作用、氢键、静电作用、范德华力等非共价键结合的作用力,而还原电泳还可以打开非还原电泳不能打开的二硫键,说明非还原电泳图上显示的各种聚合体是通过二硫键结合的。cIFN单体含有2对分子内二硫键,在还原电泳中由于二硫键破坏蛋白质结构处于松散状态,影响其电泳泳动速率,所以其表观分子量要大于非还原电泳,导致对应的Western blotting上的单体位置有微小差别。
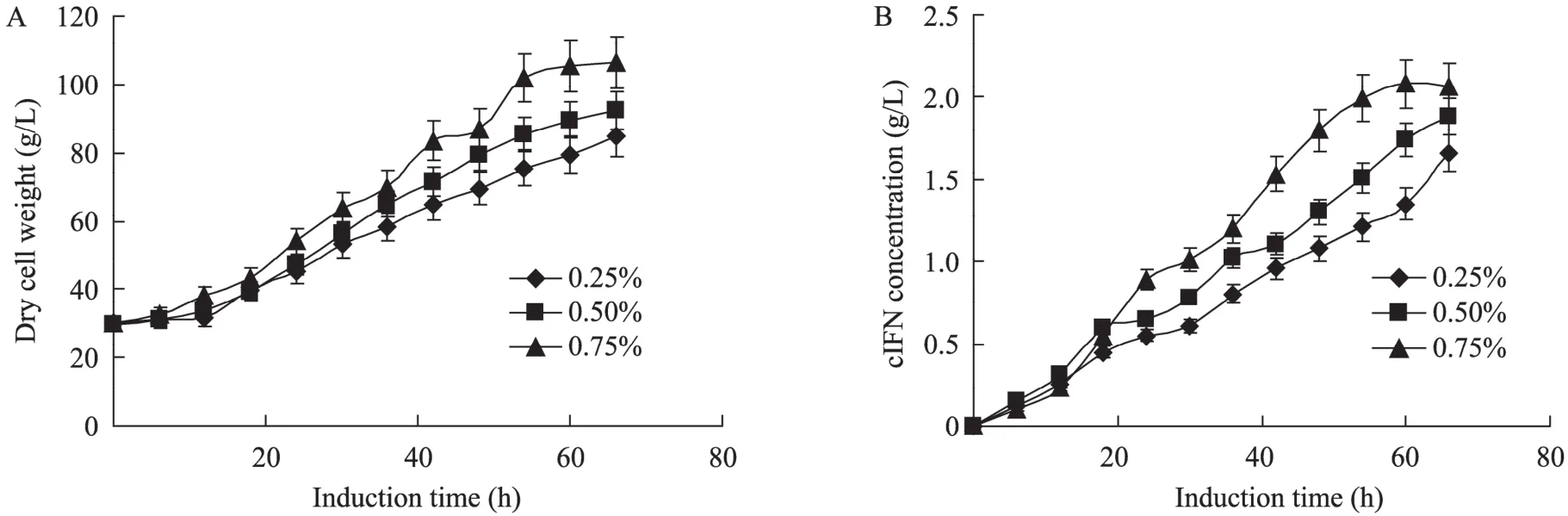
图1 不同诱导甲醇浓度下细胞生长 (A) 和cIFN表达量 (B) 分析Fig. 1 Effect of different methanol concentrations on cell growth (A) and cIFN expression level (B). Error bars stand for standard deviation (SD).
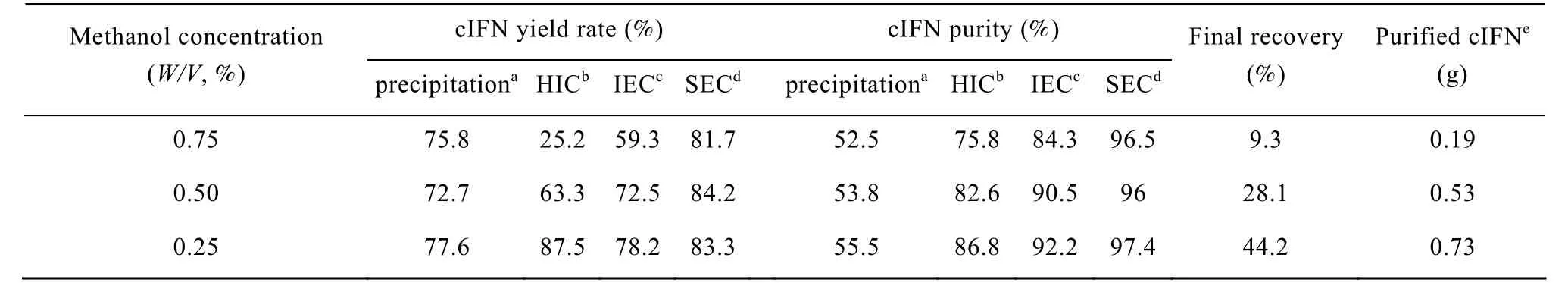
表1 不同诱导甲醇浓度下发酵液cIFN分离纯化分析Table 1 Effect of different methanol concentrations on the purification yield rate of cIFN
表2 不同浓度甲醇诱导下发酵液cIFN活性分析Table 2 Effect of different methanol concentrations on cIFN bioactivity ± s)
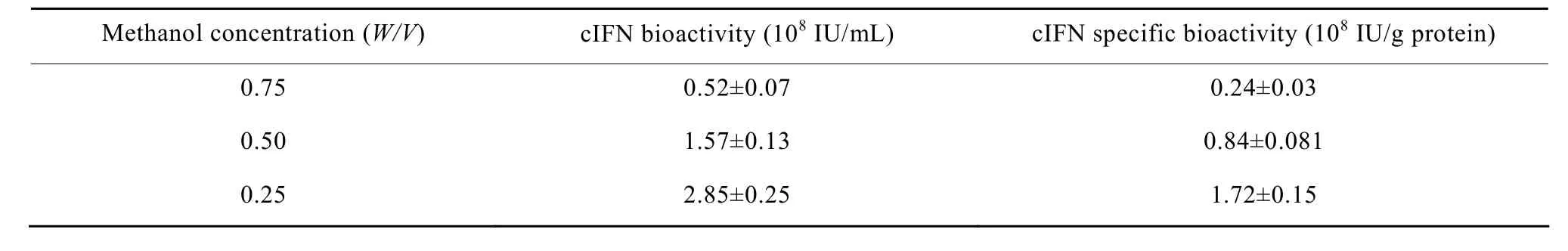
表2 不同浓度甲醇诱导下发酵液cIFN活性分析Table 2 Effect of different methanol concentrations on cIFN bioactivity ± s)
Methanol concentration (W/V) cIFN bioactivity (108 IU/mL) cIFN specific bioactivity (108 IU/g protein) 0.75 0.52±0.07 0.24±0.03 0.50 1.57±0.13 0.84±0.081 0.25 2.85±0.25 1.72±0.15
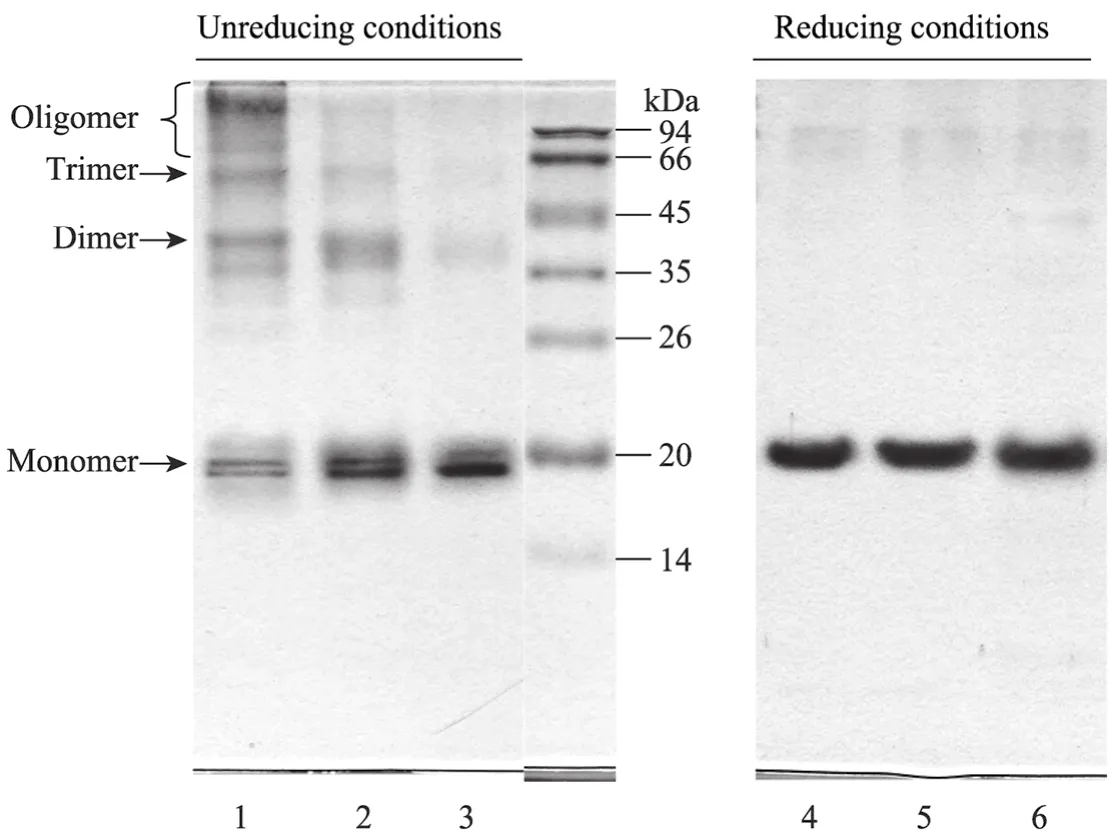
图2 不同浓度甲醇诱导下上清液非还原和还原SDS- PAGE免疫印迹Fig. 2 Western blotting of non-reducing and reducing SDS-PAGE under different methanol concentrations. 1, 4: 0.75%; 2, 5: 0.5%; 3, 6: 0.25%.
另外一个还值得引起注意的现象是,在图2泳道1中发现明显的cIFN双带,泳道2中较为明显,泳道3中基本上不明显,与此对应的,泳道1二硫键共价聚合最严重,泳道2次之,泳道3基本无聚合;经过还原电泳后泳道1和2中的cIFN (分别对应泳道3和4) 双带完全成为一条带,说明cIFN双带很可能是二硫键结构不完整的cIFN造成的,正是这种不完整 cIFN的存在导致了发酵液中共价键聚合体的产生。
另外,为了区别是否是甲醇浓度变化影响cIFN二硫键结构从而造成其共价聚合体,我们对含标准cIFN单体 (1 g/L) 的0.25%,0.5%和0.75%浓度甲醇溶液进行搅拌过夜,再用非还原SDS-PAGE分析其聚合体的产生情况。从图3可以看出,加入cIFN到不同甲醇浓度溶液后搅拌均匀马上取样 (泳道1~3) 和搅拌过夜后再取样 (泳道 4~6) 的非还原电泳图上没有看到任何聚合体条带,同图 2非还原SDS-PAGE图中cIFN聚合体形成明显对比。此结果清晰地显示甲醇浓度变化不会引起 cIFN结构发生改变,从而也无法形成各种cIFN聚合体。
2.3.2 非共价聚合情况分析
在 Native-PAGE免疫印迹中,0.75%高甲醇浓度诱导下的发酵液样品中的 cIFN单体呈现出微弱的条带 (图4,泳道1),在0.5%甲醇浓度cIFN单体条带加深 (图4,泳道2),而在0.25%甲醇情况下电泳显示出较浓的cIFN单体条带 (图4,泳道3)。不同的是,cIFN单体上方的聚合体拖尾条带呈现出相反的状况,在高甲醇浓度诱导下出现明显的聚合体 (图4,泳道1)。Tween-80是一种非离子表面活性剂,可以打开蛋白质非共价聚合体而转变为单体[13]。为了证明这些聚合体是非共价聚合体,在发酵液中加入Tween-80后再进行同样电泳 (图4,泳道4~6),结果显示所有样品的拖尾程度均明显变轻,而泳道中的cIFN单体的浓度则明显增加,说明发酵液上清中存在有非共价聚合体。对图4泳道1和4样品的cIFN生物活性测定也显示,加入 Tween-80后可以使发酵液活性提高了63%,进一步说明加入Tween后cIFN非共价聚被打开而使单体含量提高。
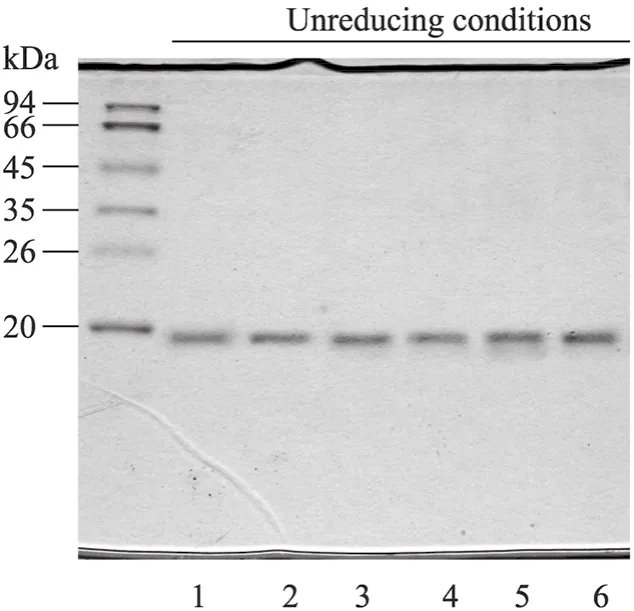
图3 不同浓度甲醇溶液中cIFN稳定性非还原SDS-PAGE分析.Fig. 3 Western blotting of non-reducing SDS-PAGE at different methanol concentration solutions. 1, 4: 0.75%; 2, 5: 0.5%; 3, 6: 0.25%. 1−3: samples taked at time of cIFN adding into methanol solution; 4−6: samples taked after 12 h at time of adding into methanol solution.
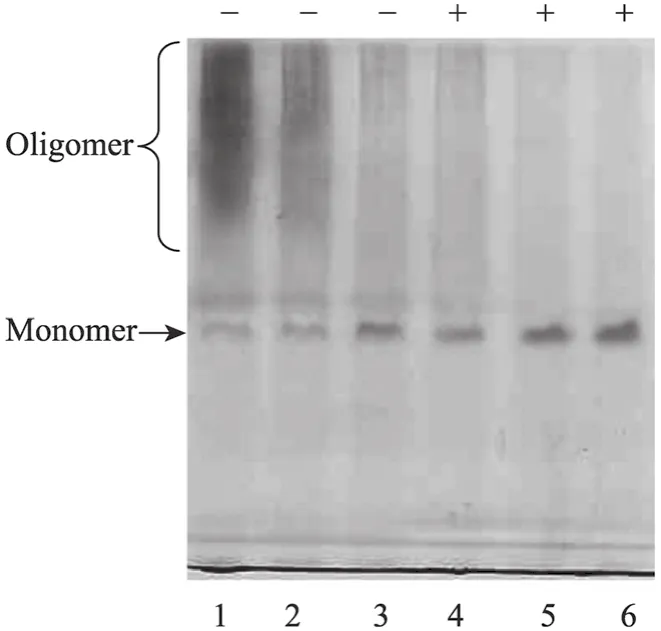
图4 Tween-80处理前后 3种甲醇浓度诱导下发酵液上清Native-PAGE免疫印迹Fig. 4 Native-PAGE of supernatant treated without Tween-80 (−) and with Tween-80 (+) under three different methanol concentrations. 1, 4: 0.75%; 2, 5: 0.5%; 3, 6: 0.25%.
3 讨论
虽然毕赤酵母现在越来越广泛用于表达各种外源蛋白,但是重组蛋白质尤其是具有复杂二硫键结构的蛋白质在发酵液中不稳定的现象一直是个难题[14-15]。甲醇浓度是毕赤酵母发酵调控中的一个很重要的参数,研究都集中在如何优化甲醇浓度来提高重组蛋白的产量,却忽视了它影响重组蛋白的稳定性的可能。本研究首次发现高甲醇浓度诱导虽然可以提高重组蛋白质的表达量,但是却容易导致重组蛋白质的聚合,虽然表达量很高,但是分离纯化的得率却很低,最终极大地降低了生产效率。本文提示今后在进行毕赤酵母发酵放大过程中,需要转变优化甲醇浓度仅仅为提高表达量的思路,还应该将甲醇浓度可能会影响重组蛋白质的稳定性纳入发酵优化考虑的范围。
二硫键对稳定蛋白质空间结构起非常重要的作用。当蛋白质分子内二硫键打开时,游离的-SH基团会在蛋白质分子间形成二硫键,这样就形成了各种二硫键共价聚合体。由于蛋白质大部分疏水基团埋在分子内部,二硫键的破坏也会使分子内疏水基团暴露出来,这样也容易导致蛋白质分子间形成疏水性的非共价聚合体[16]。本研究中cIFN形成共价聚合和疏水聚合也正是蛋白质分子内二硫键遭到破坏的结果。但关键的问题是,cIFN中二硫键是如何遭到破坏的?一般认为发酵过程中长时间的高速搅拌和气液介面等物理条件作用会破坏蛋白质高级结构而导致聚合体产生[17]。本研究中,首先排除了由于甲醇浓度变化引起的cIFN二硫键结构变化。进一步分析在 0.25%低甲醇浓度诱导发酵过程中的转速及通气量和 0.75%的高诱导甲醇浓度相似,但是在低甲醇浓度下却可以有效避免聚合体的产生,说明cINF的聚合同搅拌等外界因素没有直接关系,这为今后研究毕赤酵母发酵过程中重组蛋白质聚合体的来源提供了一个全新的视角。由于甲醇既是细胞利用的碳源又是诱导剂,所以甲醇浓度的变化很容易使细胞的生理发生改变。Mayson等发现在1%甲醇浓度下细胞生长迅速,但是最佳的表达量却是在0.7%甲醇时获得的[18]。我们推测,高甲醇浓度下细胞生长明显要快于低甲醇浓度,这样必然会占用大量的细胞伴侣蛋白如Bip和PDI等以优先合成高速生长下自身需要的各种内源性蛋白[19],如果此时外源蛋白再大量表达,很有可能折叠不完全或者只生成部分二硫键,而这种错误折叠的蛋白质分泌到胞外后会对重组蛋白的稳定性造成影响,该推论还需要进一步实验来证实。
本文通过还原和非还原SDS-PAGE已经发现发酵液中有含不完整二硫键的cIFN存在,接下来要做的工作是需要确定这些不完整的 cIFN中遭到破坏的是一对二硫键还是两对全部都被破坏,因为二硫键的破坏程度不同对其稳定性的影响也不同。另外又是何种因素导致了这些二硫键不完整的 cIFN的产生?这些研究将能进一步揭示毕赤酵母发酵过程中重组蛋白不稳定的根源,为毕赤酵母发酵调控提供新的理论依据。
REFERENCES
[1] Alton K, Stabinsky Y, Richards R, et al. Production, characterization and biological effects of recombinant DNA derived human IFN-α and IFN-β analogs//De Maeyer E, Schellekens H, eds. The Biology of the Interferon System. Amsterdam: Elsevier, 1983: 119−128.
[2] Blatt LM, Davis JM, Klein SB, et al. The biologic activity and molecular characterization of a novel synthetic interferon-alpha species, consensus interferon. J Interferon Cytokine Res, 1996, 16(7): 489−499.
[3] Cregg JM, Tolstorukov I, Kusari A, et al. Expression in the yeast Pichia pastoris. Methods Enzymol, 2009, 463: 169−189.
[4] Wan N, Hoppe HI, Goodrick JC, et al. Expression system for recombinant proteins: EP 1409695A2. 2004-04-21.
[5] Jungo C, Schenk J, Pasquier M, et al. A quantitative analysis of the benefits of mixed feeds of sorbitol and methanol for the production of recombinant avidin with Pichia pastoris. J Biotechnol, 2007, 131(1): 57−66.
[6] Zhang WH, Bevins MA, et al, Plantz BA. Modeling Pichia pastoris growth on methanol and optimizing the production of a recombinant protein, the heavy-chain fragment C of botulinum neurotoxin, serotype A. Biotechnol Bioeng, 2000, 70(1): 1−8.
[7] Schenk J, Marison IW, von Stockar U. A simple method to monitor and control methanol feeding of Pichia pastoris fermentations using mid-IR spectroscopy. J Biotechnol, 2007, 128(2): 344−353.
[8] Wang HH, Gao BY, Chen PL, et al. The analysis and countermeasure of heterogeneity of cIFN expressed in yeast. Sci China: Seri B, 1994, 24(12): 1270−1274.王洪海, 高卜渝, 陈佩丽, 等. 酵母表达基因工程产物不均一性分析及其对策. 中国科学 B辑, 1994, 24(12): 1270−1274.
[9] Zhang S, Hao YY, Chu J, et al. Effect of pH on proteolytic degradation of consensus interferon-α expressed by Pichia pastoris. Chin J Biotech, 2008, 24(1): 164−168.张盛, 郝玉有, 储炬, 等. pH对毕赤酵母表达重组人复合 α干扰素的降解影响. 生物工程学报, 2008, 24(1): 164−168.
[10] Shi QQ, Hao YY, Wu KH, et al. The effect of induction temperature on aggregation of consensus interferon-α expressed by Pichia pastoris. Chin J Biotech, 2006, 22(2): 311−315.史淇淇, 郝玉有, 吴康华, 等. 诱导相温度对毕赤酵母表达重组人复合 α干扰素聚合的影响. 生物工程学报, 2006, 22(2): 311−315.
[11] Guo RJ. The Laboratory Technology of Protein Electro-Phoresis. Beijing: Science Press, 1999.郭尧君. 蛋白质电泳实验技术. 北京: 科学出版社, 1999.
[12] Chinese Biologic Product Standardization Committee Compiled. Chinese Biological Product Regulations. Beijing: Chemical Industry Press, 2000.中国生物制品标准化委员会编. 中国生物制品规程. 北京: 化学工业出版社, 2000.
[13] Wang W, Wang YJ, Wang DQ. Dual effects of Tween 80 on protein stability. Int J Pharmaceut, 2008, 347(1/2): 31−38.
[14] Wu D, Hao YY, Chu J, et al. Inhibition of degradation and aggregation of recombinant human consensus interferon-amutant expressed in Pichia pastoris with complex medium in bioreactor. Appl Microbiol Biotechnol, 2008, 80: 1063−1071.
[15] Hao YY, Chu J, Wang YH, et al. Expressionand aggregation of recombinant human consensus interferon-α mutant by Pichia pastoris. Biotechnol Lett, 2006, 28(12): 905−909.
[16] Bhattacharyya R, Pal D, Chakrabarti P. Disulfide bonds, their stereospecific environment and conservation inprotein structures. Protein Eng Des Sel, 2004, 17(11): 795−808.
[17] Woo JH, Liu YY, Neville DM Jr. Minimization of aggregation of secreted bivalent anti-human T cell immunotoxin in Pichia pastoris bioreactor culture by optimizing culture conditions for protein secretion. J Biotechnol, 2006, 121: 75−85.
[18] Mayson BE, Kilburn DG, Zamost BL, et al. Effects of methanol concentration on expression levels of recombinant protein in fed-batch cultures of Pichia methanolica. Biotechnol Bioeng, 2003, 81(3): 291−298.
[19] Xu P, Raden D, Doyle FJ III, et al. Analysis of unfolded protein response during single-chain antibody expression in Saccaromyces cerevisiae reveals different roles for BiP and PDI in folding. Metab Eng, 2005, 7(4): 269−279.
