烟酰胺腺嘌呤二核苷酸合成相关酶有助于1,4-丁二醇转化为4-羟基丁酸
2011-02-09张鑫陈国强
张鑫,陈国强
清华大学生命科学学院,北京 100084
4-羟基丁酸 (4-hydroxybutyrate,4HB) 作为神经递质是 γ-氨基丁酸的代谢物,以很低的含量存在于哺乳动物大脑中,在医学、药学领域里被认为是一种神经递质,对于自我平衡调整和产生有规律的睡眠等方面起着非常重要的作用[1]。4-羟基丁酸可经氧化转变为琥珀酸半醛、琥珀酸,最终进入三羧酸循环而被代谢降解[2-3]。琥珀酸半醛脱氢酶缺陷的患者会在体液中积累很高浓度的 4-羟基丁酸,并表现出迟钝、癫痫等症状[4]。4-羟基丁酸具有与盐酸氯胺酮类似的麻醉效果,且能刺激体内荷尔蒙素的分泌,因而被归为管制药品[5-6]。
4-羟基丁酸的另一常见用途是作为生物塑料聚3-羟基丁酸酯 4-羟基丁酸酯 (P3HB4HB) 的合成前体,它在共聚物中的比例直接影响着最终P3HB4HB的材料学性质和降解性[7-11]。尽管 4-羟基丁酸可在厌氧菌克氏梭菌Clostridium kluyveri对乙醇、乙酸发酵过程中产生[12],也存在于古细菌勤奋金属球菌Metallosphaera sedula等的 3-羟基丁酸/4-羟基丁酸固碳途径中[13],却不能在罗氏真养菌 Ralstonia eutropha、大肠杆菌Escherichia coli等常用的PHA合成菌中形成。因此需要添加结构相关碳源,如 4-羟基丁酸、γ-丁内酯或者1,4-丁二醇作为4-羟基丁酸的来源[14-17],这些添加物主要以石化产品为原料经化学转化制备[18-20]。
张磊等利用来源于恶臭假单胞菌 Pseudomonas putida KT2442的醇脱氢酶 (DhaT) 和醛脱氢酶(AldD) 催化完成 1,4-丁二醇向 4-羟基丁酸的转化[21]。这里DhaT和AldD的催化作用需要辅酶因子NAD的参与 (图1)。
对辅酶因子的调节是代谢工程改造中的一个重要手段,提高胞内NADH水平已成功用于促进合成还原性产物如1,3-丙二醇[22]、琥珀酸[23]、丁醇[24]等。同理,提高胞内NAD含量可能促进1,4-丁二醇向4-羟基丁酸的转化。烟酸磷酸核糖转移酶 (Nicotinic Acid Phosphoribosyltransferase,PncB) 和NAD合成酶 (NAD Synthetase,NadE) 是大肠杆菌NAD合成途径的两个关键酶,单独表达时均使胞内NAD (H)总量提高约 2.5倍,共表达时能够提高近 7倍,且NAD增加量要多于 NADH增量[25]。因此,本研究通过在 E. coli S17-1 (pZL-dhaT-aldD) 中共表达pncB-nadE基因,提高1,4-丁二醇向4-羟基丁酸的转化效率。
1 材料与方法
1.1 菌株、质粒与引物
菌种Escherichia coli S17-1为清华大学微生物实验室保存。质粒 pZL-dhaT-aldD由本实验室前期构建[21]。本文所用菌种、质粒及引物序列见表1。
fastpfu DNA聚合酶以及用于基因克隆的E. coli DH5α为北京全式金生物技术有限公司产品。各种限制性内切酶为Fermentas产品。质粒提取、胶回收试剂盒为博迈德公司产品。
1.2 培养基及培养条件
质粒构建过程以及摇瓶种子液均采用 LB培养基。摇瓶发酵培养基为另外添加了10 g/L 1,4-丁二醇的 LB培养基。根据重组菌携带质粒的抗性向灭菌冷却后的培养基中加入抗生素,其中氨苄青霉素浓度为100 mg/L,卡那霉素浓度为50 mg/L。
培养条件为37 ℃,200 r/min。除摇瓶发酵培养时间为48 h外,其余情况均培养12 h。

图1 1,4-丁二醇向4-羟基丁酸的转化反应Fig. 1 Conversion of 1,4-BD to 4HB.

表1 本研究中所使用的菌种、质粒和引物Table 1 Strains, plasmids and primers used in this study
1.3 NAD (H) 含量测定
按照已报道方法提取胞内NAD和NADH[22],略有修改。将3 mL摇瓶发酵菌液于4 ℃离心收集细胞,弃上清。将细胞用冰冷的去离子水洗涤2次后充分重悬于0.2 mL去离子水中。加入50 μL 0.4 mol/L HCl (提取NAD) 或者0.4 mol/L KOH (提取NADH),充分混匀后在冰上放置10 min。NAD提取液在50 ℃水浴,NADH提取液在30 ℃水浴。10 min后迅速移到冰上加入50 μL 0.4 mol/L KOH (提取NAD) 或者0.4 mol/L HCl (提取NADH) 进行中和。4 ℃、12 000 r/min离心10 min。上清液即为NAD (H) 的提取液,将其移至新的离心管中,立即检测。
含量测定采用酶循环法,反应体系为 (1 mL):450 μL HEPES 缓冲液 (4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid,0.15 mol/L,pH 7.4);200 μL 5-乙基吩嗪硫酸盐 (PES,4 mg/mL);200 μL噻唑蓝 (MTT,5 g/L);50 μL乙醇;50 μL的600 U/mL乙醇脱氢酶 (ADH)。上述反应液混匀后37 ℃温育5 min,加入50 μL的NAD (H) 的提取液起始反应。测定5 min内OD570的变化。吸光度-时间曲线的斜率反应出提取液中NAD (H) 的浓度。
1.4 分析方法
1.4.1 细胞干重的测定
培养结束后,12 000 r/min、10 min离心收集菌体,然后用去离子水洗涤、离心,去掉菌体表面粘附的培养基成分。将得到的细胞在抽真空条件下冰冻干燥至恒重,测定细胞干重 (Dry cell weight,DCW)。
1.4.2 产物浓度的测定
4-羟基丁酸的分析方法参考文献[21],取菌液离心后上清进行冰干、酯化和气相色谱分析。
2 结果与分析
2.1 pncB/nadE基因表达质粒的构建
以E. coli MG1655基因组DNA为模板,表1中相应引物用 fastpfu DNA聚合酶对基因 pncB和nadE进行PCR扩增。反应程序:95 ℃预变性2 min;95 ℃变性20 s,58 ℃复性20 s,72 ℃延伸45/30 s,30个循环;最后72 ℃延伸8 min。
将pncB/nadE基因的PCR回收片段和表达载体pEn分别进行 Sac Ⅰ/Xba Ⅰ酶切,连接后化学法转入E. coli DH5α感受态中,阳性克隆经EcoR Ⅰ/Xho Ⅰ双酶切,得到目的基因表达单元和载体骨架两条带 (图2),证明质粒pEnpncB和pEnnadE构建成功。再用Avr Ⅱ/Xho Ⅰ酶切pEnnadE,回收nadE表达单元一段,将其插入经Nhe Ⅰ/Xho Ⅰ酶切的pEnpncB中,因为Avr Ⅱ和Nhe Ⅰ是同尾酶,因此两片段可相连得到质粒pEnpncBnadE。经Xba Ⅰ酶切验证正确后与质粒 pZL-dhaT-aldD一起经电击法转入E. coli S17-1感受态,获得重组菌株。已有报道,基于 pBBR1MCS2所构建的质粒能够与pMD19-T Simple的衍生质粒共存[26],因此,这里的pZL-dhaT-aldD和 pEnpncBnadE能够协同作用。进一步质粒提取证实了两质粒的相容性。
2.2 重组菌摇瓶发酵结果
以E. coli S17-1 (pZL-dhaT-aldD) 为参照,验证PncB-NadE表达对1,4-丁二醇转化的影响 (表2)。
野生型大肠杆菌也能由 1,4-丁二醇合成少量4-羟基丁酸,却不能进一步代谢利用 4-羟基丁酸[16,21,27]。另外,基因dhaT和 (或) aldD在嗜水气假单胞菌 Aeromonas hydrophila 4AK4与 E. coli S17-1中显示出相似的作用效果,而 A. hydrophila 4AK4 (pZL-dhaT-aldD) 的55 h发酵结果显示4-羟基丁酸积累量不断上升[21]。可推断E. coli S17-1重组菌的 4-羟基丁酸积累量以及 1,4-丁二醇的消耗量在发酵过程中应是逐渐增大的,因此,这里以48 h发酵后的结果作为讨论依据。
对照组E. coli S17-1 (pZL-dhaT-aldD) 由10 g/L的 1,4-丁二醇合成 4.31 g/L 4-羟基丁酸,转化率(mol/mol%) 为36.44%。而同条件下,E. coli S17-1 (pZL-dhaT-aldD,pEnpncBnadE) 则得到4.87 g/L 4-羟基丁酸,1,4-丁二醇的转化率为 41.18%,比对照组提高13.03%。计算单位细胞量的4-羟基丁酸产率能够更直接说明PncB-NadE的作用。对照组单位细胞产率为1.32 g/g,实验组相应值为1.86 g/g。综上结果,PncB-NadE的共表达明显促进4-羟基丁酸的合成。
尽管如此,仍有近60%的1,4-丁二醇未被利用,这是因为醇脱氢酶 (DhaT) 对1,4-丁二醇活性不高,且发酵后期会进一步减弱[21],所以,需要筛选出更有效的酶来催化反应以充分利用1,4-丁二醇。
此外,PncB-NadE的表达同时导致细胞干重下降。可能是因为胞内NAD的增加导致氧化还原态失衡,影响了细胞的正常代谢。细胞总量减少是转化率不能充分提高的另一原因,可通过添加葡萄糖等有利碳源来刺激细胞生长,进而增加 1,4-丁二醇利用率。

图2 质粒pEnpncB、pEnnadE、pEnpncBnadE的酶切图谱Fig. 2 Characterization of pEnpncB, pEnnadE, pEnpncBnadE. M: 1 kb DNA marker; p: pEnpncB digested with EcoR I/Xho I, two brands were 1 532 bp and 2 706 bp; n: pEnnadE digested with EcoR I/Xho I, two brands were 1 173 bp and 2 706 bp; pn: pEnpncBnadE digested with Xba I, two brands were 1 155 bp and 4 238 bp.

表2 重组菌摇瓶发酵生产4-羟基丁酸Table 2 Production of 4-hydroxybutyric acid by E. coli S17-1 (pZL-dhaT-aldD, pEnpncBnadE) and E. coli S17-1 (pZL-dhaT-aldD)
2.3 NAD (H) 含量测定
酶循环反应中吸光度-时间曲线的斜率正比于提取液中 NAD (H) 的浓度。结果证明 PncB-NadE的表达确实能提高胞内NAD (H) 浓度 (图3)。结合表2计算单位质量细胞内NAD和NADH含量变化,E. coli S17-1 (pZL-dhaT-aldD,pEnpncBnadE) 比E. coli S17-1 (pZL-dhaT-aldD) 中NAD和NADH含量分别提高2.04倍和2.74倍。
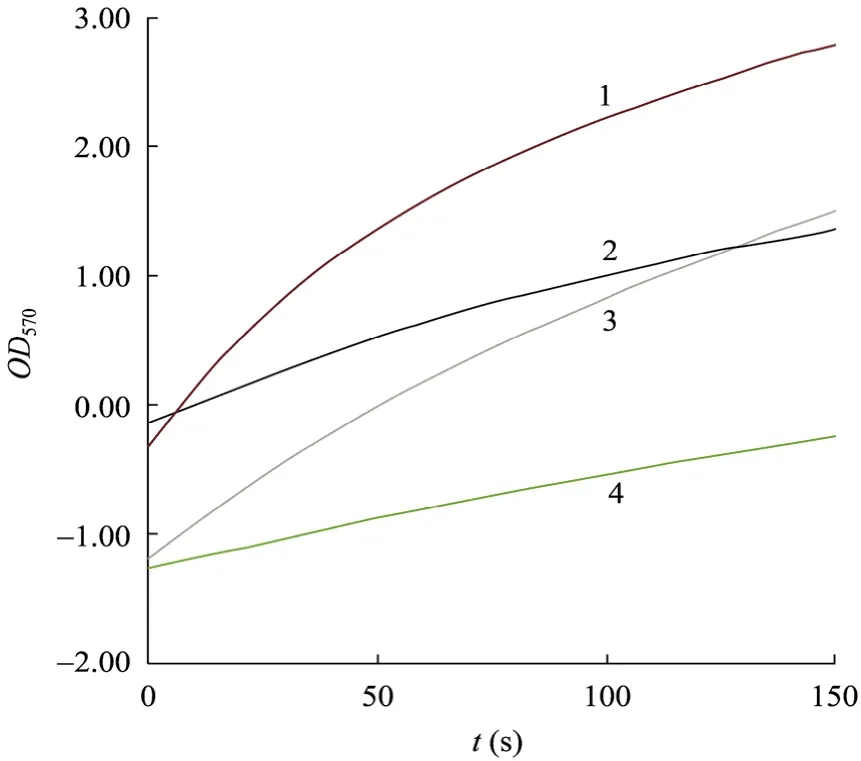
图3 重组菌NAD (H) 含量测定Fig. 3 Relative concentration of NAD (H) in different recombinants. 1: NAD (E. coli S17-1 (pZL-dhaT-aldD, pEnpncBnadE)); 2: NAD (E. coli S17-1 (pZL-dhaT-aldD)); 3: NADH (E. coli S17-1 (pZL-dhaT-aldD, pEnpncBnadE)); 4: NADH (E. coli S17-1 (pZL-dhaT-aldD)).
3 结论
REFERENCES
[1] Ye F, Dong FW. Review of analysis methods of γ-hydroxybutyrate and its derivatives. Merch Qual, 2011(S3): 156−157.叶峰, 董凤伟. γ-羟基丁酸及其相关物分析研究综述.商品与质量, 2011(S3): 156−157.
[2] Kaufman EE, Nelson T. An overview of γ-hydroxybutyrate catabolism: the role of the cytosolic NADP+-dependent oxidoreductase EC 1.1.1.19 and of a mitochondrial hydroxyacid-oxoacid transhydrogenase in the initial, rate-limiting step in this pathway. Neurochem Res, 1991, 16(9): 965−974.
[3] Wong CGT, Chan KFY, Gibson KM, et al. Gamma-hydroxybutyric acid: neurobiology and toxicology of a recreational drug. Toxicol Rev, 2004, 23(1): 3−20.
[4] Gibson KM, Hoffmann GF, Hodson AK, et al. 4-Hydroxybutyric acid and the clinical phenotype of succinic semialdehyde dehydrogenase deficiency, an inborn error of GABA metabolism. Neuropediatrics, 1998, 29(1): 14−22.
[5] Drasbek KR, Christensen J, Jensen K. Gamma-hydroxybutyrate-a drug of abuse. Acta Neurol Scand, 2006, 114(3):145−156.
[6] Efe C, Straathof AIJ, van der Wielen LAM. Options for biochemical production of 4-hydroxybutyrate and its lactone as a substitute for petrochemical production. Biotechnol Bioeng, 2008, 99(6): 1392−1406.
本次计算中取泊松比为υ=0.35,Ib=0.7,rm=12.5。室内试验测得的主固结完成后的剪切模量为G=0.664 MPa。
[7] Saito Y, Doi Y. Microbial synthesis and properties of poly (3-hydroxybutyrate-co-4-hydroxybutyrate) in Comamonas acidovorans. Int J Biol Macromol, 1994, 16(2): 99−104.
[8] Saito Y, Nakamura S, Hiramitsu M, et al. Microbial synthesis and properties of poly(3-hydroxybutyrateco-4-hydroxybutyrate). Polym Int, 1996, 39(3): 169−174.
[9] Ishida K, Wang Y, Inoue Y. Comonomer unit composition and thermal properties of poly(3-hydroxybutyrate-co-4-hydroxybutyrate)s biosynthesized by Ralstonia eutropha. Biomacromolecules, 2001, 2(4): 1285−1293.
[10] Doi Y, Kanesawa Y, Kunioka M, et al. Biodegradation of microbial copolyesters: poly(3-hydroxybutyrate-co-3-hydroxyvalerate) and poly(3-hydroxybutyrate-co-4-hydroxybutyrate). Macromolecules, 1990, 23(1): 26−31.
[11] Mukai K, Doi Y, Sema Y, et al. Substrate specificities in hydrolysis of polyhydroxyalkanoates by microbial esterases. Biotechnol Lett, 1993, 15(6): 601−604.
[12] Söhling B, Gottschalk G. Molecular analysis of the anaerobic succinate degradation pathway in Clostridium kluyveri. J Bacteriol, 1996, 178(3): 871−880.
[13] Berg IA, Kockelkorn D, Buckel W, et al. A 3-hydroxypropionate/4-hydroxybutyrate autotrophic carbon dioxide assimilation pathway in Archaea. Science, 2007, 318(5857): 1782−1786.
[14] Hiramitsu M, Koyama N, Doi Y. Production of poly(3-hydroxybutyrate-co-4-hydroxybutyrate) by Alcaligenes latus. Biotechnol Lett, 1993, 15(5): 461−464.
[15] Kunioka M, Kawaguchi Y, Doi Y. Production of biodegradable copolyesters of 3-hydroxybutyrate and 4-hydroxybutyrate by Alcaligenes eutrophus. Appl Microbiol Biotechnol, 1989, 30(6): 569−573.
[16] Hein S, Söhling B, Gottschalk G, et al. Biosynthesis of poly(4-hydroxybutyric acid) by recombinant strains of Escherichia coli. FEMS Microbiol Lett, 1997, 153(2): 411−418.
[17] Liu SJ, Steinbüchel A. A novel genetically engineered pathway for synthesis of poly(hydroxyalkanoic acids) in Escherichia coli. Appl Environ Microbiol, 2000, 66(2): 739−743.
[18] Efe C, Straathof AJJ, van der Wielen LAM. Options for biochemical production of 4-hydroxybutyrate and its lactone as a substitute for petrochemical production. Biotechnol Bioeng, 2008, 99(6): 1392−1406.
[19] Qiu YN. Overview of the production method and application of γ-butyrolactone (γ-BL). Sci-Tech Info Dev Econ, 2008, 18(34): 83−84.邱娅男. γ-丁内酯的生产方法及其应用综述. 科技情报开发与经济, 2008, 18(34): 83−84.
[20] Jing S, Guan LJ. Introduction about properties of 1,4-butanediol and processing technique. Chem Eng Equi, 2011(2): 137−138.景森, 关丽娟. 1,4-丁二醇性能及各种生产工艺介绍. 化学工程与装备, 2011(2): 137−138.
[21] Zhang L, Shi ZY, Wu Q, et al. Microbial production of 4-hydroxybutyrate, poly-4-hydroxybutyrate, and poly(3-hydroxybutyrate-co-4-hydroxybutyrate) by recombinant microorganisms. Appl Microbiol Biotechnol, 2009, 84(5): 909−916.
[22] Zhang YP, Huang ZH, Du CY, et al. Introduction of an NADH regeneration system into Klebsiella oxytoca leads to an enhanced oxidative and reductive metabolism of glycerol. Metab Eng, 2009, 11(2): 101−106.
[23] Sánchez AM, Bennett GN, San KY. Novel pathway engineering design of the anaerobic central metabolic pathway in Escherichia coli to increase succinate yield and productivity. Metab Eng, 2005, 7(3): 229−239.
[24] Nielsen DR, Leonard E, Yoon SH, et al. Engineering alternative butanol production platforms in heterologous bacteria. Metab Eng, 2009, 11(4/5):262−273.
[25] Heuser F, Schroer K, Lütz S, et al. Enhancement of the NAD(P)(H) pool in Escherichia coli for biotransformation. Eng Life Sci, 2007, 7(4): 343−353.
[26] Li ZJ, Shi ZY, Jian J, et al. Production of poly(3-hydroxybutyrate-co-4-hydroxybutyrate) from unrelated carbon sources by metabolically engineered Escherichia coli. Metab Eng, 2010, 12(4): 352−359.
[27] Yim H, Haselbeck R, Niu W, et al. Metabolic engineering of Escherichia coli for direct production of 1,4-butanediol. Nat Chem Biol, 2011, [Epub ahead of print].
