苷泰胶囊抗乙肝病毒的实验研究
2011-01-29魏思思江凤娟
杨 坤, 贾 雷, 魏思思, 江凤娟
(1.军事医学科学院北京100850;2.解放军302医院全军中药研究所北京100039)
乙肝病毒的慢性感染是临床的常见病和多发病[1-2],严重危害了世界人民的健康。全球有约3.5亿的 HBV感染者,其中,我国的感染率高达10% ~20%。目前,临床上使用干扰素和腺苷类似物治疗乙肝病毒的慢性感染,但是依然无法从“根”上治疗慢性乙肝。因此,寻找安全、有效的抗HBV药物是当前要务。
苷泰胶囊来源于我院多年使用的协定方,主要由叶下珠、甘草、苦参等组成,在临床上用于治疗慢性病毒感染性肝炎伴有肝郁脾虚及湿热互结证,治疗效果显著。本实验分别使用2.2.15细胞和感染鸭乙型肝炎病毒的北京鸭为模型对其抗乙肝病毒作用进行检测和评价,为苷泰胶囊进一步的研究提供一定的实验依据。
1 实验材料
1.1 实验试剂 苷泰胶囊,由解放军第302医院提供(090915);拉米夫啶,由英国葛兰素有限公司生产(09020018)。胎牛血清,由美国Hyclone Lab公司生产;HB-sAg和HBeAg固相放射免疫测定盒,由北方免疫试剂研究所生产;α-32P-dCTP,由北京福瑞生物科技公司生产;Sephadex G-50,Ficoll PVP,由瑞典Pharmacia公司生产;鱼精 DNA和牛血清白蛋白均由中科院生理研究所提供;0.45 μm硝酸纤维素膜,由Amersham公司生产。其它试剂均为分析纯。
1.2 实验动物 1日龄的北京鸭,80~100 g,北京药植所动物饲养场。动物饲养条件:贰级标准,(军医动字第B98006号)。
1.3 鸭乙型肝炎病毒 强阳性血清由中国医学科学院生物技术研究所提供,均采自然感染的上海麻鸭,选用其中DHBV DNA强阳性者(+++),-70℃保存。
1.4 2.2.15细胞 HBV DNA转染人的肝癌克隆细胞,由中科院医药生物技术研究所提供。
1.5 仪器 BS-224型生物化学分析测定仪,由北京生化仪器厂生产。
2 实验方法
2.1 对体内鸭乙型肝炎病毒的影响 将上海麻鸭的DHBV DNA强阳性血清按照0.3 mL/只的剂量经腿胫静脉内注射入1日龄的北京鸭体内,染毒7 d后取血,检测提取血清中DHBV DNA的含量。雏鸭的血清经检测呈DHBV阳性后,将雏鸭随机分为6组,即病毒对照(模型)组、拉米夫定(0.05 g/kg)和苷泰胶囊(1.15、2.3、4.6 g/kg)3个剂量组,每组6只。按照1.5 mL/只,灌胃给药,每天2次;病毒对照组给予同体积的生理盐水。连续给药或生理盐水10 d。分别在给药后第5天(T5)、第10天(T10)及停药后第3天(P3)经鸭胫静脉取血,并分离血清,按照试剂盒中说明书的方法,做血清的斑点杂交,测定OD值(滤光片为490 nm),计算血清DHBV-DNA光密度。
2.2 对2.2.15细胞内乙型肝炎病毒的抑制作用
2.2.1 对2.2.15细胞的毒性作用:取2.2.15细胞制备成单细胞悬液,计数后调整细胞浓度至10万个/mL,接种96孔培养板,每孔1 mL,置CO2孵箱(37℃ 5%CO2)培养24 h。用培养基将苷泰胶囊配制成含原药16 g/L的溶液,分别稀释至 8、4、2、1、0.5、0.25 mg/mL,加入培养板,每个浓度 3个孔,以无药细胞组为空白对照,每4天换同浓度药液。以细胞病变为观察指标,于8 d后在显微镜下观察其病变情况。完全破坏为4;75%破坏为3;50%破坏为2;25%破坏为1;无病变则为0。计算平均细胞病变程度及抑制百分率。按照ReedMeuench法计算TC50,TC0。见表2。


2.2.2 对乙型肝炎病毒表面抗原、e抗原的抑制作用:同上法培养2.2.15细胞,接种24孔培养板。在无毒浓度下,将分别为 500、250、125、62.5 μg/mL 4 个稀释度的药液加入培养板,每个浓度3孔,每4天换同浓度药液,在第8天时收集培养液,-20℃下冰冻保存。用γ计数仪测量每孔的cpm值,计算其抑制率。

2.2.3 对2.2.15细胞DNA抑制实验:同上法吸除培养液收取细胞,加入裂解液裂解细胞,用等体积的苯酚∶三氯甲烷∶异戊醇抽提2次,加入无水乙醇沉淀核酸,抽干,重新溶于20 μL TE缓冲液作为样品。取20 μL(DNA含量25 μg),经变性和中和,以20X SSC缓冲液于硝酸纤维素膜上稀释至1∶8倍,干烤、预杂交、杂交、洗膜、放射自显影。冲洗X光片,用gel-pro软件测定其密度,计算其抑制率。

2.3 统计学方法 用SPSS 11.0软件进行统计分析,采用齐性资料用单因素方差分析(ANOVA)和配对t检验,选择P<0.05为其统计学意义。
3 实验结果
3.1 对体内鸭乙型肝炎病毒的影响 病毒对照组雏鸭感染血清DHBV-DNA后全部呈阳性,实验全过程中血清DHBV-DNA的水平无明显变动(P>0.05)。与自身给药前比较,苷泰胶囊高、中、低剂量组鸭在给药后第10天,停药后第3天,均能显著地降低DHBV-DNA的水平(P<0.01);阳性药在给药后第5、10天可以显著地降低血清中DHBV-DNA的水平(P<0.01),但停药3 d时,血清中DHBV-DNA的水平恢复至给药前,呈现“反跳现象”。实验结果表明,苷泰胶囊高、中、低剂量均可以有效地抑制DHBV-DNA的水平升高,并且呈现剂量依赖性。见表1,图1,图2。
3.2 苷泰胶囊对2.2.15细胞内乙型肝炎病毒的抑制作用
表1 苷泰胶囊在鸭体内对乙型肝炎病毒DHBV-DNA的影响 (±s)

表1 苷泰胶囊在鸭体内对乙型肝炎病毒DHBV-DNA的影响 (±s)
各组给药后 (T5、T10、P3)OD值与同组给药前(T0)OD值比较。*P<0.05,**P<0.01。
组别 剂量/(g/kg)bid,po 动物/只 DHBV-DNA 水平T0 T5 T10 P3病毒对照组 6 0.982±0.24 0.996±0.17 0.988±0.20 1.017±.30苷泰 1.15 6 0.835±0.13 0.856±0.15 0.769±0.23** 0.741±0.10**2.3 6 0.934±0.18 0.748±0.25** 0.569±0.17** 0.689±0.09**4.6 6 0.989±0.005 0.716±0.090** 0.478±0.25** 0.588±0.05**拉米夫定 0.1 6 0.951±0.06 0.621±0.15** 0.424±0.07**0.968±0.09

图1 苷泰胶囊组与病毒对照组鸭血清DHBV-DNA水平抑制率比较
3.2.1 苷泰胶囊对2.2.15细胞的毒性作用 表2表明,苷泰胶囊对2.2.15细胞产生50%抑制作用质量浓度为793.7 μg/mL,无毒性浓度为500 μg/mL,提示苷泰胶囊的药效浓度应选择500 μg/mL以下。
3.2.2 苷泰胶囊对2.2.15细胞分泌HbsAg、HbeAg的抑制作用
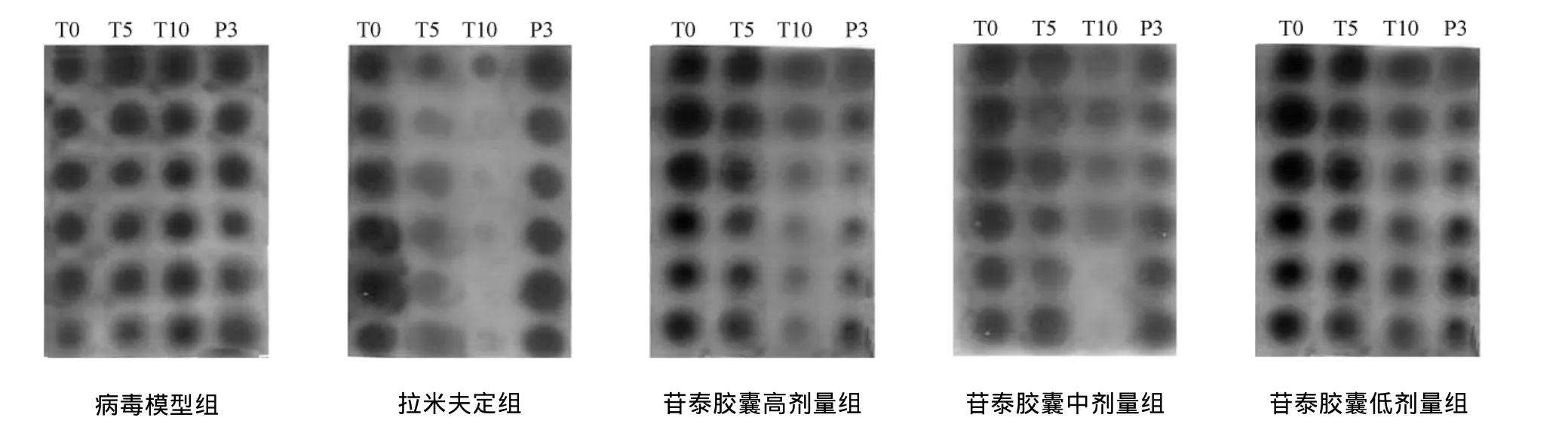
图2 鸭血清中DHBV-DNA斑点杂交放射自显影照片
结果见表3,图3。实验结果:苷泰胶囊质量浓度在500、250、125、62.5 μg/mL 时,对 2.2.15 细胞 HbsAg分泌的抑制率分别为16.80%、11.22%、8.94%、4.18%,与病毒对照组比较均有显著差异(P <0.01),IC50=1 158.92 μg/mL;苷泰胶囊质量浓度在500、250、125、62.5 μg/mL 时,对 2.2.15 细胞HbeAg分泌的抑制率分别为26.07%、14.31%、11.16%、4.28%,与细胞比较均有显著性差异(P<0.01),IC50=1 794.14 μg/mL。实验结果提示,苷泰胶囊对2.2.15细胞HBsAg、HBeAg的分泌具有一定的抑制作用并呈剂量依赖性。

表2 苷泰胶囊对2.2.15细胞的毒性作用 (n=3)
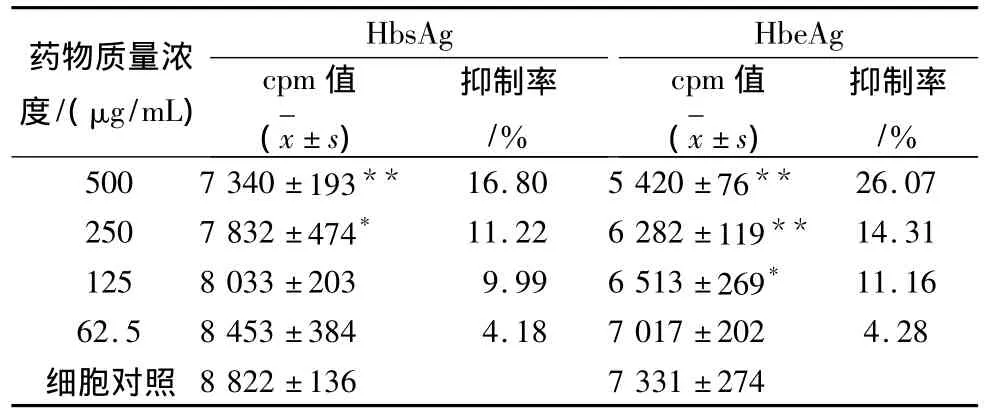
表3 苷泰胶囊在2.2.15细胞中对HbsAg和HbeAg分泌的影响
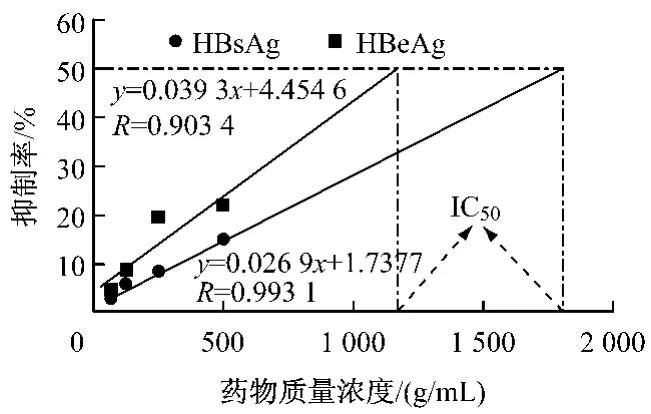
图3 苷泰胶囊对2.2.15细胞分泌HbsAg和HbeAg的抑制作用量-效关系图
3.2.3 苷泰胶囊对2.2.15细胞HBV-DNA的抑制实验
结果见表4,图4。苷泰胶囊质量浓度在500、250、125、62.5 μg/mL时,对细胞HBV-DNA的抑制率分别为21.67%、13.71%、2.08%、3.24%,IC50=701.27 μg/mL;拉米夫定药物质量浓度在 500、250、125、62.5 μg/mL 时,对细胞 HBVDNA的抑制率分别为34.33%、21.44%、15.74%、0.02%,IC50=1 096.27 μg/mL。实验结果表明,苷泰胶囊对细胞HBV-DNA水平具有一定的抑制作用并呈剂量依赖性。
4 讨论
2.2.15 细胞系最早是由美国MountSinai医学中心以HBV-DNA转染人类肝癌细胞株,可以长期稳定地分泌HB-sAg和HBeAg,是目前筛选抗乙肝病毒药物的常用细胞模型[3]。鸭感染DHBV DNA模型可以长期维持病毒血症,建立方便,并且该病毒与人乙肝病毒同属嗜肝DNA病毒,复制过程相似,是国家认可的体内评价药物抗乙肝病毒效果的重要模型[4]。2.2.15细胞及鸭乙肝病毒感染模型是研究乙肝发病机制、病毒复制过程及筛选有效药物的理想模型,故本研究选用此两种模型对苷泰胶囊的抗乙肝病毒活性进行定量评价。
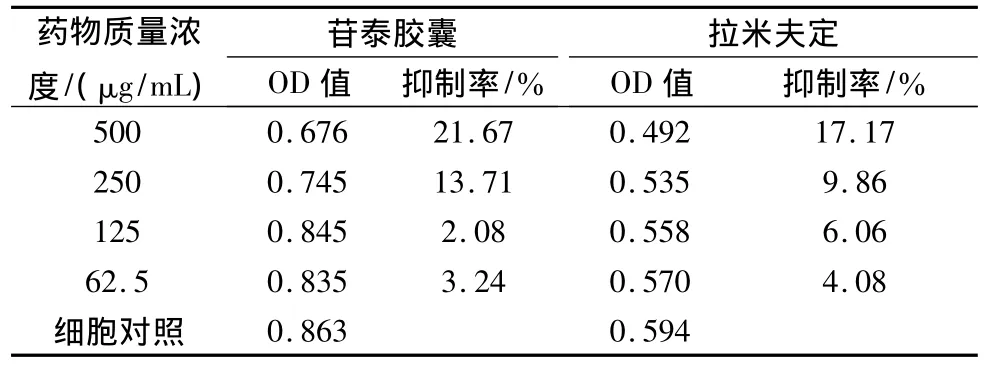
表4 苷泰胶囊在2.2.15细胞中对HBV-DNA水平的抑制作用

图4 苷泰胶囊对2.2.15细胞中HBV-DNA的抑制作用量-效关系图
乙型肝炎病毒在肝细胞内持续复制会引起宿主产生免疫应答,造成细胞的免疫病理损害,是导致肝炎慢性化的病理学基础。因此针对乙肝病毒的慢性感染的抗病毒治疗,是阻断慢性乙型肝炎发展的主要措施。慢性病毒性肝炎属中医“黄疸”、“癥积”和“虚损”等病症范畴。中医认为,慢性病毒性肝炎的主要病机多为湿热夹注,或见虚实互见及本虚标实。治当清肝解毒、健脾益气。本方中叶下珠可以清热,凉血,解毒,利湿,以祛湿、瘀、热、毒之邪,其化学成分主要有木脂素类及生物碱类鞣质等多种成分[5-6],是目前临床上应用广泛的抗肝炎病毒中草药之一[7-8]。苦参性寒,味苦,可清热解毒,主要含有具有抗肿瘤、降低转氨酶、抗乙肝病毒等作用的氧化苦参碱和苦参碱等生物碱成分。在临床上广泛用于病毒性肝炎的治疗。人参茎叶总皂苷用于肝炎的治疗,可起到扶正作用。甘草健脾益气,固本扶正,以补其虚。综合全方,共奏清肝解毒、健脾益气之功。
实验结果表明,苷泰胶囊可以较好地在体外及体内抑制乙肝病毒的复制,并且,随着给药剂量和时间的增加,对乙肝病毒的抑制作用逐渐增强,呈现一定的剂量和时间依赖性。停药后,没有出现由于病毒再复制而产生的“反跳”现象。至于其活性部位有待于进一步研究。
[1]Simonetti J,Bulkow L,McMahon B J,et al.Clearance of hepatitis B surface antigen and risk of hepatocellular carcinoma in a co-hort chronically infected with hepatitis B virus[J].Hepatology,2010,51(5):1531-1537.
[2]Ponsiano O,Christopher K O,William M L.Hepatitis B virus infection:current status[J].Am J of Med,2005,118(12):1413.
[3]郑浩杰,刘国强.利用2.2.15细胞株筛选抗乙肝病毒中草药的体外实验研究进展[J].陕西中医学院学报,2003,26:61-63.
[4]Msaon W S,Seal G,Summers J.Virus of Pekin ducks with structural and biological relatedness to human hepatitis B virus[J].J Virol,1980,36(3):829-836.
[5]仲 英,左春旭,李凤琴,等.叶下珠化学成分级其抗乙肝病毒活性的研究[J].中国中药杂志,1998,23(6):363-364.
[6]张兰珍,郭亚建,涂光忠,等.叶下珠新鞣质的分离与鉴定[J].药学学报,2004,39(2):119-122.
[7]Chia C C,Yu C L,Karin C S,et al.Lignans from Phyllanthus unnaria[J].Phytochmistry,2003,63:825-833.
[8]周 军,李 茂,樊亦军.叶下珠醇提取物对实验性肝损伤的保护作用[J].广西中医学学院学报,2004,7(1):5-7.
