岗梅药液大孔吸附树脂精制工艺研究
2011-01-29李润美陈汀波陈冠林赖小平
李润美, 张 军, 陈汀波, 陈 威, 陈冠林, 赖小平
(广州中医药大学,广东广州510006)
岗梅为冬青科植物梅叶冬青 Ilex asprella(Hook.et Arn.)Champ.ex Benth.的干燥根及根茎[1],味苦、甘,性凉,功效清热解毒、生津止渴、利咽消肿、散瘀止痛,临床用于感冒发热、肺热咳嗽、热病津伤口渴、咽喉肿痛、跌打瘀痛等病症的治疗。药效学研究表明岗梅有抗流感病毒、抗炎、抗菌、抗肿瘤作用及抗心肌缺血等作用[2-7]。主要有效成分为皂苷类,ilexoside XXIX是岗梅中含量较大的三萜皂苷类成分。大孔吸附树脂在分离纯化天然产物中有广泛的应用,AB-8型和D101型大孔吸附树脂在分离皂苷类成分时具有较大的优势[8-14]。本试验以岗梅总皂苷结合ilexoside XXIX为指标优化岗梅药液精制工艺参数。
1 仪器与试药
SHIMADZU高效液相色谱仪(日本岛津公司),SEDEX 75蒸发光散射检测器(法国SEDEX公司),N2000色谱工作站(浙江大学),AB204-N型万分之一电子分析天平,十万分之一电子分析天平(Sartorius CP225D)。
岗梅采集于广东省从化森林公园,经广州中医药大学中药鉴定教研室黄海波教授鉴定为梅叶冬青Ilex asprella(Hook.et Arn.)Champ.ex Benth的根及根茎。对照品ilexoside XXIX纯度为98.9%(暨南大学天然药物研究所张晓琦副教授提供)。乙腈、甲酸均为色谱纯,水为超纯水。
2 方法与结果
2.1 岗梅药液的提取 取岗梅药材粗粉905 g,加入8倍量的60%乙醇,加热回流1.5 h,滤过,滤渣再加入6倍量的60%乙醇,加热回流1 h,滤过,合并滤液,测定体积,得提取液11 020 mL,备用。
2.2 岗梅总皂苷测定方法
2.2.1 岗梅供试液的制备 量取岗梅药液适量,蒸干,残渣用5mL水溶解,上已预处理的AB-8大孔吸附树脂柱(13 mm×150 mm),用蒸馏水水洗至澄清,再用95%乙醇洗脱,收集醇洗液至100 mL量瓶刻度,摇匀,即得供试品溶液。
2.2.2 对照品与测定波长的选择 在400~700 nm波长处扫描,Ilexoside XXIX与岗梅提取液的紫外吸收曲线基本一致,最大吸收波长为541 nm,故采用ilexoside XXIX标定岗梅总皂苷。Ilexoside XXIX与岗梅提取液的紫外吸收曲线见图1。
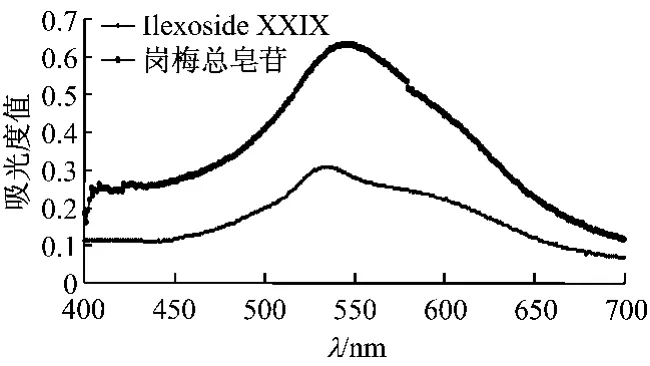
图1 岗梅提取液和ilexoside XXIX紫外吸收曲线
2.2.3 测定方法 精密吸取供试液0.5 mL,置试管中,水浴蒸干,加5%香草醛冰醋酸溶液0.2 mL和高氯酸0.8 mL,摇匀,在60℃水浴中加热20 min,取出,冷水冷却10 min,加冰醋酸至5 mL,摇匀,以相应试剂作空白对照,541 nm处测定吸光度。
2.2.4 岗梅总皂苷标准曲线的制备 精密称取岗梅对照品ilexoside XXIX 5.43 mg,置5 mL量瓶中,加甲醇定容至刻度,摇匀,得对照品溶液。精密吸取对照品溶液0.02、0.04、0.06、0.08、0.10、0.14、0.18 mL 于试管中,照 2.2.3 项测定总皂苷的含量。以对照品质量浓度C(mg/mL)对吸光度A进行线性回归,回归方程为:A=28.383C-0.053,r2=0.999 5,岗梅对照品溶液质量浓度C在4.3~39.1 μg/mL内呈良好的线性关系。
2.3 总皂苷测定方法学考察
2.3.1 精密度实验 精密吸取0.1 mL ilexoside XXIX对照品溶液于试管中,照2.2.3项测定,重复测定吸光度6次,计算结果得RSD为0.63%,表明仪器精密度良好。
2.3.2 重复性实验 精密量取岗梅供试液0.5 mL各5份,照2.2.3项下方法测定总皂苷含量,结果得RSD为1.49%,表明方法重现性良好。
2.3.3 稳定性实验 精密量取岗梅供试液0.5 mL各6份,照2.2.3 项显色,显色后室温放置,分别在0、15 min、30 min、1 h、2 h、4 h后测定吸收值,实验结果显示该方法经过时间的延长,显色效果不稳定,显色结束到测定吸收值的时间宜控制在30 min内。
2.3.4 加样回收率实验 精密量取岗梅供试液0.5 mL各6份,分别精密加入对照品2.5 mg,水浴蒸干,残渣加入95%乙醇溶解并定容于50 mL量瓶中,照2.2.3项测定,结果测得回收率为95.92%,RSD为2.14%。
2.4 ilexoside XXIX 测定
2.4.1 色谱条件 经优化色谱条件,确定以 Phenomenex BDS C18柱(250 mm × 4.6 mm,5 μm)为固定相,以乙腈-0.2%甲酸为流动相,按表1梯度洗脱。漂移管温度:40℃,载气(氮气)压力:2.5 bar,体积流量:1 mL/min,柱温:28 ℃,进样量:10 μL。在以上色谱条件下测定,谱图见图2,3。

表1 梯度洗脱程序
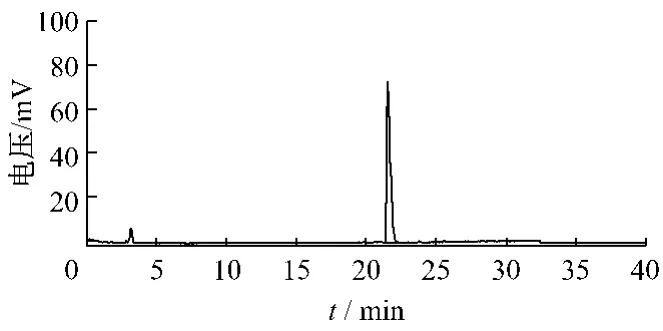
图2 ilexoside XXIX HPLC-ELSD图谱
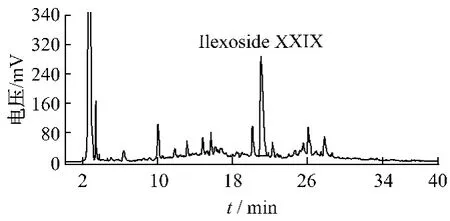
图3 岗梅药液HPLC-ELSD图谱
2.4.2 ilexoside XXIX标准曲线的制备 分别吸取对照品溶液 1、2、4、10、25、30 μL 注入液相色谱仪,测定峰面积,以进样质量的自然对数为横坐标,峰面积的自然对数为纵坐标,进行线性回归,得回归方程为 Y=1.353 5X+4.749 5,r=0.999 8,表明 ilexoside XXIX 进样质量在 0.984 ~29.52 μg范围内的自然对数值与峰面积的自然对数值成良好线性关系。
2.5 ilexoside XXIX测定方法学考察
2.5.1 精密度实验 精密吸取对照品溶液10 μL,在上述色谱条件下,重复注入液相色谱仪6次,测定峰面积,结果RSD为1.02%。表明仪器精密性良好。
2.5.2 重复性实验 精密量取岗梅药液50.0 mL各5份,分别水浴蒸干,残渣加入甲醇溶解并定容于10 mL量瓶中,精密注入高效液相色谱仪各10 μL,测定峰面积,计算ilexoside XXIX的平均含量,RSD为1.14%。表明方法重复性良好。
2.5.3 稳定性实验 精密量取岗梅药液50.0 mL各6份,分别水浴蒸干,残渣加入甲醇溶解并定容于10 mL量瓶中,精密注入高效液相色谱仪各10 μL,分别在0、2、4、8、12、24 h进样,测定峰面积,RSD为1.37%。结果表明供试品溶液在24 h内保持稳定。
2.5.4 加样回收率实验 精密量取岗梅药液10.0 mL各6份,分别精密加入对照品5.0 mg,水浴蒸干,残渣加入甲醇溶解并定容于25 mL量瓶中,精密注入高效液相色谱仪各10 μL,测定 ilexoside XXIX含量,结果其平均回收率为99.91%,RSD 为 1.21%。
2.6 精制工艺参数的考察与优化
2.6.1 树脂种类筛选 量取上述岗梅醇提取液61.0 mL(相当于生药量5 g)3份,水浴蒸干,分别加水溶解至25 mL,上已预处理的AB-8、D101、F型大孔吸附树脂柱(13 mm×150 mm),体积流量为1.0 mL/min,收集过柱液;用100 mL蒸馏水洗,收集水洗液,与过柱液合并;再用95%乙醇洗脱,收集醇洗液至100 mL量瓶刻度。将醇洗脱后的树脂先后用2%NaOH洗至澄清、蒸馏水洗至pH值为7,再用95%乙醇洗至澄清,置于烘箱中,烘干,称定树脂质量。精密量取提取液、过柱及水洗液供试液、醇洗液供试液适量,分别按2.2.3项和2.4.1项下进行测定并计算总皂苷和ilexoside XXIX的含量,根据比吸附量及解析率对3种树脂进行筛选。
比吸附量:A=(M上-M水)/M树脂;解析率:S=M洗脱/M吸附×100%。式中M上为上柱液中总皂苷或iIlexoside XXIX总含量(g),M水为过柱液、水洗液中总皂苷或iIlexoside XXIX总含量(g),M树脂为树脂质量(g),M洗脱为醇洗液中总皂苷或iIlexoside XXIX总含量(g),M吸附为上柱液中总皂苷或iIlexoside XXIX总含量减去过柱水洗液中总皂苷或iIlexoside XXIX总含量(g)。
实验结果如表2,AB-8的比吸附量和解析率最高,F型树脂的比吸附量与解析率均最小。综合考虑比吸附量与解析率,AB-8大孔吸附树脂适合用于岗梅总皂苷的精制。
2.6.2 树脂最大上样量考察 量取岗梅提取液243.5 mL(相当于生药量20 g),减压回收至无醇味,加水稀释至100 mL即得上柱液,过已预处理的AB-8大孔吸附树脂柱(13 mm×150 mm),按顺序收集过柱液,每2.5 mL为1份,共收集34管。将34管过柱及水洗液再分别经AB-8大孔吸附树脂纯化,收集醇洗液,分别按2.2.3项和2.4.1项下进行测定并计算总皂苷和iIlexoside XXIX的浓度。
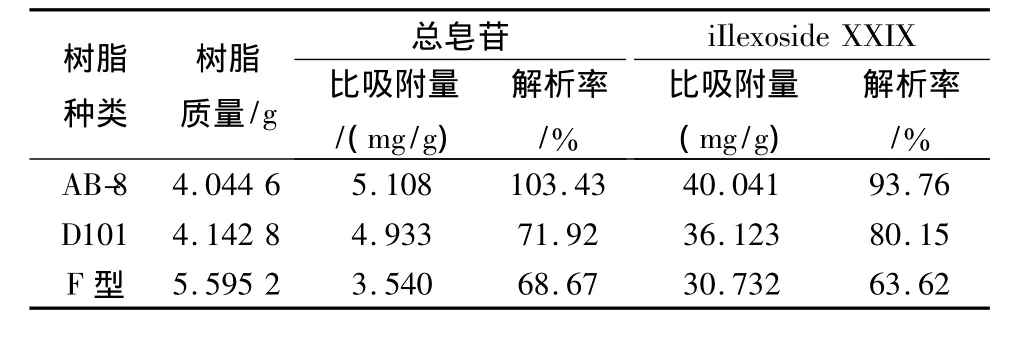
表2 不同树脂种类对岗梅动态吸附工艺参数影响
所得动态吸附曲线见图4,第26管总皂苷质量浓度为0.45 mg/mL,已超过上柱液的5%。而第34管时iIlexoside XXIX未吸附率仅为3.91%,仍未超过上柱液的5%。说明以iIlexoside XXIX作为指标考察树脂泄漏点有一定的缺陷,不足以全面反映总皂苷的信息,总皂苷对最大上样量的反应更为敏感,故最大上样量以总皂苷结果计。树脂干质量为4.04 g,以5%即得泄漏点计,其最大上样量为3.09 g生药/g干树脂;以总皂苷计,其最大上样量为119.43 mg总皂苷/g干树脂。
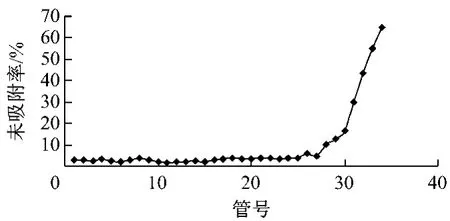
图4 岗梅总皂苷的动态吸附曲线
2.6.3 洗脱溶媒浓度考察 按照确定的最大上样量,将岗梅上柱液过已预处理的AB-8大孔吸附树脂柱,蒸馏水洗至澄清,再依次以20%、40%、60%、80%、95%乙醇分别洗脱4倍柱体积,收集醇洗液,分别按2.2.3项和2.4.1项下进行测定并计算总皂苷和iIlexoside XXIX的含量。
结果如表3显示,60%乙醇可累积洗脱下几乎100%的iIlexoside XXIX和约89%的皂苷,而80%乙醇可累积洗脱下约98.5%的皂苷,接近洗脱完全。综合考虑工艺成本与洗脱效率,选择80%乙醇为岗梅的大孔吸附树脂精制工艺的洗脱溶媒。

表3 不同溶媒质量分数的洗脱吸附结果
2.6.4 洗脱溶媒用量考察 按照确定的最大上样量及洗脱溶媒浓度,将岗梅上柱液过已预处理的AB-8大孔吸附树脂柱,蒸馏水洗至澄清,用80%乙醇洗脱,每1倍柱体积分别收集,共收集6倍柱体积,备用。分别按2.2.3项和2.4.1项下进行测定并计算总皂苷和iIlexoside XXIX的含量。
结果见表4显示,3倍柱体积的80%乙醇能将iIlexoside XXIX洗脱完全,也能洗脱97%的总皂苷,而更多洗脱溶媒仅能增加少量的总皂苷;综合考虑总皂苷保留率和生产成本,确定洗脱溶媒用量为3倍柱体积。
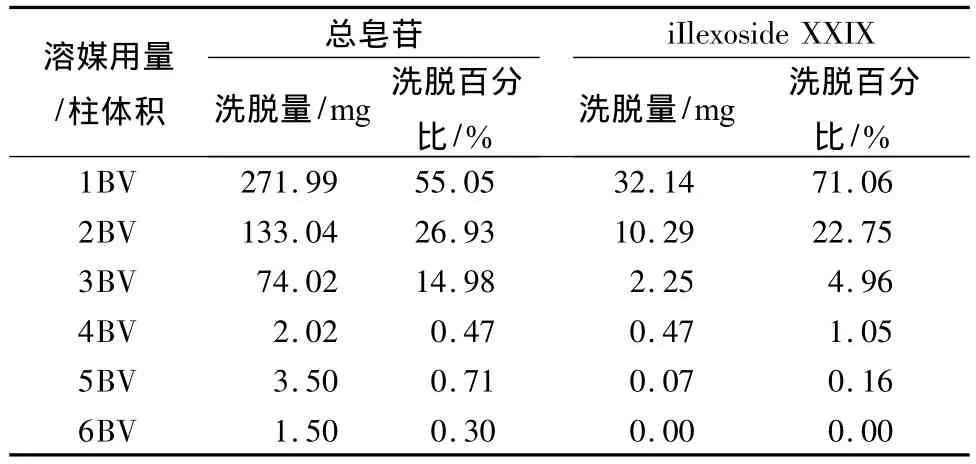
表4 不同洗脱溶媒用量的洗脱结果
2.6.5 岗梅大孔吸附树脂精制工艺验证 根据树脂精制工艺确定的参数进行重复试验,取岗梅上柱液适量,平行2份,过已预处理的AB-8大孔吸附树脂柱(3.5 cm×20.8 cm),体积流量为1 mL/min,收集过柱液,用蒸馏水洗,洗至澄清,收集水洗液,再用80%乙醇洗脱,收集3倍柱体积,备用。分别按2.2.3项和2.4.1项下进行测定并计算总皂苷和iIlexoside XXIX的含量。结果见表5,6所示,经过AB-8大孔吸附树脂纯化后,总皂苷和iIlexoside XXIX含量保留率均达80%以上,精制后固形物中总皂苷和iIlexoside XXIX分别达到87.03%及 10.83%。
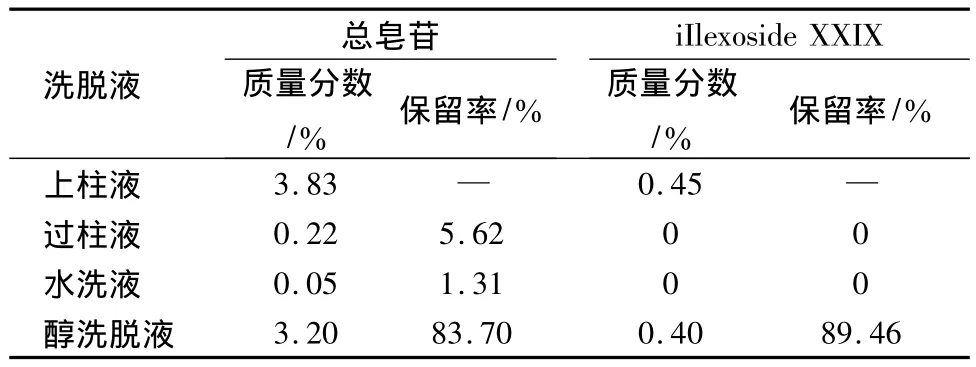
表5 岗梅验证工艺总皂苷及iIlexoside XXIX测定结果
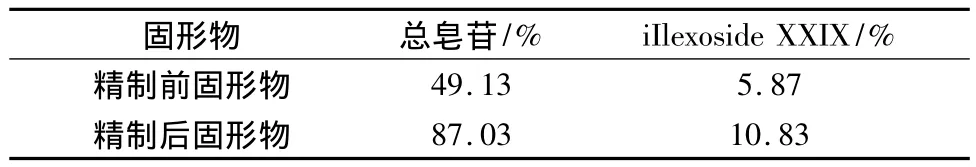
表6 精制前后固形物中总皂苷及iIlexoside XXIX含量
3 讨论
3.1 本实验以岗梅药材中特征性成分iIlexoside XXIX标定岗梅总皂苷,以岗梅总皂苷和iIlexoside XXIX保留率为指标,筛选树脂种类、最大上样量、洗脱溶媒浓度和洗脱用量等大孔吸附树脂精制工艺的关键参数,并对精制前后HPLC特征图谱进行比较,结果更为可靠。本实验还筛选了药液上柱前的预处理方式,包括离心工艺及上样浓度对岗梅总皂苷和iIlexoside XXIX保留率的影响。结果显示上柱液的离心工艺导致总皂苷损失较大,不宜采用;结合生产效率和工艺连续性,将上柱液浓度确定为0.2 g生药/mL。
3.2 经过实验研究,确定岗梅药液的大孔吸附树脂精制工艺参数为上柱液质量浓度0.2 g生药/mL,最大上样量以岗梅总皂苷计为119.43 mg/g干树脂,以80%乙醇洗脱3倍柱体积。精制后醇洗液可保留80%以上的总皂苷和iIlexoside XXIX,过柱后药液固形物中总皂苷质量分数为87.0%,iIlexoside XXIX质量分数为10.8%;相应含量提高近1倍。精制前后HPLC-ELSD特征指纹图谱基本一致,药效试验表明岗梅精制物具有抗流感病毒、抗炎效果(结果另文报道),表明岗梅大孔吸附树脂精制工艺富集了总皂苷部位,达到富集有效成分的目的。
[1]广东省食品药品监督管理局.广东省中药材标准(第一册)[S].广州:广东科技出版社,2004:21-23,111-113.
[2]朱伟群,刘汉胜,晏桂华,等.岗梅水提取物抗流感病毒的实验研究[J].热带医学杂志,2007,7(6):555.
[3]刘郴淑,陈华萍,李卫群,等.岗梅根乙醇提取物的抗炎作用[J].中药材,2004,27(7):519-520.
[4]朱伟群,晏桂华,李沛波.岗梅水提取物抗炎作用的实验研究[J].广东药学院学报,2007,23(3):304-306,311.
[5]何少璋,张一萍,喻丽元.岗梅对微生物的作用研究[J].现代医院,2008,8(5):12-13.
[6]曲彩红,席 云,陶玲,等.几种抗感冒制剂的体外抑菌作用对比研究[J].中国现代应用药学杂志,2005,22(5):420-421
[7]KashiwadaY,Zhang D C,Chen Y P,et al.Antitumor agents,145.Cytotoxic asprellie acids A and C and asprellic acid B.new p-coumaroyl triterpenes from Ilex asprella[J].J Nat Prod,1993,56(12):2077-2082.
[8]周 萍,杨 瑛.大孔树脂富集枸骨叶中总皂甙的研究[J].湖南中医杂志,2002,18(1):51-51,55.
[9]张 梅,宋 芹,张洪彬.大孔树脂富集、纯化仙茅总皂苷[J].华西药学杂志,2005,20(4):295-298.
[10]彭拓华,陈洁炜,黄湘兰.大孔树脂富集纯化人参总皂苷工艺条件优选[J].中药材,2006,29(4):392-394.
[11]刘中秋,蔡雄,赖小平,等.大孔吸附树脂富集纯化三七总皂苷工艺研究[J].中国实验方剂学杂志,2001,7(3):4-6.
[12]顾 维,楼凤昌,沈晓兰.大孔树脂纯化薤白总皂苷的研究[J].药学与临床研究,2009,(6):455-458.
[13]方达任,张 志.正交试验法优选大孔树脂对黄芪总皂苷动态吸附工艺的研究[J].中国药师,2009,(12):1747-1748.
[14]邢俊波,吴 禾,刘 云,等.大孔树脂分离黄芪总皂苷工艺研究[J].中成药,2008,30(4):519-521.
