TLR9参与巨噬细胞吞噬马尔尼菲青霉的作用研究*
2011-01-24阙冬梅张军民胡永轩
阙冬梅,张军民,胡永轩,鲁 莎,王 丽,覃 巍
TLR9参与巨噬细胞吞噬马尔尼菲青霉的作用研究*
阙冬梅1,张军民1,胡永轩1,鲁 莎1,王 丽1,覃 巍2
目的 探讨 TLR9在巨噬细胞吞噬马尔尼菲青霉中所起的作用。方法半定量RT-PCR检测马尔尼菲青霉及其基因组DNA对RAW 264.7细胞 TLR9基因转录的影响;CFU检测 TLR9对RAW 264.7细胞吞噬马尔尼菲青霉能力的影响。结果马尔尼菲青霉菌丝相和酵母相、基因组DNA及人工合成Cp G-ODN均可使RAW 264.7细胞 TLR9基因转录上调,且其上调作用均可被氯喹阻断。TLR9可增强RAW 264.7细胞对马尔尼菲青霉分生孢子的吞噬能力但不能增强其对酵母细胞的吞噬能力。结论表明巨噬细胞 TLR9参与对马尔尼菲青霉分生孢子的吞噬过程。
马尔尼菲青霉;DNA;RAW 264.7细胞;TLR9;氯喹
马尔尼菲青霉(Penicillium marneffei,P.marneffei)是青霉属唯一的双相性致病真菌。改变温度可调节其双相性转变,即室温25℃条件下表现为菌丝相而37℃体内环境下表现为酵母相,酵母相是其致病相。P.m arneffei感染人体引起马尔尼菲青霉病(penicilliosis marneffei,PSM),主要累及网状内皮-巨噬细胞系统[1],不及时进行系统抗真菌治疗者常引起全身广泛播散,病死率高。
Tokunaga等最先从BCG提取物发现DNA具有免疫刺激性[2],其免疫刺激性依赖未甲基化的Cp G结构即Cp G-DNA。人工合成的非甲基化的Cp G结构即Cp G-ODN同样具有免疫刺激活性[3],且Cp G-DNA是通过 TLR9激活免疫细胞[4]。最后证实包括细菌、病毒及真菌来源的DNA均是TLR9的天然配体。TLR9广泛表达于各种免疫细胞,包括BD-DC、巨噬细胞、B淋巴细胞等,是一种 I型跨膜蛋白[5]。
通过呼吸道吸入环境中的分生孢子被认为是P.m arneffei进入人体的最常见途径[6],因此肺泡巨噬细胞很有可能是宿主抵抗 P.m arneffei感染的第一道防线。本研究通过巨噬细胞与 P.m arneffei及其基因组DNA共培养后测定巨噬细胞TLR9基因转录水平,CFU检测TLR9对巨噬细胞吞噬 P.m arneffei能力的影响,探讨巨噬细胞TLR9在吞噬 P.m arneffei中的作用。
1 材料与方法
1.1 巨噬细胞培养 小鼠单核-巨噬细胞系RAW 264.7细胞购自武汉大学中国典藏物保存中心(CCTCC)。无菌操作复苏用含 10%FBS的DM EM培养液在含5%CO237℃培养箱中培养2~3天,ED TA-胰酶消化传代2~3次后转至6孔板,调整细胞密度为1×106/m L,每孔1 mL。根据实验要求分组。
1.2 菌株 P.m arnef fei菌株(SUM S 0152)分离自一位2岁PSM患者,经形态学及DNA测序鉴定为 P.m arnef fei。P.marneffei接种于沙堡弱培养基(SDA),37℃温箱孵育,每10 d转1次,连续转2~3次,乳酸酚棉蓝染色显微镜下观察酵母相形态,待真菌完全转为单细胞性酵母细胞且无菌丝,收集制备 P.m arneffei酵母细胞悬液,计数4℃保存备用。P.marneffei接种于马铃薯斜面培养基(PDA),25℃室温下培养7~9天PBS反复冲洗培养基表面,离心去色素,PBS重悬,镜下观察为单细胞性分生孢子,计数,4℃保存备用。酵母细胞及分生孢子的灭活均采用65℃热灭活30 m in。
1.3 主要试剂 Real-time PCR试剂盒及反转录试剂盒购自 TaKaRa公司。胎牛血清购自天津TBD公司。DM EM培养基为 Gibco公司产品。真菌大量DNA提取试剂盒购自Omega公司。Cp GODN 1826序列参考文 献,序 列 为 5′-TCCA TGACGTTCCTGACGTT-3′由上海英韦创津公司合成经硫代修饰并PAGE纯化。氯喹(chloroquine,CQ)购自sigma公司。TRIzol试剂购自 Invitrogen公司。
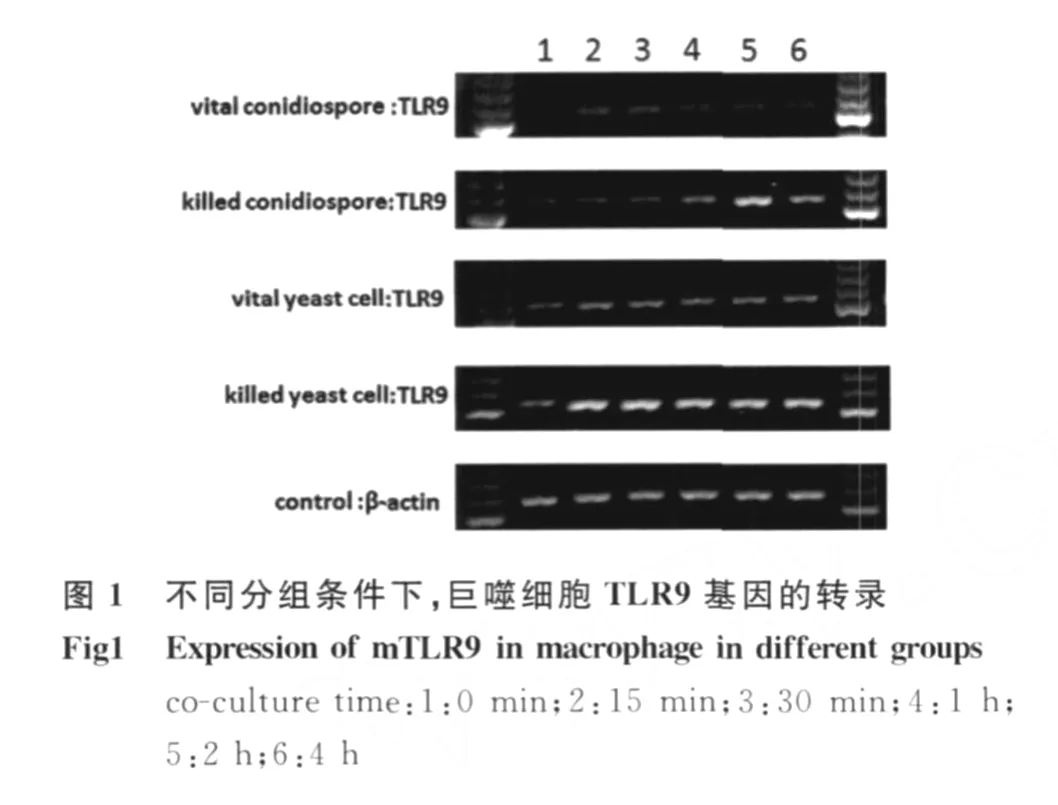
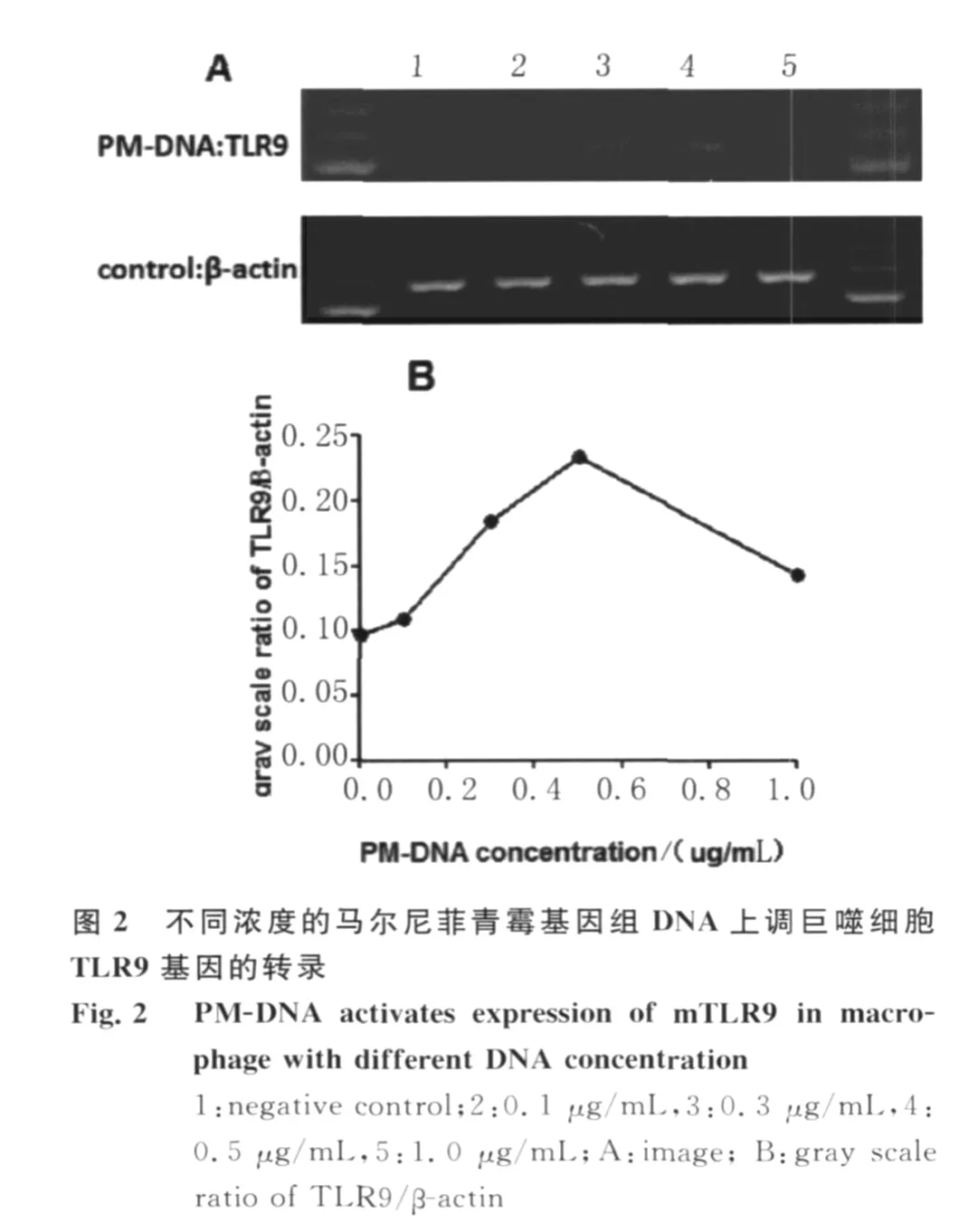
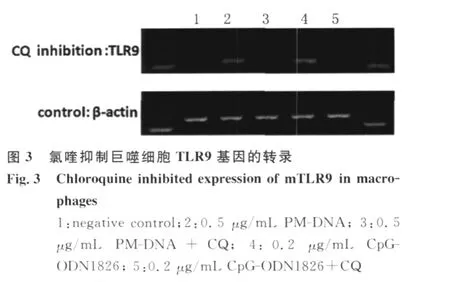
1.4 RT-PCR检测不同刺激条件下RAW 264.7细胞TLR9基因转录水平 实验分组:① P.marneffei活分生孢子组;②P.m arneffei灭活分生孢子组;③P.m arneffei活酵母细胞组;④P.marneffei灭活酵母细胞组;RAW 264.7细胞与 P.marneffei酵母细胞及分生孢子共培养均设6个不同时间点 ,分别为 0 m in、15 m in、30 m in、1 h、2 h、4 h,酵母细胞及分生孢子与巨噬细胞的比例均为4~5∶1;⑤不同浓度 PM-DNA与 RAW 264.7细胞共培养组:0μg/mL、0.1μg/mL、0.3μg/m L、0.5μg/m L、1.0μg/m L;⑥阴性对照、0.5μg/m L PMDNA、0.5μg/m L PM-DNA+CQ、0.5μg/m L Cp G-ODN 1826、0.2μg/mL Cp G-ODN 1826+CQ共培养1 h,CQ浓度为20μmol/L。
总RNA提取及RT-PCR检测 按 TRIzol试剂说明书提取 RAW 264.7细胞总 RNA,采用Dnase I处理纯化RNA。紫外分光光度计测定纯度及浓度。各组分别以等量约为0.5~1.0μg的总RNA为模板合成cDNA。采用 TaKaRa公司 PCR试剂盒扩增。RAW 264.7细胞 TLR9引物序列:上游引物 5′-CTACAACAGCCAGCCCTTTA-3′,下游引物 5′-GCTGAGGTTGACCTCTTTCA-3′,产物大小为540 bp。内参β-actin引物序列:上游引物5′-A TGGA TGACGA TA TCGCT-3′,下游引物 5′-A TGAGGTAGTCTGTCAGGT-3′,产 物 大 小 为568 bp。PCR反应条件:95℃预变性2 m in,按94℃40 s,58℃40 s,72℃1 min,TLR9采用28个循环,β-actin采用25个循环,72℃终延伸10 min。产物行1.5%琼脂糖凝胶电泳,凝胶成像系统观察并测定灰度值。以 TLR9/β-actin的灰度比值衡量TLR9基因转录水平,以上实验均重复3次,求平均值。
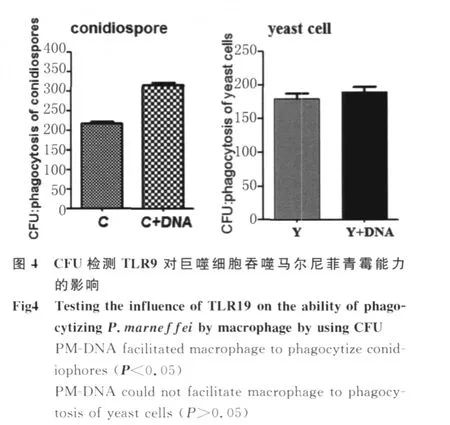
1.5 CFU检测 TLR9对RAW 264.7细胞吞噬 P.m arneffei分生孢子及酵母细胞的影响 分组:①酵母细胞空白对照组;②酵母细胞阳性组;③分生孢子空白对照组;④分生孢子阳性组。空白对照组直接加分生孢子或酵母细胞,阳性组以 0.5μg/m L PM-DNA预刺激 RAW 264.7细胞2 h。不同条件下RAW 264.7细胞与 P.marneffei分生孢子共培养1 h,与酵母细胞共培养2 h,去上清,PBS洗去未被吞噬的 P.m arnef fei,每孔以4℃预冷的无菌双蒸水 1 m L裂解细胞,倍比稀释至 1 000倍,取100μL涂SDA平皿培养基,37℃温箱培养2~3 d,菌落计数。每孔涂3个复培养皿,重复实验3次。
1.6 统计学处理 计量资料用均数±标准差表示,使用SPSS16.0统计软件进行分析,两组间均数比较采用两组独立样本t检验。检验水准为α=0.05。
2 结 果
2.1 各组RAW 264.7细胞 TLR9基因转录的趋势变化 P.marneffei分生孢子及酵母细胞均可使RAW 264.7细胞 TLR9基因转录水平升高,其中活分生孢子、活酵母细胞及灭活酵母细胞组RAW 264.7细胞 TLR9基因转录峰值均在共培养30 min,以后维持较高水平。灭活分生孢子组高峰出现时间较晚,在共培养 2 h出现(图 1)。PMDNA刺激RAW 264.7细胞 TLR9基因转录具有浓度依赖性,以0.5μg/m L PM-DNA刺激时转录水平最高。(图2A、B)人工合成 Cp G-ODN1826亦可上调RAW 264.7细胞 TLR9基因转录。CQ抑制PM-DNA和人工合成 Cp G-ODN 1826对 RAW 264.7细胞 TLR9基因转录的上调作用,见图3。
2.2 CFU检测 TLR9对巨噬细胞吞噬 P.m arneffei分生孢子及酵母细胞的影响 应用PMDNA预刺激RAW 264.7细胞上调 TLR9基因转录可增强RAW 264.7细胞对 P.marneffei分生孢子的吞噬作用,分生孢子空白对照组与分生孢子阳性组间差异有统计学意义(P<0.05);应用 PM-DNA预刺激RAW 264.7细胞上调 TLR9基因转录不能增强RAW 264.7细胞对 P.m arnef fei酵母细胞的吞噬作用,酵母细胞空白对照组与酵母细胞阳性组间差异无统计学意义(P>0.05),见图4。
3 讨 论
P.m arneffei是已知的青霉菌属中唯一温度依赖的双相型条件致病真菌,酵母相是其致病相。关于 P.marneffei可能的致病基因、蛋白及与宿主的相互作用机制已成为阐明PSM发病机制研究的核心。呼吸道吸入环境中的分生孢子被认为是P.m arneffei进入机体的最常见途径,肺泡巨噬细胞很可能参与对 P.marneffe的免疫反应。因此该研究选择RAW 264.7细胞株作为研究对象,探讨巨噬细胞 TLR9是否参与对 P.m arneffei分生孢子及酵母细胞吞噬,并为 TLR9影响下游适应性免疫的研究奠定基础。
实验发现 P.m arneffei分生孢子及酵母细胞均可使巨噬细胞 TLR9基因转录水平升高,并且在一定时间点达到高峰,以后维持较高水平,由此推测巨噬细胞 TLR9可能参与了对 P.m arneffei免疫反应。P.m arneffei来源的DNA经纯化后可刺激巨噬细胞 TLR9的基因转录,并有浓度依赖性。人工合成的Cp G-ODN 1826对其同样具有刺激活性。表明 P.m arnef fei可能通过其基因组DNA中的Cp G结构活化巨噬细胞 TLR9。
本研究初步探讨了氯喹对 P.m arneffei来源的DNA活化巨噬细胞 TLR9途径的影响。氯喹是一种弱碱性物质,可提高细胞内的p H值,而Cp GDNA活化免疫细胞 TLR9依赖于细胞内酸性环境的形成[7]。研究发现氯喹通过抑制免疫细胞 TLR9诱导的炎症因子分泌使脓毒败血症实验动物模型免受急性肾损害[8]。Zhou Hong等证实氯喹可抑制Cp G-ODN对免疫细胞 TLR9基因表达的上调并减少炎症因子的分泌[9]。本研究也表明氯喹可抑制P.m arneffei来源的DNA对巨噬细胞 TLR9基因表达的上调,其机制也可能是通过氯喹改变胞内的酸性环境。
实验结果表明 P.m arneffei来源的DNA可通过 TLR9增强巨噬细胞对 P.m arneffei分生孢子的吞噬,与 TLR9诱导体内外肿瘤细胞的自体吞噬[10],增强巨噬细胞对凋亡中性粒细胞的吞噬[11],增强小鼠神经胶质细胞对肺炎链球菌的吞噬和胞内杀伤能力[12]研究结果相一致。但 TLR9并不能增强巨噬细胞对 P.m arneffei酵母细胞的吞噬能力,因此我们推测巨噬细胞 TLR9可能只参与了对P.m arneffei入侵阶段即菌丝相的吞噬而未参与其致病相即酵母相的吞噬作用,因而有可能是 P.marneffei酵母细胞容易逃离巨噬细胞的吞噬而引起播散性感染的原因,但具体机制尚不明确。
已发现 TLR9参与机体抗白念珠菌、新生隐球菌和烟曲霉免疫反应,表现为促进 Th1型细胞免疫 ,产生 IFN-γ、TNF-α和 IL-12 等炎症因子 ,减少实验动物模型脏器载菌量和死亡率[13-15]。我们研究表明 TLR9可增强巨噬细胞对 P.m arnef fei分生孢子的吞噬,而关于巨噬细胞 TLR9是否及如何影响免疫反应和调节细胞因子分泌有待于进一步研究阐明。
[1]Segretain G.Penicillium marneffei n.spagent of a mycosis of the reticul endothelial system[J].M y-copathologia,1959,30(11):327-53.
[2]Tokunaga CT,Yamamoto T,Yamamoto S,et al.How BCG led to the discovery of immunostimulatory DNA[J].Jpn J Infect Dis,1999,52(1):1-11.
[3]Krieg AM.CPG motifs in bacterial DNA and their immune effects[J].Annu Rev Immunol,2002,20:709-760.
[4]Hemmi H,Takeuchi O,Kawai T,et al.A Toll-like recep tor recognizes bacterial DNA[J].Nature,2000,408(6813):740-745.
[5]Suzuki K,Suda T,Naito T,et al.Impaired toll-like receptor 9 expression in alveolar macrophages with no sensitivity to Cp G DNA[J].Am J Respir Crit Care Med,2005,171(7):707-13.
[6]Vanittanakom N,Cooper CR Jr,Fisher MC,et al.Penicillium marneffei Infection and recent advances in the epidemiology and molecular biology aspects[J].Clin Microbiol Rev,2006,19(1):95-110.
[7]Häcker H,Mischak H,Miethke T,etal.Cp G-DNA-specific activation of antigen-p resenting cells requires stress kinase activity and is preceded by non-specific endocytosis and endosomalmaturation[J].EMBO J,1998,17(21):6230-6240.
[8]Yasuda H,Leelahavanichkul A,Tsunoda S,et al.Chloroquine and inhibition of Toll-like receptor 9 p rotect from sepsis-induced acute kidney injury[J].Am J Physiol Renal Physiol,2008,294(5):F1050-1058.
[9]Zhou HG,Zheng JB,Wang LX,et al.Chloroquine protects mice from challenge with Cp G ODN and LPS by decreasing proin flammatory cytokine release[J].Int Immunopharmacol,2004,4(2):223-234.
[10]Bertin S,Samson M,Pons C,et al.Comparative Proteomics Study Reveals That Bacterial Cp G Motifs Induce Tumor Cell Autophagy in V itro and in Vivo[J].Mol Cell Proteomics,2008,7(12):2311-2322.
[11]Wang J,Huang WL,Liu RY,et al.Cp G-ODN enhances ingestion of apoptotic neutrophils by macrophages[J].Clin Exp M ed,2009,9(1):37-43.
[12]Ribes S,Ebert S,Regen T,et al.Toll-like recep to r stimulation enhances phagocytosis and intracellular killing of nonencapsulated and encapsulated strep tococcus pneumoniae by murine microglia[J].Infect Immun,2010,78(2):865-871.
[13]Miyazato A,Nakamura K,Yamamoto N,et al.Toll-Like Recep tor 9-Dependent Activation of Myeloid Dendritic Cells by Deoxynucleic Acids from Candida albicans[J].Infect Immun,2009,77(7):3056-3064.
[14]Nakamura K,Miyazato A,Xiao G,et al.Deoxynucleic Acids from Cryptococcusneo for mans Activate Myeloid Dendritic Cells via a TLR9-Dependent Pathway[J].J Immunol,2008,180(6):4067-4074.
[15]Bozza S,Gaziano R,Lipford GB,et al.Vaccination of mice against invasive aspergillosis with recombinant Aspergillus proteins and CpGoligodeoxynucleotides as adjuvants[J].Microbes Infect,2002,4(13):1281-1290.
The role of toll-like receptor 9 of macrophage in phagocytizing Penicillium marneffei
QUEDong-mei,ZHANG Jun-min,HU Yong-xuan,LU Sha,WANG Li,Q IN Wei
(Department of Dermatology,Sun Yat-sen Memorial Hospital,Zhong shan University,Guangzhou 510120,China)
To investigate the role of toll-like receptor 9 of macrophage in phagocytizing P.marneffei,semi-quantitative RT-PCR were used to detect the different expressions on m TLR9 of RAW 264.7 cells when stimulated by P.marneffei and its genomic DNA.In addition,CFU was used to evaluate the influence of TLR9 on the ability of phagocytizing P.marneffei by RAW 264.7 cells.The expression of m TLR9 was up-regulated w hen stimulated by conidia,yeast cells and genomic DNA of P.marneffei and synthetic Cp G-ODN.And the expression of m TLR9 was changed accompanied with the concentration of PMDNA.However,the up-regulation of m TLR9 induced by genomic PM-DNA,and synthetic Cp G-ODN could be blocked by chloroquine.On the other hand,TLR9 could enhance the capacity of RAW 264.7 for phagocytizing conidia but not yeast cells.These indicate that TLR9 might participate in the course of phagocytizing conidia by macrophage.
Penicillium m arnef fei;toll-like recep to r 9;DNA;RAW 264.7cell;chloroquine
R379
A
1002-2694(2011)06-0511-04
*广东省自然科学基金资助项目(8151008901000073)资助
张军民,Email:junminmx@163.com
1.中山大学孙逸仙纪念医院皮肤性病科,广州 510120;2.江门市中心医院皮肤科,江门 529030
2011-01-12;
2011-03-09
