绵羊肺腺瘤病毒的巢式RT-PCR技术检测*
2011-06-07赵泽赟刘淑英罗学东
赵泽赟,刘淑英,罗学东
绵羊肺腺瘤病毒(Jaagsiekte sheep retrovirus,JSRV)是引起绵羊肺腺瘤病(sheep pulmonary adenomatosis SPA)的病原,该病毒主要侵害肺脏[1]。SPA是一种慢性、进行性、接触传染性的肺脏肿瘤性疾病。该病主要以患羊咳嗽、呼吸困难、消瘦、大量浆液性鼻液、Ⅱ型肺泡上皮细胞和无纤毛细支气管上皮细胞肿瘤性增生为特征[2-3]。绵羊肺腺瘤病1825年首先发现于南非,目前,几乎所有养羊业发达的国家和地区,包括我国的新疆、内蒙、青海等省区都有该病的发生和流行,严重制约和影响着世界养羊业的发展[4]。此外,SPA与人类细支气管—肺泡癌(bronchiolo-alveolar carcinoma,BAC)在临床症状、病理组织学特征及超微病变方面极为相似,研究SPA病羊可作为研究人类BAC的理想动物模型[1]。绵羊肺腺瘤病毒是反转录病毒科β-反转录病毒属的成员之一,很多研究表明健康绵羊基因组中含有至少20拷贝与exJSRV相似内源性逆转录病毒(endogenous jaagsiekte sheep retrovirus,enJSRV)序列,并且exJSRV和enJSRV在结构和序列上同源性很高[5],在绝大多数区域同源性高达98%以上,但有 3个高可变区,分别位于 U3、env、gag区[6-7]。目前,因为该病在血液中检测不到循环抗体,所以不能用常规的血清学诊断方法,我国对本病一般通过流行病学、临床症状、病理组织学切片进行粗略的诊断,尚无快速、特异、灵敏的实验室诊断方法。
本试验在高可变区env基因的TM区和LTR的U3区分别设计了2套引物,采用巢式 RT-PCR技术对引起绵羊肺腺瘤病(SPA)的病原进行进一步的确诊,为建立特异性诊断该病的方法提供理论依据。
1 材料与方法
1.1 样品来源及处理 样品来源于内蒙古呼和浩特市某种羊场自然感染JSRV的病例,经过病理解剖、病理组织切片观察,初步诊断为绵羊肺腺瘤病,取该病羊的肺脏、肾脏、肝脏、脾脏,小鼠、家兔的肺脏分别放在无RNase冻存管中于-80℃保存。取健康绵羊肺脏(阴性对照),放在无 RNase冻存管中于-80℃保存。
1.2 常用试剂 总RNA提取试剂盒,反转录PCR试剂盒,Ex Taq DNA聚合酶,dNTP Mixture,Marker DL2000胶回收试剂盒,均为大连宝生物工程有限公司产品。
1.3 总RNA的提取 按照总RNA提取试剂盒的说明分别提取病羊肺脏的总RNA,获得的总RNA用1.0%琼脂糖凝胶电泳检测鉴定,并用微量紫外分光光度计(型号:ND-1000NanoDrop美国出产)检测RNA的浓度和纯度,之后保存于-80℃备用。
1.4 引物设计 由于enJSRV与exJSRV序列的差异主要存在于LTR的 U3区及env基因的编码跨膜蛋白的 TM区,于是根据GenBank中注册的JSRV基因全序列(登录号为AF105220),用 Primer 5.0软件在 LT R的 U3区及囊膜基因(env)的TM区分别设计套式引物,env基因的外侧上游引物P1和下游引物P2,预计其扩增片段长度约为924 bp(P1,P2分别位于AF105220的6228-6247和7151-7195位点);内侧上游引物P3和下游引物 P4,预计其扩增片段长度约为730 bp(P3,P4分别位于AF105220的6339-6357和7068-7083位点)。LTR的U3区的外侧上游引物N1和外侧下游引物N2,预计其扩增片段长度约为354 bp(N1,N2分别位于AF105220的7046-7063和7399-7419位点);内侧上游引物 N3和下游引物N4,预计其扩增片段长度约为161bp(N3,N4分别位于AF105220的7239-7259和7399-7419位点)。引物由大连宝生物工程有限公司合成。各引物的序列分别为:
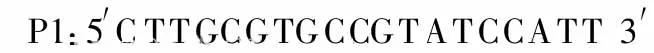

1.5 巢式RT-PCR反应体系及反应条件 反转录体系为:采用10 μL体系,在 PCR管中依次加入 5×PrimeScript Buffer 2μL,Oligo dT Primer(25pm/μL)0.5μL,Random 6 mers(50pm/μL)0.5μL,PrimeScript RT Enzyme Mix I 0.5μL,模板 RNA 1μL,其余用超纯水补至10μL。反转录条件为:37℃15min,85℃5 s。
外侧 PCR反应体系为:反应总体系为50μL,在PCR管中依次加入 Ex Taq酶(5 U/μL)0.25μL,10×Buffer(含 Mg离子)5μL,dNTP(各 215 mmol/L)4μL,反转录的 cDNA 模板 2μL,20 pmol/μL 的上下游引物 P1,P2;N1,N2;各 1μL,其余用超纯水补至 50μL。在1%琼脂糖凝胶中电泳,用凝胶成像系统拍照,观察结果。
内侧PCR反应体系同外侧PCR反应体系。循环条件:94℃预变性2 min;94℃变性30 s,env基因外侧52℃退火30 s,内侧52℃退火30 s,LTR的U3区外侧52℃退火30 s,内侧52℃退火30 s,72℃延伸1 min,env基因进行35个循环,LTR的U3区进行30个循环,最后于72℃延伸10 min。反应后,PCR产物取5μL,在 1%琼脂糖凝胶中电泳,用凝胶成像系统拍照,观察结果。
1.6 巢式RT-PCR产物纯化、测序及序列同源性比较 用AxyPrep DNA凝胶回收试剂盒分别回收env基因和 LTR的U3区的巢式RT-PCR产物。送大连宝生物工程有限公司进行双向序列测定,应用DNAstar软件对测得的序列与已经登录enJSRV和exJSRV序列进行比较。
1.7 特异性试验 采用相同的引物和反应条件,提取感染JSRV的病羊肾脏、肝脏、脾脏的 RNA为模板,进行巢式RT-PCR的特异性试验,用琼脂糖凝胶电泳进行检测;再取健康绵羊、小鼠、家兔的肺脏分别提取RNA进行巢式 RTPCR的特异性试验,用琼脂糖凝胶电泳检测。
1.8 敏感性试验 取阳性病料的肺组织,提取RNA,测定其浓度及A260/A280的值,按10倍连续进行稀释,进行巢式RT-PCR扩增,检测其敏感性。
1.9 与普通RT-PCR进行比较 应用特异性引物 P1/P2以及N1/N2,在筛选出最适反应条件下,采用50μL反应体系,在 PCR 管中依次加入 Ex Taq酶(5 U/μL)0.25μL,10×Buffer(含 Mg离子)5μL,dNTP(各215 mmol/L)4μL,反转录的cDNA模板 2μL,20 pmol/μL的上下游引物 P1,P2;N1,N2;各 1μL,其余用超 纯水补至 50μL。
循环条件:94℃预变性2 min;94℃变性30 s,env基因52℃退火30 s,LTR的U3区52℃退火30 s,72℃延伸1 min,env基因进行35个循环,LT R的U3区进行30个循环,最后于72℃延伸10 min。将模板RNA进行梯度稀释,进行RT-PCR扩增,其结果与巢式RT-PCR进行比较。
1.10 重复性试验 用外侧引物P1/P2,N1/N2以及内侧引物P3/P4,N3/N4进行巢式RT-PCR反应,使用阳性病料的总RNA为模板,进行3次重复试验,来确定试验结果的稳定性和重复性。
2 结 果
2.1 巢式RT-PCR扩增 以阳性病料的肺组织提取的总RNA为模板,以env基因的外侧引物P1/P2,以及LT R的U3区的外侧引物N1/N2,分别进行RT-PCR的扩增,同时设置健康绵羊肺组织总RNA以及水为模板的阴性对照。env基因外侧PCR扩增的产物经过琼脂糖凝胶电泳显示约为924 bp,LT R的U3区外侧扩增产物显示约为354 bp(如图1)。
以外侧产物为模板,用内侧引物P3/P4,N3/N4分别进行的PCR扩增产物经过琼脂糖凝胶电泳显示env基因的片段约为730 bp,LTR的U3区的片段约为161 bp(如图2)。

图1 env基因、LTR的U3区外侧引物的扩增结果与阴性对照Fig.1 RT-PCR products of env gene and U3(using outer primers P1P2,N1N2 separately)and negative control
2.2 序列同源性分析 经过大连宝生物工程有限公司对巢式RT-PCR产物纯化,进行双向测序,将2个基因的测序结果应用DNAstar软件与GenBank中已登录的外源性exJSRV序列(AF105220),内源性enJSRV序列(AF153615)进行比较分析,其中测得的env基因序列与外源性exJSRV的核苷酸同源性达100%,与内源性enJSRV核苷酸的同源性为88%,说明扩增到的目的序列为外源性的病毒序列;LTR的U3区序列与外源性exJSRV的核苷酸同源性达98%,与内源性 enJSRV核苷酸的同源性为48%,说明扩增到的目的序列也为外源性的病毒序列。

图2 env基因、LTR的U3区巢式PCR扩增结果Fig.2 Nested PCR products of env gene(using inner primers P3P4,outer RT-PCR product of env gene as templates)and U3(using inner primers N3N4,outer RT-PCR product of U3 as templates)
2.3 特异性试验结果 用感染JSRV的病羊肾脏、肝脏、脾脏的RNA为模板,在相同的条件下用env基因和LTR的U3区的引物进行巢式 RT-PCR试验,用琼脂糖凝胶电泳检测均未见到相应的条带(如图3);用健康绵羊、小鼠、家兔的肺脏分别提取RNA,在相同条件下进行巢式RT-PCR试验,用琼脂糖凝胶电泳也均未见到相应条带(如图4),证明了不论是同一病羊的不同组织,还是不同动物的同一组织,本试验设计的引物是特异的。

图3 同一感染SPA羊env gene、LTR的U3区特异性试验结果Fig.3 Specificity result of env gene and U3 by nested RT-PCR
2.4 敏感性试验结果 用微量紫外分光广度计测定,A260/A280=2.0134,可用于 RT-PCR扩增。取标准品总 RNA(含量480.4 ng/μL)按10倍倍比稀释后,用本试验设计env基因和LT R的U3区的引物进行巢式RT-PCR方法检测。该反应体系检测标准模板RNA的最大稀释倍数为1×109,即env基因最低可检测到约为48 fg的RNA,结果如图5所示;LTR的 U3区最低可检测到约为 48 pg的RNA,结果如图6所示。

2.5 普通RT-PCR敏感性试验及与巢式RT-PCR敏感性的比较 取标准品总RNA(含量480.4 ng/μL)按10倍倍比稀释后,用本试验设计的env基因和LTR的U3区的外侧引物进行普通 RT-PCR方法的检测。该反应体系检测标准模板RNA的最大稀释倍数为1×109,即env基因最低可检测到约为0.48 ng的RNA,结果如图7所示;LT R的 U3区最低可检测到约为4.8 ng的 RNA,结果如图8所示。说明巢式RT-PCR比普通RT-PCR更灵敏,且env基因的敏感性高于LTR的U3区。
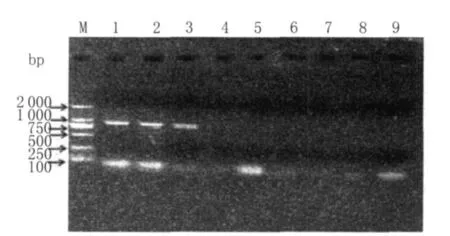
图7 env基因普通RT-PCR的敏感性试验结果Fig.7 Sensitivity result of env gene by RT-PCR
2.6 重复性试验结果 用阳性病料的总RNA为模板,用内外侧引物进行巢式RT-PCR扩增,重复3次,并同时也用健康绵羊肺脏的RNA为模板,进行同样扩增,作为阴性对照,阳性病料每次都能出现特异性条带,而阴性对照则未扩增出相应的条带,说明本试验具有高度稳定性和重复性。

图8 LTR的U3区普通RT-PCR的敏感性试验结果Fig.8 Sensitivity result of U3 by RT-PCR
3 讨论
到目前为止,在 SPA病羊体内未曾检测到exJSRV的循环抗体,因此,不能用常规的免疫学方法进行诊断。另外,exJSRV还无法在体外培养传代,所以常规的病毒分离鉴定方法在SPA诊断中也无法利用。目前,SPA的诊断主要依靠临床症状和病理组织学检查,但特异性的诊断还需依靠分子生物学技术进行确诊,所以本研究运用了巢式 RTPCR的方法,对SPA的病原进行检测。
Bai等对来自美国 3个州的 6个enJSRV和exJSRV病毒分离株进行对比研究,发现gag基因、LTR、env基因是内源性enJSRV和外源性exJSRV之间的可变区,尤其是env基因编码跨膜蛋白区域(TM)和LTR的U3区是2个高可变区[8]。Palmarini等发现内源性enJSRV env和外源性exJSRV env基因的同源性为89%,但在env基因编码跨膜蛋白区域(TM)和 LT R的U3区,同源性分别为57%~59%、50%[9]。因此本研究分别在env基因的TM区和LT R的U3区设计特异性引物,从而来保证诊断的特异性。本试验结果表明应用病肺组织提取的RNA为模板进行的巢式RT-PCR,在env基因(730 bp)和LTR的U3区(161 bp)上都成功的扩增出了外源性exJSRV的特异性基因序列,序列分析所扩增的片段与外源性exJSRV的同源性分别高达100%和98%。
本课题组的梁化春等在进行该病的诊断时,运用了RT-PCR技术和半巢式RT-PCR技术成功的扩增出了外源性exJSRV的3段特异性基因序列(U3、env基因、gag基因),扩增序列的同源性和外源性exJSRV基因序列的同源性也较高,最后确诊病例为绵羊肺腺瘤病[10]。然而他们的试验没有进行敏感性的试验,没有确定半巢式的方法的最低病毒检出量是多少。
本研究通过提取病羊肺脏总RNA运用在env基因和LTR的U3区设计的特异性引物进行巢式RT-PCR和普通 RT-PCR,并且对比普通特异性RT-PCR和巢式RT-PCR的敏感性。env基因的巢式RT-PCR诊断方法最低能检测出48 fg的标准模板RNA,LTR的 U3区的巢式 RT-PCR诊断方法最低能检测出48 pg的标准模板 RNA,而普通的RT-PCR,env基因及LTR的 U3区的最低检出量分别为0.48 ng和4.8 ng,试验结果说明巢式RTPCR的敏感性明显高于特异性RT-PCR的敏感性,同时还得出env基因的敏感性明显高于LTR的U3区的敏感性。所以在相同的条件下用env基因进行检测比LTR的U3区检测的敏感性更高,所以在诊断时利用env基因可能要更好。
目前,对于绵羊肺腺瘤病的诊断还没有快速、高效的方法,而且Marcel D等报道约240 000个外周血单核细胞中只含有一拷贝的外源性前病毒序列[11],由于病毒载量极低,所以用普通RT-PCR方法很难检测到或容易出现假阳性,制约了该病的检测研究,本试验采用敏感性很高的巢式RT-PCR技术,通过对比env基因和LT R的U3区的敏感性,得出env基因在检测中的敏感性更高,所以在实践中,应用env基因引物通过巢式RT-PCR技术来检测SPA将成为检测该病的有效方法。
[1]Palmarini M,Fan H.Retrovirus-Induced ovine pulmonary adenocarcinoma,an animal model for lung cancer[J].Journal of the National Cancer Institute,2001,93:1603-1614.
[2]Palmarini M,Delasheras M,Lnglis NF,et al.Epithelial tumour cells in the lungs of sheep with pulmonary adenomatosis are major sites of replication for Jaag siekte retrovirus[J].J Gen Virol,1995,76:2731-2737.
[3]Palmarini M,Dalziel RG,Bai J,et al.The exogenous form of Jaagsiekte retrovirus is specifically associated with a contagious lung cancer of sheep[J].J Virol,1996,70:1618-1623.
[4]Beytut E,Sozmen M,Erginsoy S.Immunohistochemical detection of pulmonary surfactant proteins and retroviral antigens in the lungs of sheep with pulmonary adenomatosis[J].Comp Pathol,2009,140(1):43-53.
[5]Bai J,Bishop JV,Carlson JO,et al.Sequence comparison of JSRV with endogenous proviruses:Envelope genotypes and a novel ORF with similarity to a G-protein-coupled receptor[J].Virology,1999,258:333-343.
[6]De Las Heras M,Ortin A,Salvatori D,et al.A PCR technique for the detection of Jaagsiekte sheep retrovirus in the blood suitable for the screening of ovine pulmonary adenocarcinoma in field conditions[J].Res Vet Sci,2005,79(3):259-64.
[7]刘淑英,马学恩,齐景伟,等.绵羊肺腺瘤病毒NM 株前病毒基因组的克隆与全序列[J].中国病毒学,2006,21(5):443-448.
[8]Bai J,Zhu RY,Stedman K,et al.Unique long terminal repeat U3 sequences distinguish exogenous jaag siekte sheep retroviruses associated with ovine pulmonary carcinoma from endogenous loci in the sheep genome[J].J Virol,1996,70(5):3159-3168.
[9]Palmarini M,Hallwirth C,York D,et al.M olecular cloning and functional analysis of three type D endogenous retrovirus of sheep reveal a different cell tropism from that of the highly related exogenous jaagsiekte sheep retrovirus[J].J Virol,2000,74(17):8065-8076.
[10]梁化春,齐景伟,刘淑英,等.绵羊肺腺瘤病的病理学及 RT-PCR诊断[J].中国预防兽医学报,2009,31(6):443-447.
[11]Marcel D,Aurora O,Daniela S,et al.A PCR technique for the detection of Jaagsiekte sheep retrovirus in the blood suitable for the screening of ovine pulmonary adenocarcinoma in field conditions[J].Research in Res Vet Sci,2005,79(3):259-264.
