未折叠蛋白反应在强噪声致豚鼠耳蜗细胞损伤过程中的作用
2011-01-23薛秋红陈小林龚树生谢静陈佳何坚
薛秋红 陈小林 龚树生 谢静 陈佳 何坚
内质网是细胞加工蛋白质和储存钙离子的场所,许多理化因素可以导致未折叠或错误折叠蛋白质在内质网的蓄积以及细胞内钙稳态的失衡,这种状态称为内质网应激,近年来有关内质网应激的信号通路与效应的研究已成为热点。未折叠蛋白反应(unfolded protein response, UPR)是内质网应激激活的信号通路之一,UPR以位于内质网的分子伴侣如葡萄糖调节蛋白78(Bip/GRP78)显著增加为特征,UPR激发Bip/GRP78高表达,通过协助蛋白质的折叠、装配和运输来维持内质网的稳定,保护细胞[1]。有研究表明 UPR在Alzheimer’s病等神经系统疾病的病理过程中有重要作用[2],但其在噪声性聋方面的研究不多。本研究通过观察强噪声暴露后不同时期豚鼠耳蜗细胞UPR标志物Bip/GRP78的表达,探讨UPR在噪声暴露后豚鼠耳蜗细胞损伤过程中的作用。
1 材料与方法
1.1实验动物 选用健康白色红目雄性豚鼠48只,体重400~450 g,耳廓反射灵敏,鼓膜完整,无中耳炎,无耳毒性药物应用史及噪声接触史。动物随机分为6组,即健康对照组和噪声暴露后3 h、1 d、4 d、14 d、30 d组,每组8只。适应性喂养1周,健康对照组不给噪声暴露,后5组给予强噪声暴露4 h。
1.2实验方法
1.2.1噪声刺激 噪声由软件4 kHz NBN-316 Hz BW-50 mV(解放军总医院耳鼻咽喉研究所自制并惠赠) 经笔记本电脑声卡产生,经功率放大器放大传至扬声器,扬声器置于80 cm×80 cm×85 cm的双层隔音箱四角,实验豚鼠置于35 cm×35 cm×50 cm的饲养笼中,自由进水。豚鼠活动范围内声强相差最大不超过5 dB。用HS6280型噪声频谱分析仪(中国江西国营红声器材厂)进行连续监测,测得噪声频率为中心频率4 kHz的窄带噪声,声级计测量噪声强度为120 dB SPL,暴露时间为4 h。
1.2.2听性脑干反应(ABR)检测 对照组和噪声暴露后各组豚鼠于相应时间点处死前行ABR检测。动物以10%水合氯醛(30mg/kg)腹腔麻醉,在静电屏蔽室内测试。采用Nicolet Compass 系统,刺激声为click,重复率为20次/秒, 扫描周期10 ms,滤波带宽100~3 000 Hz,信号叠加1 024次,以波Ⅲ为标准判断反应阈。测试后处死动物,每组取4只豚鼠耳蜗作石蜡切片,余4只提取耳蜗总蛋白。
1.2.3耳蜗石蜡切片 动物以10%水合氯醛(30 mg/kg)腹腔麻醉后,仰卧固定,开胸暴露心脏,灌流冲洗,随后灌注4%多聚甲醛磷酸缓冲液(pH 7.4)300~500 ml,快速断头取出双侧听泡,两窗灌注同种液体,放在4%多聚甲醛磷酸缓冲液中4 ℃下过夜,修剪后置入10%乙二胺四乙酸二钠(pH 6.8)充分脱钙3周左右。常规石蜡包埋,平行于蜗轴方向连续切片,片厚5 μm,烘干,室温储藏备用。
1.2.4Bip/GRP78免疫组化染色 耳蜗组织切片常规脱蜡至水,3% H2O2孵育10 min,蒸馏水冲洗;滴加抗原修复液1~3滴,孵育10 min,10%正常羊血清封闭20 min;滴加羊多抗Bip/GRP78(1:100稀释,美国Santa Cruz公司产品)(其余试剂均由中山公司提供),4℃过夜(阴性对照用正常羊血清代替一抗);加生物素标记二抗,37 ℃孵育30 min,滴加SABC反应液1~2滴,37 ℃DAB显色;Mayer苏木素复染,梯度酒精脱水,透明、封片,显微镜(×400)观察照相。Bip/GRP78染色阳性表现为胞浆/膜中有棕黄色颗粒分布。
1.2.5Western Blot检测Bip/GRP78蛋白 处死动物,提取双耳耳蜗总蛋白, 分别用10%SDS - PAGE凝胶电泳,转膜,封闭1 h;加入羊多克隆Bip/GRP78抗体(1:400,为美国Santa Cruz公司产品,),抗β-actin单克隆抗体(1:400 ,Sigma,美国),4 ℃孵育24 h,洗膜(5 min,3次),加1:5 000辣根过氧化物酶标记的二抗孵育60 min,洗膜,显色,曝光。
Bip/GRP78免疫组化染色切片由新9.0版HPIAS-100高清晰度彩色病理图像免疫组化测量系统,在400倍视野下,测每组Corti器、螺旋神经节、侧壁细胞染色的平均吸光度值。为减少误差,固定对每张切片第2、3 回以上部位的细胞进行吸光度测定。在每组中随机选择400个受检细胞做统计学处理,计算每组的平均吸光度值。Bip/GRP78蛋白条带采用Kodak Digital Science ID 图像分析系统(USA)进行光密度值测定,分别与以β-actin光密度值的比值代表Bip/GRP78蛋白表达的相对水平。
1.3统计学方法 应用SPSS11.5统计软件,两组间比较采用t检验,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1ABR阈值 各组ABR阈值见表1。可见,与对照组比较,噪声暴露后各组ABR阈值显著升高,差异均有统计学差异(P<0.05)。
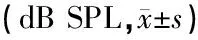
表1 各组豚鼠ABR反应阈(n=8只)
注:*与对照组比较,P<0.05
2.2Bip/GRP78免疫组织化学染色观察结果 噪声暴露后各组均可见Corti器、螺旋神经节及耳蜗侧壁的细胞质/膜上有染色程度不等的棕黄色颗粒分布(图1),正常对照组染色弱阳性。经图像分析,各组Corti器、螺旋神经节及耳蜗侧壁的Bip/GRP78蛋白免疫组化染色平均吸光度值见表2,噪声暴露后各组Bip/GRP78蛋白Corti器、螺旋神经节及耳蜗侧壁的平均吸光度值与对照组比较差异有统计学意义(P<0.01),暴露后30 d组与暴露后3 h、1 d、4 d、14 d组Bip/GRP78蛋白差异也有统计学意义(P<0.01),而暴露后3 h、1 d、4 d、14 d组间Bip/GRP78蛋白差异无统计学意义(P>0.05)。

表2 各组豚鼠耳蜗各部位Bip/GRP78免疫组化染色的平均吸光度值(n=4只)
注:*与对照组同一部位比较,P<0.01;▲与暴露后3 h、1 d、4 d、14 d组同一部位比较,P<0.01

图1 光镜下耳蜗各部位Bip/GRP78的表达(免疫组化SP染色×400)a、b、c为暴露后3 h组的Corti器、侧壁、螺旋神经节的Bip/GRP78免疫组化SP染色强阳性细胞(箭头所示) ,d、e、f为对照组Corti器、侧壁、螺旋神经节Bip/GRP78免疫组化SP染色弱阳性细胞(箭头所示)
2.3Bip/GRP78蛋白的Western Blot检测 Bip/GRP78蛋白的Western Blot法检测蛋白变化条带见图2。可见暴露后各组表达明显增高,而且在暴露后3 h、1 d、4 d、14 d组时达到高峰,30 d时减弱,对照组Bip/GRP78表达较少。经图像分析并以Bip/GRP78蛋白与β-actin平均光密度比值进行统计学分析,结果暴露后各组与对照组差异有统计学意义(P<0.01),暴露后30 d组与暴露后3 h、1 d、4 d、 14 d组相比差异有统计学意义(P<0.01),但暴露后3 h、1 d、4 d、 14 d组间差异没有统计学意义(P>0.05)。

图2 Western Blot法检测Bip/GRP78蛋白的变化
3 讨论
Bip/GRP78又名免疫球蛋白重链结合蛋白,与热休克蛋白70(Hsp70)家族具有高度同源性,存在于各类哺乳动物细胞的内质网腔中,是内质网标志分子伴侣,其表达上调是内质网应激反应的标志之一。近年来认为细胞受刺激时未折叠蛋白反应(UPR)激发Bip/GRP78高表达可能是细胞的一种重要的防御机制[1]。
目前对噪声性聋的发病机制的研究较多,包括兴奋性氨基酸毒性、钙超载、氧化应激反应等,其中氧化应激、钙超载与内质网应激关系密切[3]。强噪声刺激作为一种应激源可引发内质网应激反应,而Bip/GRP78表达上调是内质网应激反应的标志之一。本研究结果显示,噪声暴露后3 h、1 d、4 d、14 d、30 d时豚鼠耳蜗Bip/GRP78的表达明显高于正常对照组。Bip/GRP78的表达上调表明强噪声诱导了耳蜗细胞的内质网应激反应,其机制可能是钙超载和大量氧自由基生成的三磷酸腺苷消耗增加,非折叠蛋白反应加剧,Bip/GRP78蛋白合成在某种机制调控下加速,从而阻止进一步的内质网应激反应,当然其具体机制还需要进一步实验证实。从文中结果看,在噪声暴露后3 h到30 d,Bip/GRP78一直保持高表达,这可能与强噪声暴露后耳蜗细胞发生次级损伤有关;Hu等[4]通过实验证实强噪声暴露后豚鼠耳蜗从暴露后1 d到14 d不断有新的细胞损伤在发生,损伤的区域也在持续扩大;次级损伤的发生通过刺激耳蜗细胞Bip/GRP78的持续高表达,来阻止进一步或持久的内质网应激反应,对损伤不严重的细胞起保护作用,从而使其恢复正常功能。本研究中,豚鼠听力损失在噪声暴露后3 h最严重,而暴露后4 d到14 d听力损失逐渐减轻,也证实Bip/GRP78的表达上调,维持了内质网钙稳态及内环境的稳定,从而使大量损伤较轻的细胞逐渐恢复。因此,本文结果提示Bip/GRP78蛋白的高表达对强噪声引起的耳蜗细胞损伤可能具有一定的保护作用,而且这种保护作用从暴露后3小时开始一直可以持续到暴露后30天,30天后由于强噪声对内耳细胞损害逐渐减弱,Bip/GRP78蛋白的表达也相对减少。本实验还发现,Bip/GRP78阳性细胞分布在毛细胞、耳蜗侧壁及螺旋神经节细胞上,说明Bip/GRP78不仅对毛细胞起保护作用而且对整个内耳细胞都起保护作用;当然这种保护作用是相对的,UPR既诱导促细胞存活信号,又诱导促细胞凋亡信号,对受损严重的细胞,内质网应激反应会通过凋亡等方式清除这些细胞[5]。综上所述,推测豚鼠强噪声暴露后,启动UPR保护机制,通过上调分子伴侣Bip/GRP78的表达,引导蛋白质正确折叠,降低细胞损伤,这可能是内耳细胞内源性保护机制之一。
4 参考文献
1 Hayashi T, Saito A, Okuno S,et al. Induction of GRP78 by ischemic preconditioning reduces endoplasmic reticulum stress and prevents delayed neuronal cell death[J]. J Cereb Blood Flow Metab,2003,23:949.
2 Hoozemans JJ,Veerhuis R,Van Haastert ES,et al. The unfolded protein response is activated in Alzheimer/s disease[J]. Acta Neuropathol,2005,110:165.
3 Hayashi T, Saito A, Okuno S, et al. Induction of GRP78 by ischemic reconditioning reduces endoplasmic reticulum stress and prevents delayed neuronal cell death[J]. Cereb Blood Flow Metab,2003, 23:949.
4 Hu BH, Nicotera T, Henderson D. Involvement of apoptosis in progression of cochlear lesion following exposure to intense noise[J]. Hear Res, 2002,166:62.
5 薛秋红,陈佳,龚树生,等. Caspase-12在强噪声诱导下豚鼠耳蜗细胞凋亡中的作用[J].中华耳鼻咽喉头颈外科杂志, 2009,44:154.
