大鼠听觉发育中听觉敏感度及时间分辨率的变化
2011-01-23余新王坚殷善开
余新 王坚 殷善开
听觉敏感度即听敏度,是辨别不同频率和强度声音的能力。时间分辨率是听觉系统对声音信号快速变化做出反应的能力,时间分辨率主要通过间隔探测实验来衡量,即测量受试者在一个连续的声音中,探测出一个短暂的无声间隔的能力。一般以能够探测到的最短的无声间隔的时程,即间隔阈值代表听觉系统对时间的分辨能力。动物实验中,以往通常采用电击、饮食剥夺等方法建立条件反射以进行行为学间隔测试,上述方法无法保证测试个体身体状态的一致性从而影响结果的准确性,且相对残酷,已逐渐被淘汰。听觉惊跳反射前抑制试验近来以其简单、无创的优点广为运用。听觉惊跳反射(acoustic startle response, ASR)是指人或动物对突然出现的强烈声音刺激产生的防御性行为反射,表现为突然的面部、颈部和肢体骨骼肌的运动。惊跳反射前抑制(prepulse inhibition,PPI)是指在惊跳刺激(startle stimulus,SS)前适当时间(因此称为前刺激,prepulse stimulus,PS)给予一个一定时程和强度的阈下刺激(即不能引起惊跳反射的刺激)抑制惊跳反射,使惊跳反应幅度减小,潜伏期延长的现象。PPI测试可用于观察听觉系统对前刺激处理的能力。
近期许多学者采用间隔抑制试验,即以镶嵌在背景噪声中的无声间隔(silent gap)作为前刺激来研究受试动物的时域处理能力[1]。不同时程的gap镶嵌在60~75 dB的背景噪声中,其后大约20~100 ms跟随一个惊跳刺激,因为只有当动物感受到gap才能对惊跳反射有明显的抑制作用,因此,可以通过该方法测得受试动物的前刺激抑制率或间隔阈值,从而对受试动物时域处理能力进行研究。
目前运用gap-PPI测试手段研究大鼠时间分辨率发育与听敏度发育的相关性仍较少。本试验运用gap-PPI及ABR测试研究大鼠听觉时间分辨率和听敏度的发育及其相互关系。在gap-PPI测试中,以携带不同时程的gap作为惊跳反射前刺激,研究大鼠听觉系统发育过程中时间分辨率的改变。携带gap的背景噪声的频率采用大鼠最敏感且发育最早的频率,即8~32 kHz,并排除扩大的频率带宽对间隔测试的影响。同时也采用1~48 kHz的背景噪声作为对比,观察大鼠发育过程中时间分辨率的变化及带宽对其的影响。另外,为了排除PPI测试的经验效应对间隔阈值的影响,每只大鼠只进行一次gap-PPI测试,报告如下。
1 材料与方法
1.1实验材料
1.1.1实验动物 日龄为14、16、18、22、26、30、35天的新生SD大鼠各20只,共140只。雌雄不限,耳廓反射正常,耳镜检查排除外耳道耵聍栓塞及中耳感染。
1.1.2实验试剂及仪器 盐酸氯胺酮注射液,2%盐酸利多卡因注射液。TDT system 3、TDT ES1 扬声器、Startle reflex 软件、Biosig 软件、压电转换器和LP-4电热毯、铁笼大小7 cm×5 cm×5 cm (长×宽×高)(自制)。
1.2实验方法
1.2.1各日龄实验大鼠随机分为A、B两组,每组10只。A组大鼠gap-PPI测试标记gap的背景噪声带宽为1~48 kHz,B组大鼠的背景噪声带宽为8~32 kHz,背景噪声的强度均为75 dB SPL。各日龄的两组大鼠均先进行ABR测试,然后进行gap-PPI测试。
1.2.2ABR测试 所有刺激信号的产生和诱发电位的记录均由TDT system 3系统硬件和软件完成。ABR阈值为1~48 kHz范围内各倍频程点短纯音的响应阈值。短纯音上升、下降时间为0.5 ms,时程为10 ms,刺激重复率为11.1次/秒。大鼠经盐酸氯胺酮肌肉注射麻醉后置于恒温电热毯上,保证大鼠体温稳定在37.5℃左右,1%利多卡因于大鼠的颅顶及两侧乳突皮下局部注射,记录电极刺入颅顶皮下,参考及接地电极分别刺入左、右侧乳突皮下。刺激声从90 dB SPL开始,5 dB下降一档,以刚刚诱发出可辨认的波V的最小声强值为ABR反应阈值。
1.2.3gap-PPI测试 如图1所示,听觉惊跳反射的记录在屏蔽隔声室进行,一次可同时测试多个动物。其主要测试装置为载有敏感压电转换器的铁笼,铁笼大小根据受试动物大小而定,以适度限制动物活动为佳。惊跳刺激信号由TDT system 3系统(Tucker-Davis Technologies, TDT)硬件和软件完成,并通过悬挂在铁笼上方10 cm处的高频扬声器传出。当动物发生惊跳反射时,躯体运动通过垂直力作用于铁笼,经铁笼底部的压电传感器输出信号接入另一个实时处理系统(TDT),经过放大(10-100X)和滤过(10~300 Hz),输入到实时处理器中 (RP2.1, TDT), ASR的峰峰值由基于TDT硬件的startle reflex软件计算。在听觉惊跳反射前抑制的记录中,前刺激信号也由TDT system 3系统硬件和软件完成,通过悬挂在铁笼上方10 cm处的高频扬声器传出,前刺激的听觉惊跳反射(acoustic startle response with prepulse,ASRp)的记录和峰峰值计算和ASR的记录方法一致。

图1 听觉惊跳反射前抑制模式图[2]
在gap-PPI的记录中,由一个高频扬声器输出惊跳刺激信号,另一个高频扬声器输出背景噪声和gap。惊跳刺激信号为115 dB SPL (持续时间20 ms,上升/下降时间0.1 ms),前刺激信号为插入在75 dB SPL背景噪声中的不同时程无声间隔(gap),其时程分别为0、1、2、4、6、8、10、15、25、50、100 ms,上升/下降时间0 ms,0 ms的间隔测试为仅有惊跳刺激的测试,反映惊跳反射的基值。实验采用2个不同带宽的背景噪声,分别为1~48 kHz和8~32 kHz。实验间隔(inter-trial interval, ITI)为相邻两个惊跳刺激信号之间的间隔,在16~24 s之间,平均ITI为20 s,以避免前面刺激产生的不应期对后面刺激的影响。另外,随机变化的实验间隔较固定的间隔更少出现惊跳反射的适应性,并可防止动物产生期待情绪。单组实验流程包括:背景噪声—插入gap—背景噪声—惊跳刺激信号。
1.3统计学方法 所有数据经sigma state统计软件分析。在研究听敏度的发育中,以每组各时间点大鼠各频率段的ABR阈值为自变量,日龄和频率为两个因素,进行双因素方差分析。文献报道[3]大鼠在生后14天ABR才能够引出,到第35天左右,听敏度和成年鼠无差异,所以本实验将35天龄大鼠的ABR作为标准对照。故每个日龄大鼠的ABR阈值均与第35天的ABR阈值比较,有统计学差异表示该日龄大鼠的听敏度尚未发育成熟,无统计学差异则表示该日龄的听敏度已经发育成熟。间隔阈值(gap threshold)通过配对t检验,比较各时程的gap(1、2、4、6、8、10、15、25、50、100 ms)引起的ASRp与ASR基值(gap为0 ms)而得,以具有统计学差异的最短gap为间隔阈值。
PPI%是 ASRp和ASR的比值,可用于比较不同日龄大鼠在间隔探测中的表现。采用双因素方差分析,比较日龄(7个水平,14、16、18、22、26、 30、 35天)和无声间隔(10个水平,1、2、4、6、8、10、15、25、50、100 ms)双因素的作用及可能相互作用,如果发现某一因素的显著性作用后,再用两两比较的方法决定具有显著作用的因素水平。
2 结果
2.1日龄增加对间隔阈值的影响 图2为两组大鼠在不同背景噪声下的间隔阈值。可见,大鼠间隔阈值随日龄增加而下降,表明随着听觉系统的发育,大鼠的时间分辨率增加,时域处理能力增强。另一方面,相对于8~32 kHz的背景噪声,1~48 kHz背景噪声时的间隔阈值明显下降(P=0.013),也证实了随着携带gap的背景噪声频率带宽的增宽或频率的提高,时间分辨率越佳。

图2 不同背景噪声下两组大鼠的间隔阈值

表1 各日龄组大鼠在两种背景噪声下不同无声间隔时间的PPI%
注:在背景噪声为1~48 kHz时,30天大鼠的时间分辨率与35天大鼠差异无统计学意义(P>0.05)。在背景噪声为8~32 kHz时,30天大鼠时间分辨率与35天差异无统计学意义(P=0.138)
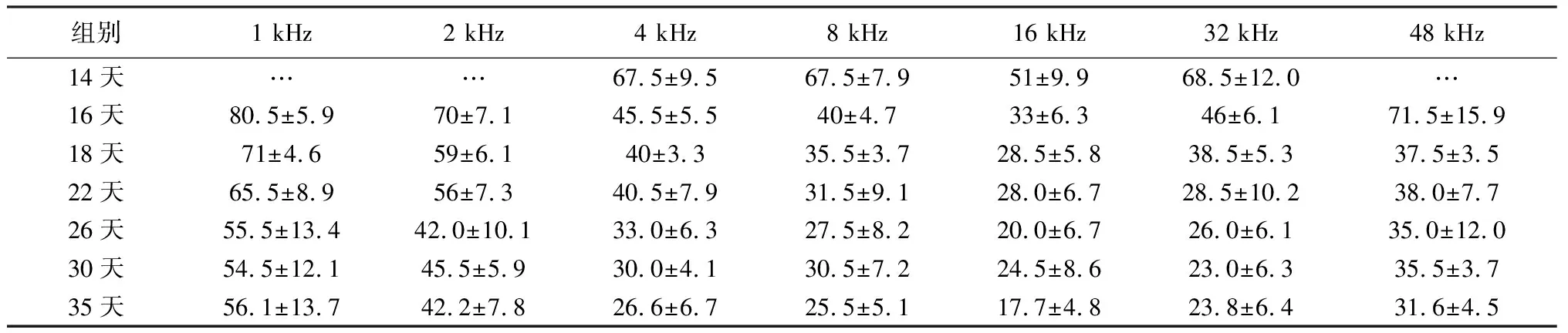
表2 不同日龄大鼠的各频率ABR阈值(dB SPL)
注:双因素方差分析示1、2和4 kHz频率的ABR阈值第26天与35天差异无统计学意义[P(1 kHz)=0.098;P(2 kHz)=1.000;P(4 kHz)=0.715];16和 32 kHz的ABR阈值第22天与35天差异无统计学意义[P(16 kHz)=0.072;P(32 kHz)=0.920];8 和48 kHz的ABR阈值第18天与35天差异无统计学意义[P(8 kHz)=0.104;P(48 kHz)=0.527]。
2.2日龄增加对PPI%的影响 表1结果显示在背景噪声为1~48 kHz时,第30天大鼠的时间分辨率才发育成熟。当背景噪声为8~32 kHz时,虽然大鼠的间隔阈值提高,但同样到第30天时,时间分辨率才发育成熟。不同日龄在不同背景噪声下大鼠PPI%的变化趋势,gap时程越长,PPI%越小;日龄增加,PPI%越小。
2.3不同日龄大鼠ABR反应阈比较 生后14、16、18、22、26、30及35天大鼠的ABR阈值见表2。1、2和4 kHz频率的ABR阈值第26天与35天无统计学差异;16和 32 kHz的ABR阈值第22天与35天无统计学差异;8 和48 kHz的ABR阈值第18天与35天无统计学差异。所以到生后第26天,大鼠各频率听敏度已达到正常水平。
3 讨论
Friedman[3]运用gap-PPI测试手段研究大鼠的时间分辨率与年龄以及经验的相关性。他们选用生后15天、35天及64天的大鼠,每只大鼠均进行连续5天的测试,结果发现随年龄增加,间隔探测阈值下降,生后15天和35天大鼠的间隔阈值在10~20 ms之间,而生后64天大鼠则为5~10 ms。经过连续5天的测试,所有年龄组大鼠的间隔阈值均比第一天下降,这一现象提示在发育早期和成熟期,感觉处理中存在依赖经验的可塑性机制。然而,生后15天大鼠的听觉系统发育尚未完善,且生后10天至20天是大鼠听觉发育最快的时期,因此连续5天测试后间隔阈值的降低不仅仅有经验依赖性的影响,快速发育完善的听功能也起了重要的作用,Friedman的实验无法区分听觉系统发育、经验及其相互作用。
本研究结果发现,两种背景噪声下,都可观察到随日龄增加,间隔阈值降低,时间分辨率提高。证实了携带gap的背景噪声的频谱越宽,间隔阈值越低,在背景噪声为8~32 kHz时获得的间隔阈值普遍比1~48 kHz时要高,其原因在于通过整合多频率上的信息获得了更佳的时间分辨率。在背景噪声为1~48 kHz时,无法排除日益发育、增加的可听频率范围间隔探测的影响。有文献[4]表明2~4 kHz背景噪声下,间隔阈值大于29 ms; 4~8 kHz噪声下的间隔阈值为16 ms;8~16 kHz噪声下的阈值为7 ms,16~32 kHz和32~64 kHz背景噪声下的间隔阈值是2 ms。因此,1~48 kHz背景噪声下所测得的间隔阈值,不能精确反应时间分辨率的发育和听敏度发育的关系。本研究结果还显示两种背景噪声下的大鼠的时间分辨率均在第30天发育成熟,与第35天大鼠相比无统计学差异,这种结果的差异性有待进一步研究。
发育中大鼠ABR的变化直接反映了大鼠内耳和听觉传导通路的成熟过程,大鼠是较理想的听觉系统生后发育研究对象[5,6],生后第14天的大鼠90 dB SPL短纯音可引出ABR,随着日龄增加,其ABR阈值明显下降,频率范围由窄变宽,至生后第35天ABR阈值已与成年大鼠无异。本研究结果显示,在生后第14天,中频区可以记录到稳定的脑干电位,然而,此时大鼠的听觉频率范围较窄,为4~32 kHz左右;生后第16天,4~32 kHz频率范围内的ABR阈值稳定下降,并且向48 kHz和1、2 kHz发展,但是听觉敏感度还很低;到生后第18天高频区ABR反应阈明显下降,到生后第22~26天各频率ABR反应阈值均明显下降,已与成年大鼠阈值无明显差异。对于低、中、高频听觉发育的先后顺序尚存争议[7,8],Ehret[9]认为大鼠听觉最敏感的频率最先发育,即10~20 kHz。本实验结果与Ehret一致,大鼠最先发育的频率在15 kHz左右。
从本研究结果看,大鼠听敏度在26天左右已经与成年鼠无异,而时间分辨率要到第30天才发育成熟。时间分辨率发育落后于听敏度的成熟可能的原因如下:首先可能是初级听觉通路中的时间编码,如时相同步(phase locking)发育较慢。时间编码通常在外周听觉系统发育完全后一段时间内才成熟,而且可能与其他中枢核团的成熟有关。其次,在外周听觉系统有功能后,听觉频率分辨率和强度分辨率迅速增加,很快达到成年水平。因此,由于时间编码发育速度相对落后,时间分辨率的发育成熟落后于听敏度。在动物实验研究中发现听皮层(auditory cortes,AC)神经元的调谐特性和时间分辨率有很强的相关性[10]。在发育过程中,AC神经元的调谐曲线变得更为尖锐,同样,时间分辨率发育迅速成熟。本实验表明从14天到35天,大鼠的间隔阈值由50 ms降低到8 ms,这一时间段和AC的发育时间相一致[2]。AC在间隔测试中的作用也十分重要,破坏AC可减弱间隔探测能力[11],但当AC功能性退化后,大鼠虽然失去对gap的探测能力,但是仍可探测短音[12]。同时,听觉时域处理能力不仅依靠听功能,更有神经元的整合过程。研究发现听皮层与时间分辨率的发育有关,另外还有其他的听觉中枢核团,例如膝状体、上橄榄复合体、丘脑和脑干[11, 13]的参与,这些听觉中枢尚未完全发育成熟时,对外界信号的传入及调控能力不高,也影响时间分辨率。
本试验结果表明在大鼠听觉系统发育过程中,最先发育的频段是中频区,随后向低频和高频扩展,听敏度在大约26天左右发育成熟;伴随着其听觉频率的不断扩展,听阈的降低,时间分辨率也逐渐成熟,大约在30天左右完成发育。
4 参考文献
1 Leitner DS, Hammond GR,Springer CP,et al.Parameters affecting gap detection in the rat[J]. Percept Psychophys, 1993,54:395.
2 Fitch RH, Threlkeld SW, McClure MM,et al.Use of a modified prepulse inhibition paradigm to assess complex auditory discrimination in rodents[J]. Brain Res Bull, 2008,76:1.
3 Friedman JT, Peiffer AM,Clark MG,et al. Age and experience-related improvements in gap detection in the rat[J]. Brain Res Dev Brain Res, 2004,152:83.
4 Ison JR, Allen PD,Rivoli PJ,et al.The behavioral response of mice to gaps in noise depends on its spectral components and its bandwidth[J]. J Acoust Soc Am, 2005,117:3 944.
5 Sun W, Hansen A, Zhang L,et al.Neonatal nicotine exposure impairs development of auditory temporal processing[J]. Hear Res, 2008,245:58.
6 Grecova J, Bures Z, Popelar J,et al.Brief exposure of juvenile rats to noise impairs the development of the response properties of inferior colliculus neurons[J]. Eur J Neurosci, 2009,29:1 921.
7 Romand R,Ehret G.Development of tonotopy in the inferior colliculus. I. Electrophysiological mapping in house mice[J]. Brain Res Dev Brain Res, 1990,54:221.
8 Walsh EJ,McGee J.Postnatal development of auditory nerve and cochlear nucleus neuronal responses in kittens[J]. Hear Res, 1987,28:97
9 Ehret G, Marean GC,Halpin CF, et al.Development of absolute auditory thresholds in the house mouse (Mus musculus)[J]. J Am Audiol Soc, 1976,1:179.
10 Chang EF,Bao S,Imaizumi K, et al.Development of spectral and temporal response selectivity in the auditory cortex[J]. Proc Natl Acad Sci USA, 2005,102:16 460.
11 Kelly JB, Rooney BJ,Phillips DP.Effects of bilateral auditory cortical lesions on gap-detection thresholds in the ferret (Mustela putorius)[J]. Behav Neurosci, 1996,110:542.
12 Ison JR, O'Connor K,Bowen GP,et al.Temporal resolution of gaps in noise by the rat is lost with functional decortication[J]. Behav Neurosci, 1991,105:33.
13 Siveke I, Ewert SD,Grothe B,et al.Psychophysical and phy-siological evidence for fast binaural processing[J]. J Neurosci, 2008,28:2 043.
