猪分离卵泡体外培养过程中Fas/FasL对颗粒细胞凋亡的作用
2010-12-25林鹏飞郝元斌郭慧利刘红林
林鹏飞,郝元斌,郭慧利,刘红林,芮 荣
(南京农业大学 动物医学院,江苏 南京 210095)
猪分离卵泡体外培养过程中Fas/FasL对颗粒细胞凋亡的作用
林鹏飞,郝元斌,郭慧利,刘红林,芮 荣*
(南京农业大学 动物医学院,江苏 南京 210095)
从猪卵巢分离完整有腔卵泡,按质量分为3类:健康卵泡、早期闭锁卵泡和晚期闭锁卵泡。猪分离卵泡经眼观检查后再行石蜡切片和HE染色,形态学研究表明,眼观检查对于健康卵泡的判定准确率为92%。取健康卵泡按直径大小分为3组:直径>5 mm大卵泡组、3~5 mm中卵泡组和<3 mm小卵泡组。卵泡培养8、16和24 h,以Annexin-V FITC/PI双染流式细胞仪检测壁层颗粒细胞凋亡情况,结果发现培养卵泡颗粒细胞的总凋亡率(早期凋亡+晚期凋亡)在8 h时就已达到70%以上,至24 h则为81.1%~94.6%。收集无血清培养0、8、16、24、48和72 h的卵泡颗粒细胞,用real time PCR SYBRgreen法检测各组卵泡颗粒细胞FasL和Fas mRNA相对表达量。各级卵泡颗粒细胞中FasL mRNA水平随培养时间显著增加,培养至24 h达最大值(P<0.05);小卵泡颗粒细胞FasL mRNA水平均高于大、中卵泡组。各级卵泡颗粒细胞Fas mRNA相对表达量在培养前(0 h)差异不显著,8 h时显著增加,48 h达最大值。该实验表明,所用无血清卵泡培养体系可有效诱导卵泡颗粒细胞的凋亡,细胞凋亡是卵泡闭锁的主要诱因,但卵泡闭锁程度可因卵泡大小而异,小卵泡似乎更容易发生闭锁。
猪;有腔卵泡;颗粒细胞;凋亡;Fas/FasL
哺乳动物卵巢上存在大量的各级卵泡,卵泡生长过程中仅有少数能够发育至成熟排卵,绝大部分归于闭锁。研究表明,颗粒细胞凋亡是导致卵泡闭锁的重要原因(Matsuda-minehata et al, 2006)。猪卵泡颗粒细胞凋亡至少与5种配体受体系统有关:肿瘤坏死因子α(tumor necrosis factor alpha, TNFα)和TNF受体系统;肿瘤坏死基因相关的凋亡诱导配体(TRAIL)和TRAIL受体系统;Fas配体受体系统;APO-3配体受体系统及PFG-5配体受体系统(Manabe et al, 2004)。TNFα的不同作用是通过特殊的细胞表面受体TNFR-1或TNFR-2来实现的,TNFR-1-TRADD-FADD-caspase-8信号转导通路能引起细胞凋亡,而TNFR-1-TRADD-RIP-TRAF-2信号传导通路则为存活因子。在卵泡闭锁早期,颗粒细胞层出现TNFR-2强烈免疫染色,表明在猪卵泡闭锁过程中TNFα是作为存活因子而起作用(Nakayama et al, 2003)。在TRAIL和TRAIL受体系统中,已发现的受体包括DR-4、DR-5和DcR-1。DcR-1只表达于猪健康卵泡颗粒细胞中,而TRAIL、DR-4和DR-5在闭锁卵泡颗粒细胞中高表达,说明TRAIL及其受体DR-4和DR-5与猪卵泡闭锁过程中颗粒细胞凋亡的诱导有关,DcR-1在颗粒细胞凋亡过程中起抑制作用(Inoue et al, 2003)。FasL与Fas是研究较多、也是最主要的一对死亡配体-受体,Fas也称Apo-l或CD95,是肿瘤坏死因子和神经生长因子受体(TNF/NGF-R)家族的细胞表面分子,它是FasL的受体;FasL是肿瘤坏死因子(TNF)家族的细胞表面分子。Fas和FasL在人类、大鼠、小鼠、牛、鸡及猪的卵巢上都有表达(Quirk et al, 1995; Chen et al, 2005; Dharma et al, 2003; Porter et al, 2000; Bridgham & Johnson, 2001; Inoue et al, 2006),但mRNA和蛋白表达存在种属特异性(Nakayama et al, 2000),因此作用机理在不同种类动物间也有差异。当缺少必要的存活因子或存在凋亡因子时,FasL与Fas结合,导致Fas胞内的死亡域形成三聚体而活化,并引起与之结合FADD构象改变,使caspase-8前体开始自动解蛋白的分裂和激活,产生有活性的caspase-8,从而激发一系列下游的caspase级联反应,诱发细胞凋亡(Matsuda-minehata et al, 2006)。
现有的对于Fas/FasL的研究多集中于各种动物腔前卵泡,而在有腔卵泡体外培养过程中颗粒细胞凋亡的研究迄今鲜见报道。本实验拟通过对猪卵巢完整卵泡的分离培养,测定并分析猪不同发育阶段有腔卵泡在不同培养时间的颗粒细胞凋亡率及Fas和FasL mRNA的表达量变化,以期了解Fas/FasL在猪有腔卵泡闭锁中的作用,为进一步了解猪有腔卵泡闭锁的机理提供实验资料。
1 材料与方法
实验所用各项试剂除特别说明者以外,均为SIGMA产品。
1.1 卵巢来源
猪卵巢采自南京市哈慈天环食品有限公司下属屠宰场,卵巢置于37℃无菌生理盐水(含青霉素、链霉素各500 IU/mL)中,2 h内送达实验室。
1.2 完整有腔卵泡的分离及分组
在无菌条件下,先用杜氏磷酸盐缓冲液(Dulbecco’s phosphate buffered saline, PBS)洗卵巢2~3次,放入含适量PBS平皿中,先用眼科剪剪去卵巢周围多余组织及系膜,再沿系膜缘将卵巢剪开,眼科镊细心剥离有腔卵泡,尽量去除其周围结缔组织,再细心剥离完整卵泡,置于PBS中。在实体显微镜下肉眼观察卵泡形态,按质量将所分离卵泡分为3类:(1)健康卵泡。卵泡壁结构完整、均匀、紧密,略呈粉红色或黄色,毛细血管分布均匀、色泽鲜红,卵泡液清亮,一般可见到卵丘。(2)早期闭锁卵泡。卵泡壁结构较均匀,但内层稍呈絮状化,或壁上有少量暗色斑块,卵泡略呈灰白色,血管较少或血管较粗大、颜色变淡,卵泡液稍混浊,少数可见到卵丘,(3)晚期闭锁卵泡。卵泡壁结构不均匀,颜色灰暗,毛细血管较少,内部絮状化严重或可见到卵泡内部有暗色的团快;卵丘一般不可见(Alonso-Pozos et al, 2003; Jolly et al, 1997)。取健康卵泡用于Fas和FasL mRNA检测,按直径大小又将其分为3组:大卵泡组卵泡直径>5 mm、中卵泡组直径为3~5 mm、小卵泡组直径<3 mm。
1.3 卵泡切片制作与HE染色
采用改进的切片制作方法分别处理3组卵泡,用Bouin氏固定液(苦味酸饱和水溶液75 mL、40%甲醛25 mL、冰醋酸5 mL)固定72 h;水洗、滤纸吸干后进行梯度酒精脱水(依次为30%、50%酒精各1 h,70%酒精24 h,80%、2次95%各2 h,2次无水酒精各1 h);然后转入二甲苯:无水酒精(v/v为1∶1)混合液中1h,二甲苯Ⅰ液、Ⅱ液各30 min(Ⅰ液、Ⅱ液均为100%二甲苯),至组织透明为止。经透明处理样本依次放入预先融化的石蜡:二甲苯(v/v为1∶1)中浸30 min,石蜡Ⅰ浸1 h,石蜡Ⅱ浸1 h;冷却后的蜡块经修整后采用常规方法切片;常规HE染色,封片后在光镜下观察。
1.4 完整卵泡的培养
大、中、小3组健康卵泡先用PBS洗2次、卵泡培养液洗1次。卵泡培养液为无血清TCM199(GIBCO产品)培养液,用24孔板进行培养,每孔加1.5 mL培养液并放入1个卵泡,培养条件为38.5℃、5%CO2气相和饱和湿度。分别于培养0(对照)、8、16、24、48和72 h,用眼科镊轻轻撕破卵泡,去除卵母细胞−卵丘复合体,挤压并翻开卵泡膜轻刮卵泡壁层颗粒细胞,直接用吸管吸取全部卵泡液和颗粒细胞,置于离心管内以2 000 r/min离心5 min,收集颗粒细胞直接冻存于−70℃用作凋亡分析。
1.5 Annexin V-FITC/PI细胞凋亡检测
经上述方法培养8、16和24 h的大、中、小卵泡,所获新鲜颗粒细胞按BIPEC Bioreagent凋亡试剂盒产品说明书所述步骤操作,细胞立即用4℃冰箱预冷的PBS液离心洗涤2次,去除PBS;再用PBS调整细胞密度至1×106细胞/mL,1 mL细胞中加入400 μL Binding Buffer悬浮细胞;加入5 μL Annexin V-FITC(膜联蛋白V-异硫氰酸荧光素),蜗旋混匀,置于4℃条件下避光反应15 min;添加10 μL PI(碘化丙啶),于4℃条件下避光反应5 min,1 h内进行流式细胞仪(BD FACSCanto)分析。每份样品检测10 000个细胞,所获数据经BD FACSDiva™software软件处理后,换算为细胞凋亡比例。在二维FCM分析图上,细胞分为4个亚群:左下象限为AnnexinV-FITC-/ PI-活细胞群,右下象限为AnnexinV-FITC+/PI-早期凋亡细胞;右上象限显示AnnexinV-FITC+/PI+细胞为晚期凋亡与坏死细胞,左上象限为AnnexinV-FITC-/ PI+操作过程中发生机械损伤的细胞。
1.6 样品总RNA制备与反转录
按Trizol(Invitrogen产品)试剂盒提供的说明书略加改进后,进行颗粒细胞总RNA抽提;生物分光光度计(BioPhotometer 6131)测OD值及总RNA浓度,1.2%琼脂糖凝胶电泳结合凝胶成像(Tanon GIS2500)检测RNA完整性。各取检测合格的上述RNA样品0.5 µg,用ReverTra Ace®qPCR RT Kit(TOYOBO公司)在TaKaRa PCR扩增仪上合成cDNA第一链,−20℃保存备用。
1.7 引物设计与real time PCR反应
根据目的基因库中mRNA序列和real time PCR对引物的要求,利用软件Oligo 6设计β-actin、Fas和FasL的特异性引物,引物由上海英俊生物技术有限公司合成(表1)。 应用real time PCR Master Mix Kit(TOYOBO公司)及MJ Opticon荧光定量PCR仪进行扩增。 反应体系包含SYBRgreen MIX 10 µL,上下游引物(10 µmol/L)各0.8 µL,cDNA模板2 μL,加Nuclease-free Water补足体积至20 μL。反应程序为:95℃ 30 s预变性,再在94℃ 5 s变性,β-actin(57℃)、FasL(58℃)、Fas(59℃)10 s退火,72℃15 s延伸,循环45次,反应结束后执行熔解曲线,确定反应产物的单一性。在定量PCR仪上记录每个样本的Ct值,结果分析采用相对定量法,以2-△△Ct获得的数值来比较在不同的处理之下,相对于内参β-actin各基因的mRNA的表达量(Livak & Schmittgen, 2001)。
1.8 数据统计分析
每个样本设置3次重复,每次实验均设立1个空白对照。所有数据以平均数±标准差(±s)表示,采用SPSS13.0统计软件One-Way ANOVA LSD法进行差异显著性检验,P<0.05判为差异显著。

表 1 Real time PCR引物序列Tab. 1 The primers sequence for the real time PCR
2 结 果
2.1 猪卵巢卵泡的分离与质量判定
在显微镜下可直接观察评价卵泡质量,但判定结果的准确性则往往与实验人员的经验有关。为验证本实验对猪分离卵泡直观形态学判断的准确性,按质量所分的3组卵泡经石蜡切片和HE染色后于镜下观察。各阶段卵泡形态学特征如下:(1) 健康卵泡的卵泡壁结构完整、均匀、紧密,略呈粉红色或少数见黄色,毛细血管分布均匀、色泽鲜红,卵泡液清亮,一般可见到卵丘。HE染色后,健康卵泡壁各层完整、层次清晰,颗粒细胞体积较大,细胞浆及细胞核染色均匀,核位于细胞中央,颗粒细胞层中仅有少量凋亡细胞,卵泡腔中无脱落的颗粒细胞。(2)早期闭锁卵泡在低倍镜下膜细胞与壁层颗粒细胞之间界限较清楚,卵泡壁外层完整,基膜部分退化,与颗粒层有不同程度的分离,颗粒层细胞彼此结合松散,有少量颗粒细胞脱落到卵泡腔中;高倍镜下颗粒细胞核膜皱缩,出现染色质凝缩,向核边缘聚集,部分可见凋亡细胞常见的典型的半月结构,胞质中出现少量的空泡。(3)晚期闭锁卵泡壁外层完整,基膜退化,与颗粒层有不同程度的分离,颗粒层细胞彼此结合变松散,颗粒细胞部分或全部脱落于卵泡腔中,颗粒细胞的细胞核呈深染,或碎裂为闭锁小体(图1)。形态学研究表明,眼观检查卵泡并分类的准确率在76%~92%之间(表2),对于健康卵泡的判定准确率达92%。依据这一结果,通过眼观检查选择健康卵泡用于后面的实验。
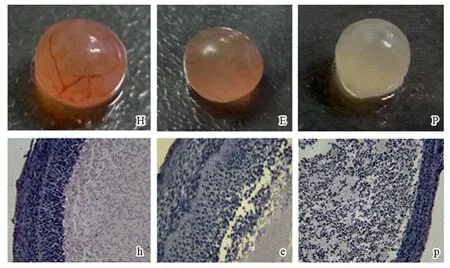
图 1 猪分离卵泡的眼观形态与组织学特征Fig. 1 Morphological observation and histological feature of porcine isolated follicles

表 2 猪不同质量卵泡眼观检查与组织学检查准确性的比较Tab.2 Comparison of the acuracy of classification by morphometric criteria with HE staining
2.2 体外培养卵泡的形态学变化
大、中、小3组健康的猪分离卵泡培养16 h后,各组卵泡均表现出卵泡壁结构完整、紧凑、无脱落细胞,血管逐渐变得不明显,各组卵母细胞都包被3层以上卵丘/颗粒细胞;中、小卵泡组卵泡液轻微浑浊,整个卵泡变得不透明。培养24 h的各组卵泡结构完整,但卵泡表面开始有细胞脱落,卵泡液浑浊。培养48 h后,大、中卵泡组常见卵泡塌陷、松弛;小卵泡的卵泡壁开始溶解,卵泡外脱落细胞增多并向周围扩散,卵泡液中颗粒细胞散在分布,整个卵泡外观发白,卵母细胞只包被1、2层卵丘细胞,且卵丘细胞排列疏松。卵泡壁溶解严重的小卵泡,其卵母细胞往往变成裸卵且开始退化。在整个培养过程中,卵泡体积未发生明显变化,仅前24 h略有缩小,可能是新鲜有腔卵泡的内压较大,培养初期卵泡液渗透到卵泡外所致。
2.3 培养卵泡颗粒细胞凋亡率的变化
分离卵泡培养8、16、24 h分别取颗粒细胞作凋亡检测,结果列如表3,部分测定的散点图见图2。
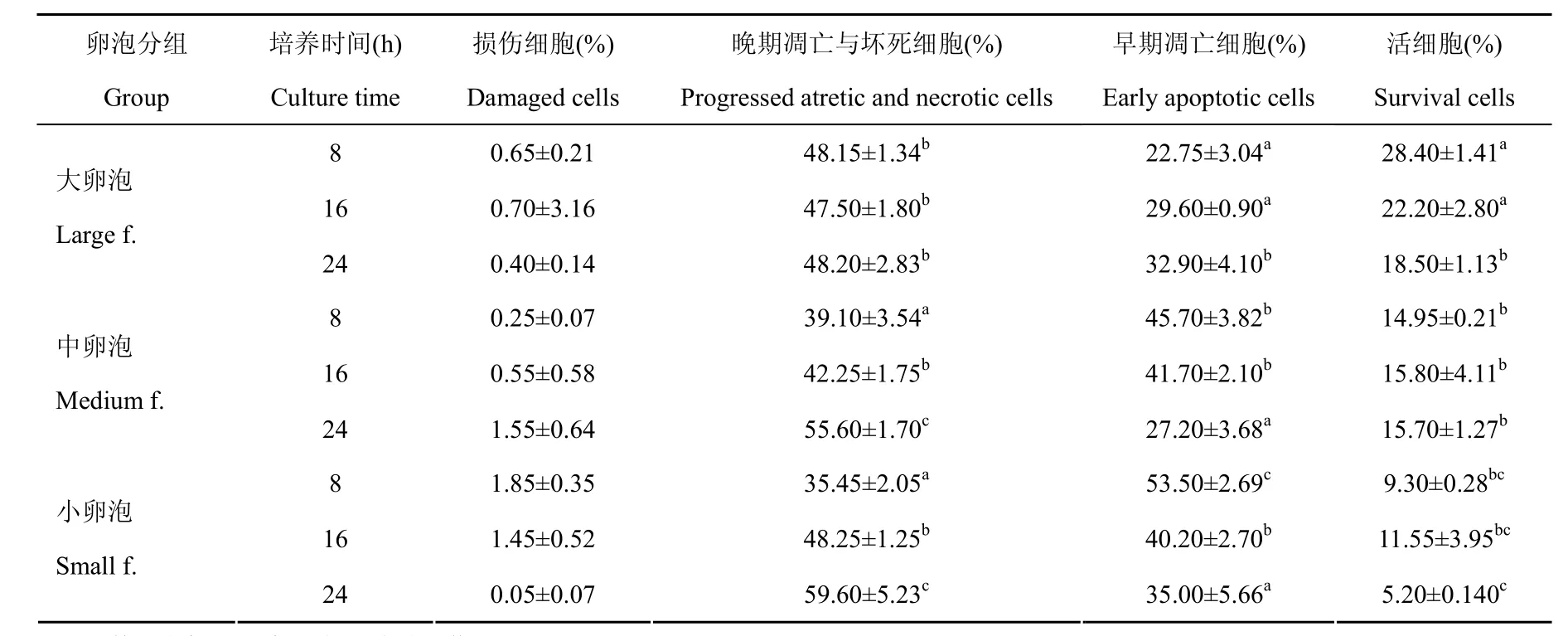
表 3 猪体外培养卵泡的颗粒细胞Annexin V-FITC/PI双染检测结果Tab. 3 Results of Annexin V-FITC/PI double-labeling examination for granulosa cells derived from porcine antral follicles cultured in vitro

图 2 部分颗粒细胞Annexin V-FITC/PI双染检测散点图Fig. 2 Partial scatterplots of granulosa cells examined by Annexin V-FITC/PI double-labeling
由表3可见,大、中、小卵泡培养8 h后,颗粒细胞均已出现大量凋亡,虽然大卵泡中活细胞比率显著高于中、小卵泡组(P<0.05),但也仅有28.4%。大卵泡培养早期的颗粒细胞凋亡率明显低于中、小卵泡组(P<0.05),晚期凋亡与坏死细胞比率显著增加(P<0.05)。中、小卵泡组的活细胞和晚期凋亡/坏死细胞差异不显著。小卵泡中大量颗粒细胞处于早期凋亡状态,显著高于其他各组。培养至16 h和24 h时,大卵泡组活细胞比率进一步减少,早期凋亡细胞数随之增加,而晚期凋亡与坏死细胞数变化不明显;中卵泡组培养后的活细胞比率变化不大,但早期凋亡细胞明显转为晚期凋亡与坏死细胞(P<0.05)。小卵泡组培养16 h活细胞数似乎略有增加,但无统计学差异;培养24 h时则显著下降(P<0.05),大量早期凋亡细胞转为晚期凋亡与坏死细胞(P<0.05)。本实验表明,所用无血清卵泡培养体系可有效诱导卵泡颗粒细胞的凋亡;在此培养过程中,小卵泡最易发生闭锁,而大卵泡明显较中、小卵泡组表现出高的抗凋亡能力。
2.4 卵泡培养过程中颗粒细胞FasL mRNA相对表达量的检测
收集培养0、8、16、24、48和72 h的卵泡颗粒细胞,用real time PCR SYBRgreen法检测各组卵泡颗粒细胞FasL mRNA相对表达量如图3。大、中、小卵泡颗粒细胞FasL mRNA的表达,随培养时间发生的整体变化趋势大致相似。颗粒细胞中FasL mRNA水平随培养时间显著增加,健康卵泡(0 h)的FasL mRNA水平在大、中、小卵泡无差异,培养至24 h均显著增高(P<0.05)。在培养过程中的每个时间点,小卵泡颗粒细胞FasL mRNA水平均高于大、中卵泡组,以培养16 h 时的增加最为显著(P<0.05),培养至24 h达最大值。
2.5 卵泡培养过程中颗粒细胞Fas mRNA的表达
培养前(0 h)的各级卵泡颗粒细胞Fas mRNA相对表达量差异不显著,培养至8 h均显著增加,48 h达最大值,72 h的Fas mRNA相对表达量虽较48 h的表达量稍有下降,但仍显著高于0 h(图4)。培养0~72 h的每个时间点内,大、中、小卵泡颗粒细胞的Fas mRNA相对表达量差异不显著。

图 3 猪大、中、小有腔卵泡培养不同时间后颗粒细胞FasL mRNA的表达Fig. 3 Expression of FasL mRNA in porcine granulosa cells derived from different size of antral follicles cultured in vitro
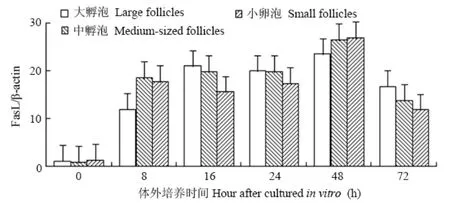
图 4 猪大、中、小卵泡培养不同时间后颗粒细胞Fas mRNA的表达Fig. 4 Expression of Fas mRNA in porcine granulosa cells derived from different size of follicles cultured in vitro
3 讨 论
无血清培养可诱导颗粒细胞和其它类型细胞发生凋亡(Parborell et al, 2005; Guthrie et al, 1998),是用于研究生殖激素、生长/细胞因子等作用凋亡通路的理想模型,它可有效避免血清培养时未知因素的干扰。本实验结果显示,各级有腔卵泡中壁层颗粒细胞的凋亡率在培养8 h即可大幅上升,培养24 h颗粒细胞表现为晚期凋亡与坏死状态者占50%以上,小卵泡壁层颗粒细胞的凋亡比例显著高于中、大卵泡组。本研究表明,所用无血清培养体系可诱导猪各级有腔卵泡发生闭锁,颗粒细胞凋亡是卵泡闭锁的主要诱因,但卵泡闭锁程度可因卵泡大小而异;卵泡大小不同,闭锁过程中颗粒细胞死亡的程度也不同,小卵泡似乎更容易发生闭锁。
Fas是一种细胞膜糖蛋白,FasL是Ⅱ类膜蛋白。Fas/FasL直接参与了细胞凋亡的调节,在各种动物的健康或闭锁卵泡颗粒细胞均有表达,并在闭锁卵泡高表达。健康卵泡的Fas定位在胞浆,而不是细胞膜,多以非活性状态存在;当卵泡发生闭锁时,Fas从胞浆转移到胞膜,与FasL结合引发颗粒细胞凋亡(Inoue et al, 2006)。在本实验中,Fas和FasL在猪各级有腔卵泡壁层颗粒细胞均有表达,在各级健康有腔卵泡的表达无差异;随着颗粒细胞凋亡率的上升,它们的表达量增加,显示出Fas/FasL系统对各级有腔卵泡闭锁具有重要的调节作用,可被去除血清等所激活。
完整卵泡内微环境对于维持颗粒细胞和卵母细胞的存活是必要的(Moor et al, 1998)。颗粒细胞间通过缝隙连接相互作用,颗粒细胞与卵母细胞间也通过透明带以微绒毛相互联系。卵母细胞与颗粒细胞的相互作用,对于决定卵泡命运起着重要的作用(Diaz et al, 2007)。Canipari et al(2000)认为,卵母细胞成熟与其后的胚胎发育能力取决于卵泡整体结构的完整。Maillet et al(2003)分离兔健康卵泡颗粒细胞进行培养,并与体外培养的完整卵泡颗粒细胞凋亡情况进行对比,发现两者对凋亡的敏感性不同,证明完整卵泡内的旁分泌机制可能在抑制颗粒细胞凋亡方面发挥了作用。Dharma et al(2003)应用马绒毛膜促性腺激素(eCG)诱导小鼠卵泡闭锁,证实在健康和闭锁卵泡颗粒细胞中均有Fas/FasL mRNA和蛋白的表达,但在健康卵泡卵母细胞中未检测到上述凋亡基因的表达,即使在闭锁卵泡卵母细胞也只检测到Fas的表达;认为颗粒细胞的FasL可与卵母细胞的Fas相结合,进而导致卵泡闭锁。本实验在卵泡培养的不同时间点收集壁层颗粒细胞时发现,卵丘−卵母细胞复合体(COC)的形态在培养的头24 h,几乎所有的卵母细胞都包裹3层以上的颗粒细胞,而培养16 h时卵泡液即变得不透明,培养24 h时镜下可见卵泡壁层颗粒细胞不再成片连接、呈散在分布状。经过完整卵泡培养所获的COC在进行卵母细胞成熟培养后,均未获得成熟(待发表资料),暗示本实验所用卵泡培养体系在诱导卵泡闭锁后,可能对卵母细胞继续发育造成了障碍。FasL mRNA在卵泡培养至24 h达最高,而Fas mRNA在卵泡培养至48 h达最高,可能暗示着配体对其受体的诱导作用。根据本实验对猪的培养卵泡的观察,培养16 h后中、小卵泡的卵泡液开始变得不透明,培养至24 h各组卵泡均表现为不透明,与此同时培养卵泡颗粒细胞的总凋亡率(早期凋亡+晚期凋亡)在8 h就已达到70%以上,至24 h则为81.1%~94.6%。
在牛和猪上,虽有完整有腔卵泡的分离,但尚未见到分离卵泡培养的报道。Inoue et al(2006)研究了直径3 mm左右卵泡颗粒细胞Fas/FasL mRNA的表达变化,发现Fas mRNA和FasL mRNA在猪健康与闭锁卵泡中均有表达,但健康卵泡表达量较低,闭锁时表达增加,且FasL mRNA表达增加显著。在牛上,Fas/FasL mRNA在闭锁卵泡颗粒细胞和泡膜细胞均为高表达。应用免疫组化分析发现,在闭锁卵泡中FasL蛋白在泡膜细胞浓染,而Fas蛋白则在颗粒细胞浓染,据此认为Fas/FasL对牛颗粒细胞和泡膜细胞有不同的调节方式,或存在调节Fas表达的其他机制(Porter et al, 2001)。本实验在分离猪有腔卵泡的基础上,通过体外培养来研究卵泡形态学变化,对卵泡培养过程中颗粒细胞的凋亡规律进行探讨,是一种独特的卵泡发育、闭锁研究的体外实验模型。
Alonso-Pozos I, Rosales-Torres AM, Ávalos-Rodrígueza A, Vergara-Onofre M, Rosado-García A. 2003. Mechanism of granulosa cell death during follicular atresia depends on follicular size [J].Theriogenology, 60: 1071-1081.
Bridgham JT, Johnson AL. 2001. Expression and regulation of Fas antigen and tumor necrosis factor receptor type I in hen granulosa cells [J].Biol Reprod, 65: 733-739.
Canipari R. 2000. Oocyte--granulosa cell interactions[J].Hum Reprod Update,6(3): 279-289.
Chen Q, Yano T, Matsumi H, Osuga Y, Yano N, Xu J, Wada O, Koga K, Fujiwara T, Kugu K, Taketani Y. 2005. Cross-talk between Fas/Fas ligand system and nitric oxide in the pathway subserving granulosa cell apoptosis: a possible regulatory mechanism for ovarian follicle atresia [J].Endocrinology, 146: 808-815.
Dharma SJ, Kelkar RL, Nandedkar TD. 2003. Fas and Fas ligand protein and mRNA in normal and atretic mouse ovarian follicles [J].Reproduction, 126: 783-789.
Diaz FJ, Wigglesworth K, Eppig JJ. 2007. Oocytes determine cumulus cell lineage in mouse ovarian follicles [J].J Cell Sci,120: 1330-1340.
Guthrie HD, Garrett WM, Cooper BS. 1998. Follicle-stimulating hormone and insulin-like growth factor-I attenuate apoptosis in cultured porcine granulosa cells [J].Biol Reprod, 58: 390-396.
Inoue N, Maeda A, Matsuda-minehata F, Fukuta K, Manabe N. 2006. Expression and localization of Fas ligand and Fas during atresia in porcine ovarian follicles[J].J Reprod Dev, 52(6): 723-730.
Inoue N, Manabe N, Matsui T, Maeda A,Nakagawa S, Wada S, Miyamoto H. 2003. Roles of tumor necrosis factor-related apoptosis-inducing ligand signaling pathway in granulosa cell apoptosis during atresia in pig ovaries [J].J Reprod Dev, 49: 313-321.
Jolly PD, Smith PR, Heath DA, Hudson NL, Lun S, Still LA, Watts CH, McNatty KP. 1997. Morphological evidence of apoptosis and the prevalence of apoptotic versus mitotic cells in the membrana granulosa of ovarian follicles during spontaneous and induced atresia in ewes [J].Biol Reprod, 56: 837-846.
Livak KJ, Schmittgen TD. 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△Ct method [J].Methods, 25: 402-408.
Maillet G, Benhaïm A, Mittre H, Féral C. 2003. Involvement of theca cells and steroids in the regulation of granulosa cell apoptosis in rabbit preovulatory follicles [J].Reproduction,125(5): 709-716.
Manabe N, Goto Y, Matsuda-Minehata F, Inoue N, Maeda A, Sakamaki K, Miyano T. 2004. Regulation mechanism of selective atresia in porcine follicles: regulation of granulosa cell apoptosis during atresia [J].J Reprod Dev, 50(5): 493-514.
Matsuda-minehata F, Inoue N, Goto Y, Manabe N. 2006. The regulation of ovarian granulosa cell death by pro- and anti-apoptotic molecules [J].J Reprod Dev, 52(6): 695-705.
Moor RM, Dai Y, Lee C, Fulka J Jr. 1998. Oocyte maturation and embryonic failure [J].Hum Reprod Update, 4(3): 223-236.
Nakayama M, Manabe N, Inoue N, Matsui T, Miyamoto H. 2003. Changes in the expression of tumor necrosis factor (TNF)α, TNF ɑ receptor (TNFR) 2 and TNFR-associated factor 2 in granulosa cells during atresia in pig ovaries [J].Biol Reprod, 68: 530-535.
Nakayama M, Manabe N, Nishihara S, Miyamoto H. 2000. Species specific differences in apoptotic cell localization in granulosa and theca interna cells during follicular atresia in porcine and bovine ovaries [J].J Reprod Dev, 46: 147-156.
Parborell F, Irusta G, Vitale A, Gonzalez O, Pecci A, Tesone M. 2005. Gonadotropin-releasing hormone antagonist antide inhibits apoptosis of preovulatory follicle cells in rat ovary [J].Biol Reprod, 72: 659-666.
Porter DA, Vickers SL, Cowan RG, Huber SC, Quirk SM. 2000. Expression and function of Fas antigen vary in bovine granulosa and theca cells during ovarian follicular development and atresia [J].Biol Reprod, 62: 62-66.
Quirk SM, Cowan RG, Joshi SG, Henrikson KP. 1995. Fas antigen-mediated apoptosis in human granulosa/luteal cells[J].Biol Reprod, 52: 279-287.
Role of Fas/FasL on Apoptosis of Porcine Follicular Granulosa Cells Derived from Isolated Follicles During Culturein vitro
LIN Peng-Fei, HAO Yuan-Bing, GUO Hui-Li, LIU Hong-Lin, RUI Rong*
(College of Veterinary Medicine, Nanjing Agricultural University, Nanjing210095,China)
The whole antral follicles were isolated from porcine ovaries and classified as follows: healthy follicles (HF), early atretic follicles (EF) and progressed atretic follicles (PF). The isolated porcine follicles were used for routine histological section and HE staining after examination by eyesight. Morphological research shows that the accuracy rate of eyesight examination for HF is 92%. Healthy follicles were chosen for further experiment and divided into 3 groups: large follicles (∅>5 mm), medium follicles (3−5 mm) and small follicles (<3 mm). All follicles were cultured for 8, 16 and 24 h, respectively and the apoptosis of of their granulosa cells were examined by Annexin V-FITC/PI double-labeling. It showed that the total apoptotic rate of granulosa cells derived from cultured follicles could reach over 70% at 8 h after culture and be 81.1% − 94.6% at 24 h after culture. Granulosa cells from groups were collected at 0, 8, 16, 24, 48 and 72 h after culture without serum and used for the examination of expression of FasL and Fas mRNA with real time PCR SYBRgreen method. The expression level of FasL mRNA of granulosa cells from different size of follicles increased with culture time and reached the highest level at 24 h after culture (P<0.05). Expression level of FasL mRNA of granulosa cells from small follicles was higher than those from large and medium follicles. There exists no difference for expression level of Fas mRNA of granulosa cells among groups before culture but significantly increased at 8 h after culture and reached the highest level at 48 h after culture. It showed in the present experiment that the follicular culture system without serum used could effectively induce the apoptosis of follicular granulosa cells. Cell apoptosis is the main cause of follicular atresia, the degree of which varied with the size of follicles. Small follicles seemed to be easier atretic than medium and large follicles.
Swine; Antral follicles; Granulosa cells; Apoptosis; Fas/FasL
林鹏飞(1982-),男,内蒙古乌蒙人,南京农业大学博士研究生,研究方向为动物生殖生物学
Q959.842;Q952.4;Q245
A
0254-5853-(2010)03-0268-07
10.3724/SP.J.1141.2010.03268
2009-06-22;接受日期:2009-12-29
国家高技术研究与发展计划(2008AA101003);国家基础研究发展规划“973”项目(2007CB947403)
*通讯作者(Corresponding author),Tel:025-84395595,Email:rrui@njau.edu.cn
