萼花臂尾轮虫种复合体遗传分化的空间格局
2010-12-25项贤领席贻龙温新利张晋艳
项贤领, 席贻龙, 温新利, 张晋艳, 马 芹
(安徽师范大学 生命科学学院;安徽省高校“生物环境与生态安全”省级重点实验室,安徽 芜湖 241000)
萼花臂尾轮虫种复合体遗传分化的空间格局
项贤领, 席贻龙*, 温新利, 张晋艳, 马 芹
(安徽师范大学 生命科学学院;安徽省高校“生物环境与生态安全”省级重点实验室,安徽 芜湖 241000)
对采自中国东部8个地理区域中的萼花臂尾轮虫种复合体(Brachionus calyciflorusspecies complex)内124个轮虫克隆的核DNA ITS区进行了测序和分析,重建了萼花臂尾轮虫种复合体的系统发生树。研究发现,73个单倍型聚合为3个支系,支系间序列差异百分比为4.2%~25.3%,表明萼花臂尾轮虫实际上是由3个隐种组成的种复合体,在广州、儋州和芜湖采样点均具有隐种共存现象。萼花臂尾轮虫种复合体的核苷酸多样性和单倍型多样性均较高,隐种Ⅲ内各种群间遗传分化指数也较高,这可能是由于栖息地片段化和有限的基因流导致的。另外在冰期瓶颈后拓殖种群的快速增长也阻碍了有效基因流,并加速了地理种群间的遗传分化。巢式支系分析显示部分巢支具有一定的系统地理格局,而Mantel检验表明,种群间平均净遗传距离及遗传分化指数和地理距离间均无显著相关性。末次盛冰期之后的新仙女木事件(Younger Dryas Event,YD)可能对我国萼花臂尾轮虫隐种的分布和地理格局造成较大影响。在YD时期,3个萼花臂尾轮虫隐种可能退缩并共存于南岭以南地区的多个残遗种避难所,而此后的休眠卵长距离拓殖并伴随后期的栖息地片段化可能是形成当前地理格局的主要原因。萼花臂尾轮虫种复合体在全球范围内的地理分布可能与大陆板块构造运动有关。
萼花臂尾轮虫;种复合体;遗传分化;空间格局;巢式支系分析;系统地理学
系统地理学是研究物种及物种内不同种群形成现有分布格局的历史原因和演化过程的一门学科,其研究的核心是遗传谱系空间分布的历史特征(Avise & Hamrick, 1996)。通过对种群遗传结构的分析来探讨种内系统地理格局的形成机制、系统发育关系以及现有分布特征,并结合种群的地理分布状况来发现和验证与其相关的地质事件,追溯和揭示种群的进化历程(Avise et al, 1987; Avise, 1998),这对理解种群分化、物种形成、生态适应和历史气候变化等进程具有重要意义(Avise, 2000)。生物体分布格局的形成原因不仅包括生物因素(如扩散、适应、物种形成、灭绝以及生物之间的相互作用等),还应当包括地理历史因素(如板块构造运动、海平面升降、气候变化和海洋洋流变化等)(Chen et al, 2006)。山脉、河流等自然地理条件对生物扩散具有一定的隔离屏障作用,维持甚至加速了种群的局域性分化(Hebert et al, 2003; Taylor et al, 1998; Cox & Hebert, 2001)。地理历史上的拓殖事件以及物种分布区的扩张或退缩也会对种群的遗传结构产生重要影响。我国是惟一跨越六大动物地理区(古北界、新北界、旧热带界、东洋界、新热带界和澳洲界)中两个主要地理区(古北界与东洋界)的国家, 加之地处欧亚大陆东南端,地球地质历史上的一些重大事件(如印度板块与欧亚板块的碰撞、青藏高原的隆起以及末次盛冰期以来的新仙女木事件等)都对我国的气候和动物地理分布产生直接影响,使得我国成为研究世界动物区系演化与生物地理学的关键地区之一(Miao et al, 2003)。
目前,系统地理学研究主要集中在对高等动植物系统地理格局的分析上(Taberlet & Bouvet, 1994; Johnson et al, 1999; Fernando et al, 2000; Edwards & Gadek, 2001),而关于浮游动物系统地理学的研究仅局限于枝角类溞属(Daphnia)(Hebert, 1987; Innes, 1991; De Meester, 1996; Vanoverbeke & De Meester, 1997; Weider et al, 1999a, b; Hebert et al, 2003; Penton et al, 2004; De Gelas & De Meester, 2005)、褶皱臂尾轮虫种复合体(Brachionus plicatilisspecies complex)(Gómez et al, 2000, 2002a, b; Gómez, 2005; Mills et al, 2007)和螅状独缩虫(Miao et al, 2003),其中的原因除了长期以来认为大多数浮游动物种群可以休眠体形式通过风力、水流和水禽等介质传播而形成全球性分布以至于不存在地理分化外,还由于浮游动物个体小,寻找不同种群间形态结构差异相对比较困难(Miao et al, 2003)。迄今为止,关于浮游动物的系统地理格局主要包括以下两种不同的观点:一种观点认为少数有建群效应的休眠体在经历了历史拓殖事件后,种群会有一个快速增长期,从而有效阻止了由基因流引起的等位基因频率的变化(Boileau et al, 1992)。此外,这些定殖种群对栖息地环境的快速适应(De Meester, 1993, 1996; Okamura & Freeland, 2002)以及它们所拥有的庞大的休眠卵库(Hairston, 1996)均进一步强化了建群效应的持久性。因此,这些种群表现出高度的遗传分化和显著的系统地理格局(Gómez et al, 2000, 2002a, b, 2007; Gómez, 1997, 2005; Hebert, 1998; Mills et al, 2007),种群间的遗传距离随着地理距离的增加而增加。这些进程已由De Meester et al(2002)整合定名为“独占假说”;另一种观点认为由于浮游动物在整个休眠卵阶段具有高度的扩散能力,休眠体的长距离拓殖限制了种群分化和局域性适应,从而使得种群间遗传距离比期望值小,遗传多样性降低,无法形成系统的地理格局,种群间遗传距离和地理距离间没有显著的相关性(Weider et al, 1999a; Innes, 1991; Dong & Niu, 2004; Mergeay et al, 2005; Ishida & Taylor, 2007; Muñoz et al, 2008)。
浮游动物多样的地理分布格局可能与其隐种混杂和季节替代有关。大多数浮游动物都具有高度的扩散能力和广泛的地理分布(Hebert, 1987; Ruttner-Kolisko, 1974; Koste, 1978; Wallace & Snell; 2001),广布种在其分布区常常表现出广泛的形态变异,如高度的表型可塑性或周期变形,以及由于高度的形态停滞而引起的形态学一致性(De Gelas & De Meester, 2005),这些均会导致我们对隐性物种形成的忽视(Hutchinson, 1967; Knowlton, 1993; Hebert, 1998),从而使得许多物种的确定可能存在错误。近期的分子系统学研究表明,这些在较大地理尺度上分布的广布种,尤其是来自不同大陆的地理种群间存在多个遗传谱系或隐种(Taylor et al, 1998; Gómez et al, 2000, 2002b; Cox & Hebert, 2001; Hebert et al, 2003; Penton et al, 2004; Gilbert & Walsh, 2005),所谓的广布种事实上可能是隐种复合体(Gómez et al, 2002b; Gómez, 2005; Gilbert & Walsh, 2005; Ciros-Pérez et al, 2001; Derry et al, 2003),即使在较小的地理范围内,这些广布种的地理种群间也存在高度的遗传分化(Hebert, 1987; Carvalho, 1994; De Meester, 1996; Ortells et al, 2000, 2003; Gómez et al, 2002b; Suatoni, 2003; Gómez, 2005; Li et al, 2008)。另外,在同一水体中还存在季节种群间的遗传分化或隐种共存(Gómez et al, 1995; Ortells et al, 2003; Cheng et al, 2008)。因此,种群遗传结构研究中必须首先进行物种分化的相关研究,尤其是当该物种被怀疑可能存在隐种时(Ortells et al, 2003),从而避免隐种混杂和季节替代对轮虫种群遗传分化的空间格局分析产生干扰。
萼花臂尾轮虫(Brachionus calyciflorus)是常见的淡水轮虫种类之一,具有典型的周期性孤雌生殖特点,长期被看做是世界性分布的广布种。然而,近期的研究表明,它也是一个种复合体(Gilbert & Walsh, 2005; Cheng et al, 2008; Li et al, 2008)。有关萼花臂尾轮虫的系统地理学研究目前只涉及少数地理区域(Dong & Niu, 2004),在较大地理尺度上对其种群遗传分化的空间格局研究尚未见报道。
为了避免轮虫种群遗传结构的季节变异对空间格局分析可能产生的影响,本研究选择在各采样点间水温差异最小(28~35℃)时(2007年7月和8月)进行了样品采集。以核DNA ITS序列(ITS1-5.8S-ITS2)为分子标记,对采自中国东部沿纬度梯度分布的8个地理区域的124个萼花臂尾轮虫克隆进行测序和分析,以便我们正确认识轮虫种群遗传分化的空间格局和形成机制,探明轮虫隐种同域共存的历史原因。
1 材料与方法
1.1 样品采集和DNA提取
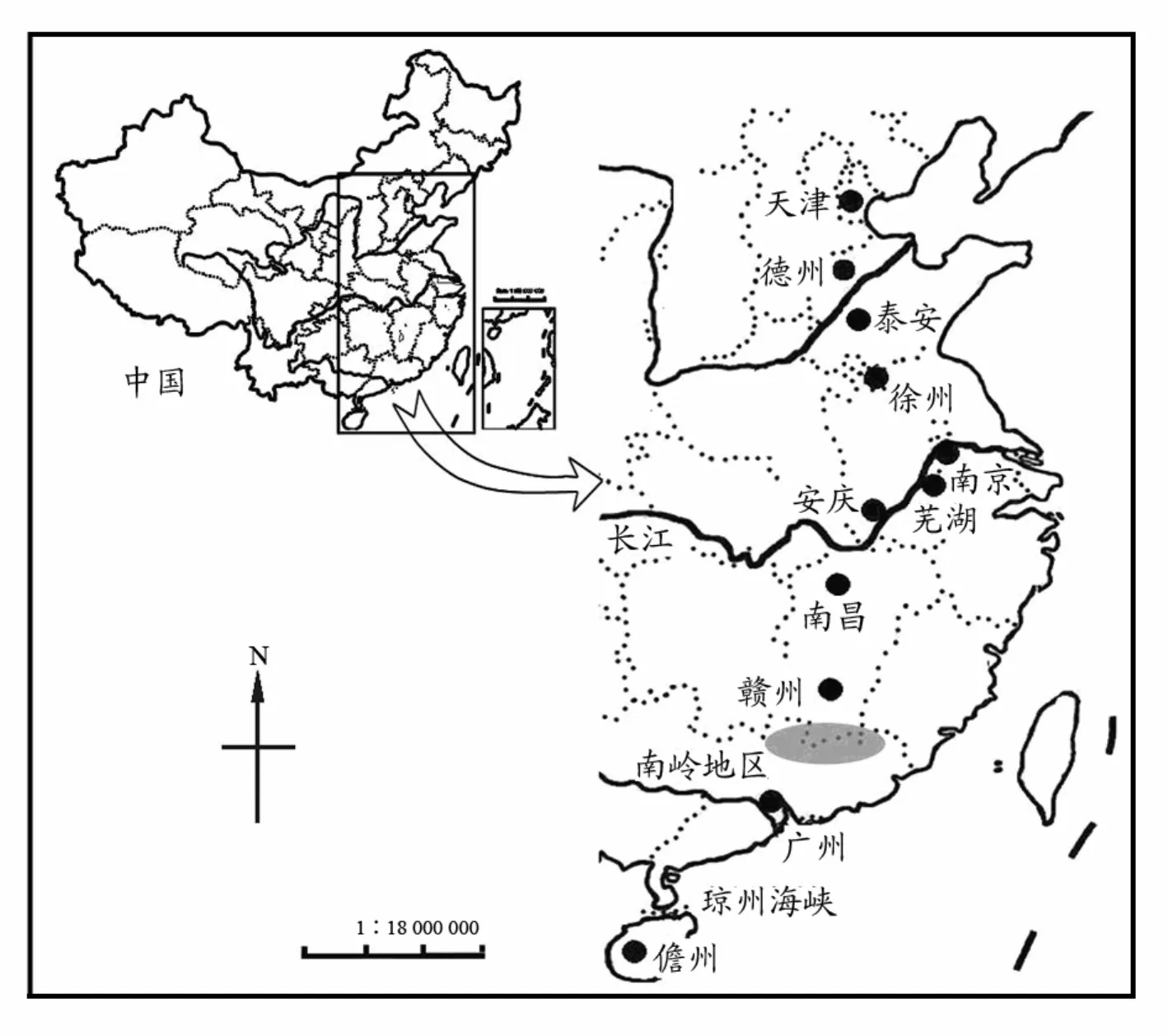
图 1 萼花臂尾轮虫种复合体采集点分布图Fig. 1 Sampling localities for Brachionus calyciflorus species complex in this study
实验用萼花臂尾轮虫于2007年7—8月分别采自中国天津、德州、泰安、徐州、南京、芜湖、安庆、南昌、赣州、广州和儋州(图1)。采集轮虫样品的同时,测定水温、pH值和氨氮浓度等水体理化因子(表1)。样品采集后,于各地理种群内分别挑取约200个萼花臂尾轮虫雌体,在自然光照(光照强度约130 lx,L∶D=14∶10和与采样点水温相近的温度条件下进行克隆培养。培养液采用Gilbert(1963)配方(pH=7.3),所用饵料为HB-4培养基(Li et al, 1959)培养的、处于指数增长期的斜生栅藻(Scenedesmus obliquus),培养时间在1个月以上。当各克隆轮虫达较高密度(200~300 ind./mL)时,用轮虫培养液过滤冲洗,饥饿24 h后用70%酒精固定保存。由于实验室内轮虫克隆培养难度较大,只有部分轮虫个体的克隆培养获得成功;赣州、南昌和泰安等3个地理种群由于仅建立1~2个克隆而未被使用,最终124个轮虫克隆数据被纳入本次分析。
用玻璃粉法提取基因组DNA(Xiang et al, 2006)。具体方法为:离心获得轮虫样品,置于1.5 mL Eppendorf管中,加500 μL DNA提取缓冲液(0.5% SDS,25 mmol/L EDTA,25 mmol/L NaCl,100 mmol/L Tris-HCl,pH8.0)和20 μL蛋白酶K(20 μg/mL),置60℃水浴2 h;加500 μL 8 mol/L预热后的硫氰酸胍和40 μL(1∶1)的洁净玻璃粉乳液,混匀后置37℃水浴1 h,不时摇动;取出4 000 r/min离心2 min,弃去上清液;沉淀用70%冰乙醇清洗2次,再用丙酮清洗1次;置真空干燥机中干燥。加TE(pH8.0)40 μL,置56℃水浴30 min,取出,8 000 r/min离心2 min,吸上清液,置−20℃保存备用。
1.2 PCR扩增和测序
PCR扩增在Bio-Rad公司生产的iCycler扩增仪上进行。ITS序列(ITS1-5.8S-ITS2)引物为宝生物工程(大连)有限公司合成的LH2(5'-GTCGAATTCGTAGGTGAACCTGCGGAAGGATCA-3')和Dlam (5'-CCTGCAGTCGACAKATGCTTAARTTCAGCRGG-3')(Xi et al, 2003)。反应体系包括1×Buffer,0.2 mmol/L dNTP,0.2 μmol/L引物,2 mmol/L Mg2+,DNA模板4 μL,4 U的Taq酶,超纯水补至50 μL。扩增程序如下:94℃预变性5 min;94℃变性1 min,55℃退火1.5 min,72℃延伸2 min,共35个循环;最后72℃延伸10 min,4℃保存。扩增产物在1.5%的琼脂糖凝胶(含0.5 μg/mL EB)中电泳检测,并使用AxyPrepTMPCR纯化试剂盒(AXYGEN)纯化,然后连接到pMD 19-T载体(Takara)并转化进入DH5α大肠杆菌体内。用质粒提取试剂盒提取含有目的片段的质粒DNA,ABIPRISM 3730型自动测序仪进行序列测定。
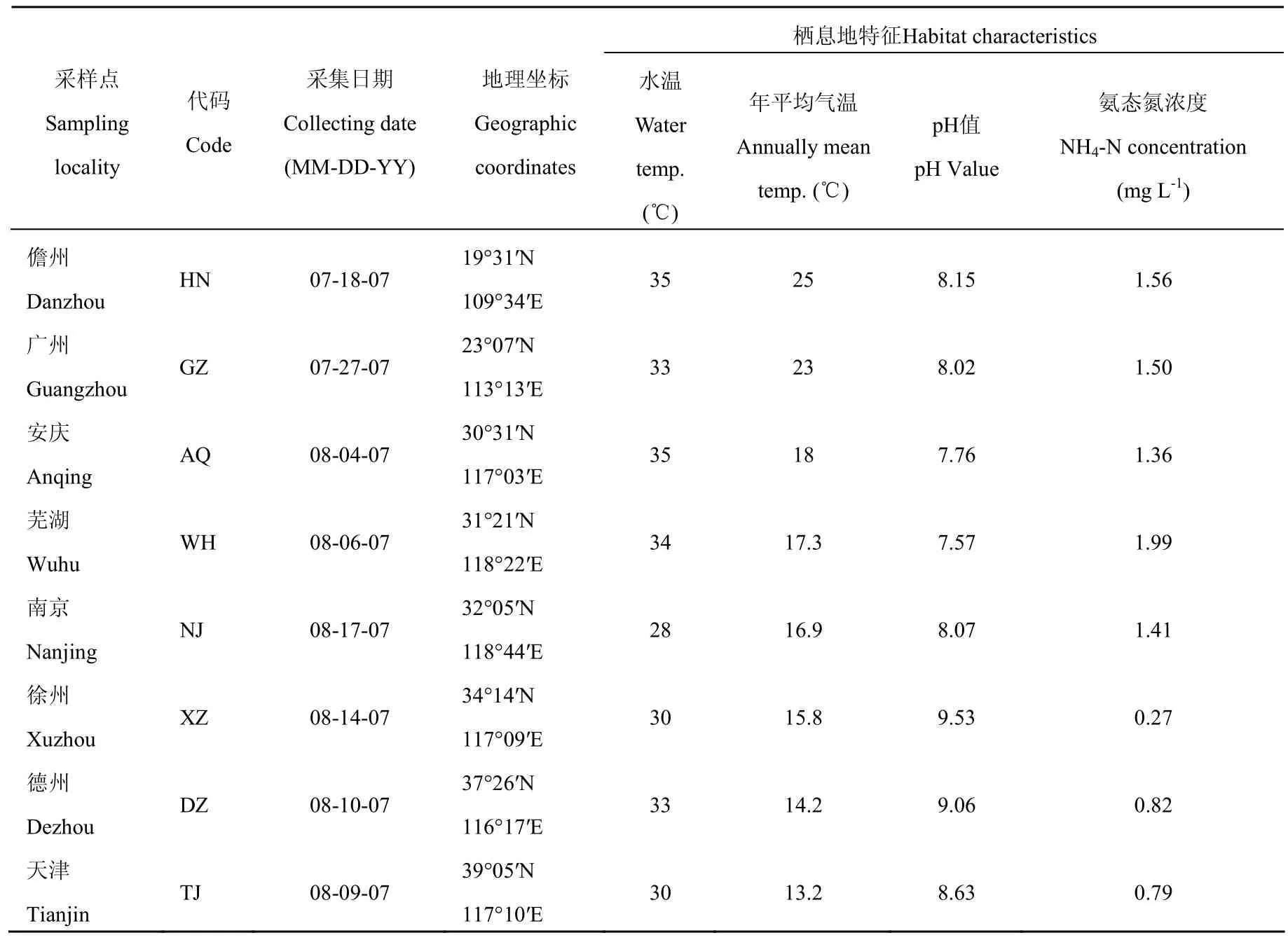
表 1 采样点信息Tab. 1 Summary information of sampling localities in this study
1.3 数据分析
采用CLUSTAL X(1.8)软件(Thompson et al, 1997)进行序列对位排列,并辅以人工校对;用DNASTAR软件计算两两序列的序列差异百分比;再用DnaSP 5.1软件(Librado & Rozas, 2009)分析变异位点、多态位点、简约信息位点、单倍型多样性(h)、核苷酸多样性(π)和种群间平均净遗传距离(Da)。
为了在更大范围内探讨轮虫谱系关系,本研究引用了GenBank中用于探讨萼花臂尾轮虫谱系关系的ITS序列,它们分别采自乔治亚(Georgia)、佛罗里达(Florida)、德克萨斯(Texas)和澳大利亚(Australia)(Gilbert & Walsh, 2005)以及中国芜湖(Wuhu)(Zhang, 2009),序列登录号分别为DQ071668-DQ071671和EU978878。以剪形臂尾轮虫(B. forficula)为外群,运用PAUP*4.0b10软件(Swofford, 2002),采用启发式搜索的方法,分别以最大似然法(maximum likelihood,ML)、最大简约法(maximum parsimony,MP)和邻接法(neighbor joining method,NJ)构建系统发生树。 采用Modeltest 3.7(Posada & Crandall, 1998)中的赤池信息准则(Akaike information criterion, AIC)检测用于ML分析的最佳模型,模型检测表明,最适模型为TVM+G(P<0.001),Base = (0.2953 0.1752 0.1806),Nst=6,Rmat=(1.1595 3.8251 2.5981 0.5005 3.8251),Rates=gamma,Shape=0.8567。MP和NJ系统树各结点的支持率以序列数据集1 000次重复抽样检验的自引导值(Bootstrap value)(Felsenstein, 1985)表示,而ML系统树则以100次重复抽样检验的自引导值表示。贝叶斯法构建系统树利用MrBayes 3.1.2软件(Ronquist & Huelsenbeck, 2003)进行,其中马尔科夫链的蒙特卡洛方法(Markov Chain Monte Carlo)设置为4条链(3条热链、1条冷链)同时运行,重复一次。采用最适合的DNA进化模型TVM+G,以随机树为起始树,运行6 00万代,每100代抽样一次,在舍弃老化样本后,根据剩余的样本构建一致树,节点置信度以后验概率(posterior probability, PP)评价。
应用Arlequin 3.1(Excoffier & Schneider, 2005)中的分子变异分析(analysis of molecular variance, AMOVA)方法检测种群间和种群内的遗传变异组成并估算地理种群遗传分化指数(F-statistics,Fst)。同时,利用Arlequin软件包中的Mantel统计学检验(Mantel, 1967),分别比较平均净遗传距离(Da)和遗传分化指数(Fst)与地理距离矩阵之间的相关性,并进行1 000次重复的显著性检验。采样点环境因子(水温、年平均气温、pH值和氨态氮浓度)与种群遗传学参数(单倍型多样性h、核苷酸多样性π以及遗传分化指数Fst)间的相关性分析采用SPSS 16.0(SPSS Inc., Chicago, IL, USA)完成。
ITS序列单倍型之间的网络关系用Network 4.510(Bandelt et al, 1999; available from http://www.fluxus-engineering.com)程序中的Median-Joining进行分析。这样得到的网络关系树是一种无根的系统进化树,各单倍型之间由突变连接。然后按照Templeton et al(1987)和Templeton & Sing(1993)组巢原则构建单倍型巢式支系图:处在网络关系树边缘、只与一个支系或单倍型连接的支系或单倍型称为末支(tip clade);而与一个以上支系或单倍型连接的支系或单倍型称为内支(interior clade)。通常认为,在同一支系内,末支和内支分别代表了在进化上较晚和较早的支系或单倍型(Castelloe & Templeton, 1994)。组巢的基本原则是从单倍型水平开始,将末支与其相连的内支组为一个一级支系;之后再对一级支系对应的末支、内支组巢成为二级支系,直到单倍型网络关系树组为一个大的完整支系为止。基于巢式支系图,进行巢式支系分析(nested clade analysis, NCA):首先利用Geodis 2.5程序(Posada et al, 2000)计算不同支系(从一级支系到一个大的支系)内两种类型的距离,巢内距离(Dc)表示某支系或某单倍型所有个体与该支系或该单倍型地理分布中心的平均距离,即该支系的地理分布范围;巢间距离(Dn)表示某支系或某单倍型所有个体与包含该支系的高一级水平地理分布中心的平均距离,即该支系与进化上相近的支系间的地理分布关系;另外,在所有组巢水平各个支系内还要计算内支两种距离均值与末支两种距离均值之差(即各个支系内I-T的Dc和Dn)。同时,通过1 000次的随机选择来检验上述数值的显著性大小;最后,根据上述的两种距离结果,参照Templeton(2004)给出的对巢式支系图不同水平支系距离格局的检索表推测单倍型地理分布格局的历史成因。
2 结 果
2.1 萼花臂尾轮虫种复合体的序列变异和遗传多样性
萼花臂尾轮虫种复合体内124个克隆的ITS区序列长度在759~785 bp之间,比对后长809 bp,其中变异位点253 bp,多态位点226 bp,简约信息位点185 bp,从而定义了73个单倍型。A、T、C和G碱基平均含量分别为28.9%、36.2%、16.6%和18.3%,其中A+T含量(65.1%)明显高于C+G含量(34.9%),表现出明显的反G偏倚。儋州样品的A+T含量稍有偏高(65.9%),C+G含量较平均值稍微偏低(34.1%),其它各采样点样品间的碱基组成变化不大。所有样品测序结果已提交至GenBank(序列登录号GU012678-GU012801)。大部分单倍型都分布在单一采样点中,另外有12个共享单倍型分布在两个或两个以上的采样点(表2)。平均核苷酸多样性和单倍型多样性分别为0.0529(±0.0078SD)和0.960(±0.008SD)(表2),各采样点样品的核苷酸多样性(π)与单倍型多样性(h)之间并不呈现显著的相关关系。广州、儋州、南京和芜湖样品的核苷酸多样性均高于平均核苷酸多样性。对各采样点样品间净遗传距离(Da)的分析显示,芜湖样品和徐州样品与其他各采样点样品间具有较高的Da值(表3)。
2.2 系统发生关系
运用贝叶斯法、最大似然法、最大简约法(未示出)和邻接法(未示出)构建的系统发生树的拓扑结构基本一致(图2—3),均将73个单倍型分成3个支系:支系Ⅰ(Clade Ⅰ)、支系Ⅱ(Clade Ⅱ)和支系Ⅲ(Clade Ⅲ),且置信度较高。支系Ⅰ涵盖的单倍型数最少(7个),全部为来自儋州采样点的样品;支系Ⅱ包括了13个儋州单倍型、11个广州单倍型、2个芜湖单倍型和1个儋州与广州共享单倍型;剩下的39个单倍型全部归入支系Ⅲ,分布于8个采样点。所有73个单倍型间序列差异百分比为0%~25.3%,平均5.97%,最大的序列差异位于共享单倍型SH9和单倍型HN14间。支系Ⅰ、支系Ⅱ和支系Ⅲ内部的ITS区序列差异百分比分别为0%~1.7%、0%~0.8%和0%~2.4%;支系Ⅰ和支系Ⅱ,支系Ⅰ和支系Ⅲ以及支系Ⅱ和支系Ⅲ间的序列差异百分比分别为23.7%~25.3%、23.9%~25.3%和4.2%~6.2%。根据Gilbert & Walsh(2005)对不同地理品系萼花臂尾轮虫的交配实验和ITS区序列分析结果,不同地理品系萼花臂尾轮虫间ITS区序列差异百分比大于4%时具有生殖隔离,为不同的隐种。因此本研究中的这3个支系应该属于不同的隐种,在本文中分别临时命名为隐种Ⅰ、Ⅱ和Ⅲ。
表1罗列了PISA与中考数学在不同内容主题上的分布,可清楚地得出PISA题和中考题对运算和几何概念考察比例相差不大,不过中考题的三角几何知识所占比例较大;PISA题的数据展示、统计和概率相加达到34%,高于中考题;另一方面,中考题包括函数的知识,而在PISA题内并未涉及,而PISA题中涉及的测量和消费者应用方面,在中考题中也未出现.表2罗列了从认知要求维度上的分布情况,可得两者执行程序认知所占的比例都非常高,中考题涉及的回忆的知识和证明题较多,而PISA题中解决非常规问题比例较高.因此PISA题倾向与要求学生解决一些实际问题,建立数学和实际的联系,而中考题侧重考察学生对知识的掌握情况.

表 2 萼花臂尾轮虫种复合体各采样点的样品数、单倍型、核苷酸多样性和单倍型多样性(±标准差)Tab. 2 Sample size, haplotypes, nucleotide and haplotype diversity (±SD) for each geographic population in Brachionus calyciflorus complex
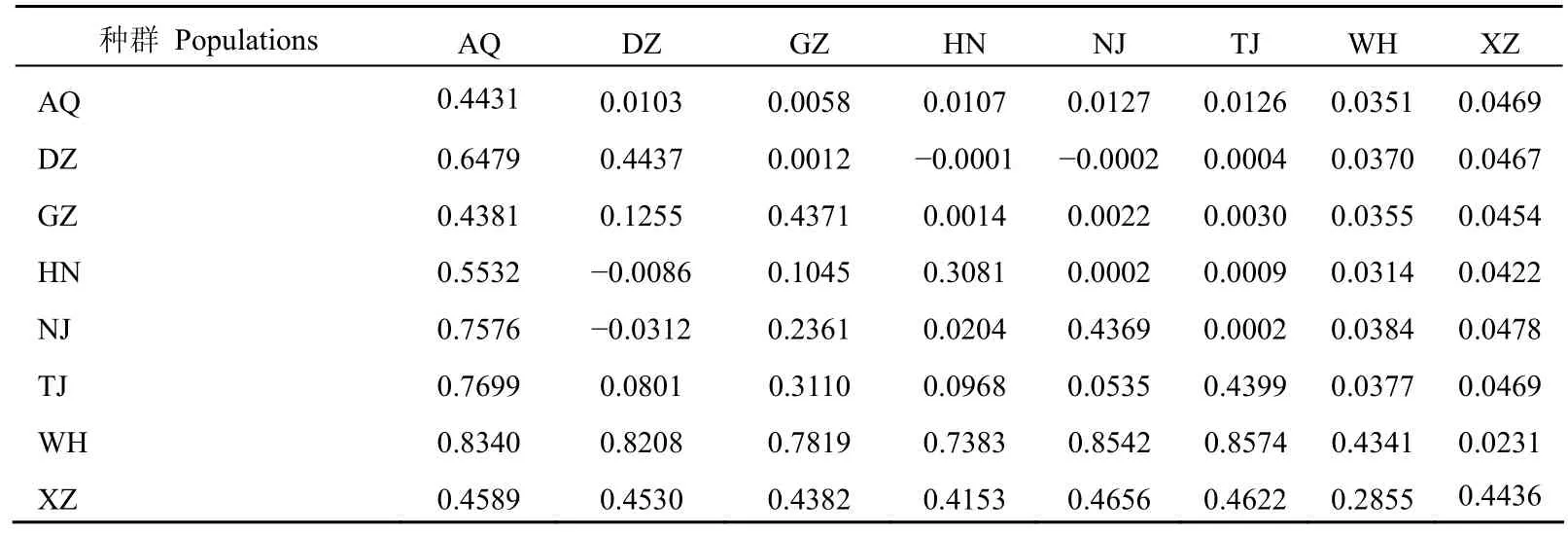
表 3 萼花臂尾轮虫种复合体各采样点样品间平均净遗传距离(Da,对角线上)和分化程度(Fst,对角线下)以及样品内分化程度(Fst,对角线)Tab. 3 Average pairwise difference between populations (Da, above diagonal), Fst among (below diagonal) and within (on the diagonal) geographic populations in Brachionus calyciflorus complex
来自乔治亚(Georgia DQ071668)和佛罗里达(Florida DQ071669)的萼花臂尾轮虫隐种被归入支系Ⅲ,它们与支系Ⅲ内部各克隆间序列差异百分比为0.8%~3.2%;与支系Ⅱ间序列差异百分比为5.5%~6.7%;与支系Ⅰ间序列差异百分比为24.8%~25.6%。因此,乔治亚和佛罗里达的萼花臂尾轮虫隐种与支系Ⅲ为同一谱系。来自中国芜湖的萼花臂尾轮虫隐种(Wuhu China EU978878)被归入支系Ⅱ,其与支系Ⅱ内部各克隆间序列差异百分比为0.1%~0.5%;与支系Ⅰ内部各克隆间序列差异百分比为24.4%~25.2%;与支系Ⅲ内部各克隆间序列差异百分比为4.6%~6%。因此,中国芜湖的萼花臂尾轮虫隐种与支系Ⅱ为同一谱系;而来自德克萨斯和澳大利亚的萼花臂尾轮虫隐种均作为一个单独的支系被独立出来,德克萨斯萼花臂尾轮虫隐种(Texas DQ071670)与支系I、支系II和支系III间的序列差异百分比分别为25.9%~26.7%、4.5%~5.1%和3.8%~4.5%;澳大利亚萼花臂尾轮虫隐种(Australia DQ071671)与支系I、支系II和支系III间的序列差异百分比分别为25%~25.8%、7.1%~7.8%和5.6%~6.9%。
2.3 种复合体内隐种Ⅲ的遗传多样性、种群遗传分化和系统地理结构
考虑到隐种Ⅰ内仅含有儋州种群,隐种Ⅱ内含有儋州、广州和芜湖种群,且芜湖种群仅有两个单倍型(WH21和WH23)。因此,下面的种群遗传分化和系统地理格局分析仅包括隐种Ⅲ内的6个地理种群的38个单倍型(由于儋州和广州种群都仅含一个单倍型,因此未被包括在内)。
隐种Ⅲ的平均核苷酸多样性和单倍型多样性分别为(0.0096±0.0008)和(0.918±0.018),均低于萼花臂尾轮虫种复合体的核苷酸多样性和单倍型多样性,尤其是核苷酸多样性。各种群的核苷酸多样性(π)与单倍型多样性(h)之间并不呈现显著的相关关系。AMOVA分析显示,隐种Ⅲ内各种群间具有较高的遗传分化水平(种群间变异为32.61%,种群内变异为67.39%,Fst=0.3261)。种群间净遗传距离(Da)的分析显示,徐州种群与其他各地理种群间具有很高的Da值;种群间的分化程度(Fst)也同样遵循这种规律(表4)。
Mantel检验结果表明,隐种Ⅲ内各地理种群间的遗传距离(Da)和遗传分化程度(Fst)(表4)并不随空间距离的增加而增大,两对矩阵未发现有显著的相关性(P=0.999);萼花臂尾轮虫种复合体的Da和Fst(表3)与各采样点间的距离也无显著的相关性(P=0.923)。
相关分析表明,隐种Ⅲ内地理种群的遗传学参数(单倍型多样性、核苷酸多样性以及遗传分化指数)与采样点的环境因子(水温、年平均气温、pH值和氨态氮浓度)间均没有显著的相关性;但采样点的年平均气温与萼花臂尾轮虫种复合体的核苷酸多样性呈显著正相关(r=0.720,P<0.05),与遗传分化指数呈显著负相关(r=−0.717,P<0.05)。

图 2 基于ITS序列的萼花臂尾轮虫种复合体的ML系统发生树Fig. 2 ML phylogenetic tree of Brachionus calyciflorus species complex based on ITS sequences
2.4 巢式支系分析
根据组巢原则得到的萼花臂尾轮虫种复合体内73个单倍型的巢式支系图的拓扑结构(图4)与贝叶斯及最大似然法系统树(图2—3)基本一致。73个单倍型组成了16个一级支系、6个二级支系和3个三级支系。根据Templeton et al(1992)的判断程序,由于3个三级支系之间的分歧已超过95%的简约性连接置信限度,因此这3个支系之间并没有连接。
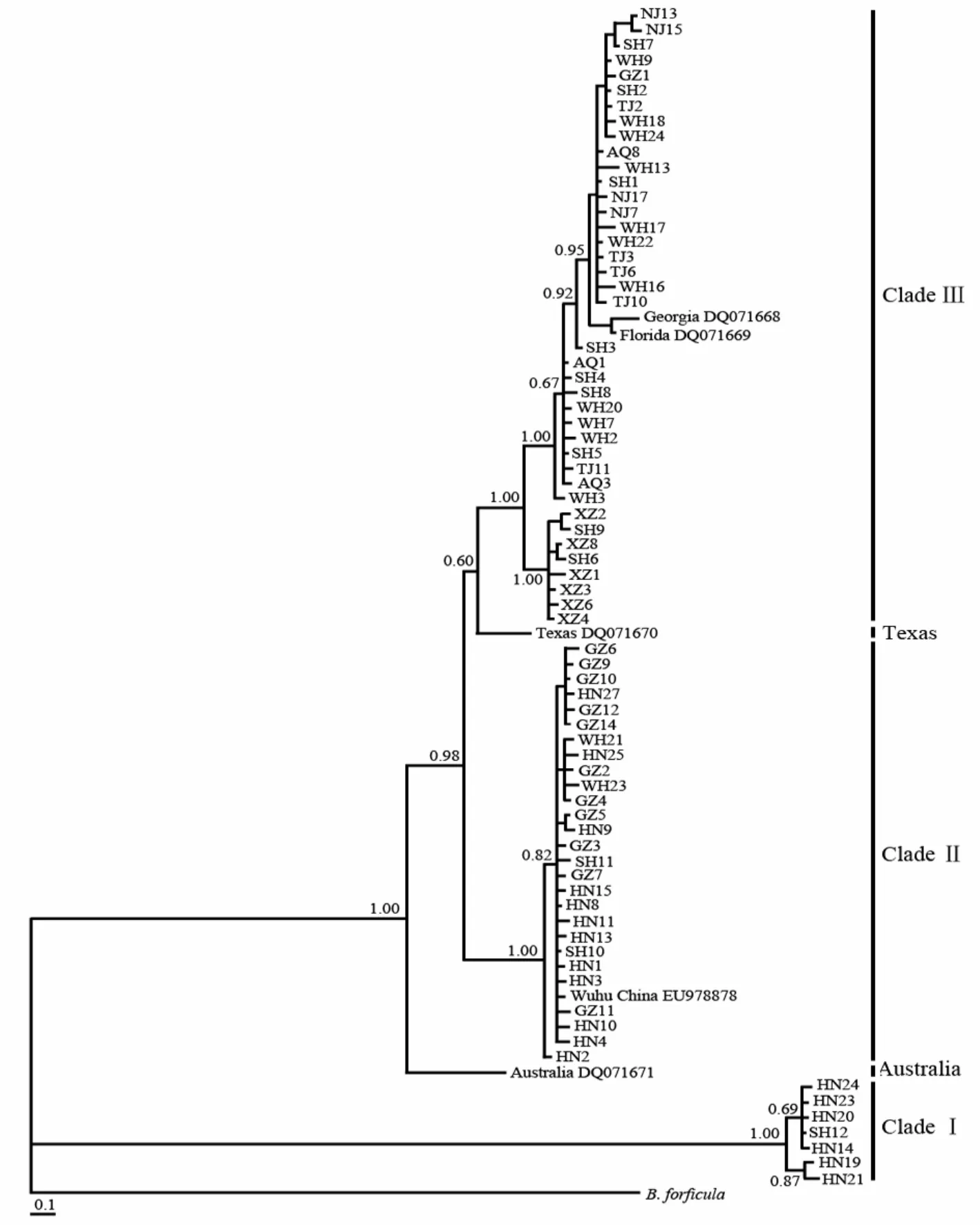
图 3 基于ITS序列的萼花臂尾轮虫种复合体的贝叶斯系统发生树Fig. 3 Bayesian phylogenetic tree of Brachionus calyciflorus species complex based on ITS sequences

表 4 隐种Ⅲ内各地理种群间平均净遗传距离(Da,对角线上)、种群间遗传分化程度(Fst,对角线下)、种群内遗传分化程度(Fst,对角线)、核苷酸多样性和单倍型多样性Tab. 4 Average pairwise difference between populations (Da, above diagonal), Fst among (below diagonal) and within (on the diagonal) populations, nucleotide diversity and haplotype diversity in cryptic species Ⅲ

图 4 萼花臂尾轮虫种复合体内单倍型网络图和巢支设计Fig. 4 Haplotype networks and nested clade design for all unique Brachionus calyciflorus species complex haplotypes
经巢支设计,萼花臂尾轮虫种复合体内73个单倍型组成3个网络图(图4)。网络图Ⅰ仅由7个来自儋州的单倍型组成,其中共享单倍型SH12可能为祖先单倍型;网络图Ⅱ中大部分是来自儋州(13个)和广州(11个)的单倍型,此外还有两个来自芜湖的单倍型和一个共享单倍型SH11;剩下的所有单倍型被归入网络图Ⅲ,其中在多个采样点间共享的单倍型SH5可能是最原始的单倍型。 3个网络图间具有显著的遗传分歧,与单倍型系统发生分析结果相一致。
巢式支系分析(NCA)得到的所有组巢水平各个支系内的内支、末支和内外支的巢内距离(Dc)和巢间距离(Dn)之差以及显著性大小值(P)的结果见表5。单倍型分布与其地理位点间的随机关系零假设在部分巢支中被拒绝,呈现出一定的系统地理格局。根据检索表分析推测到的各个单倍型地理分布格局的一系列历史成因见表6。支系2-2、2-4和3-3由长距离拓殖并可能伴随后期的栖息地片段化形成;支系2-5,由于距离隔离情况下有限的基因流造成的;支系3-2,由于样本量有限而无法辨别是距离隔离还是长距离扩散影响了其地理分布格局。支系3-1,由于代表的是隐种Ⅰ,且只包括一个地理种群,故无法分析其地理格局。
3 讨 论
3.1 萼花臂尾轮虫种复合体和隐种Ⅲ的遗传多样性
在两个随机选择的DNA序列间平均每个核苷酸位点的差异数,也许更能反映种群的遗传变异水平(Nei & Li, 1979)。单倍型多样性和核苷酸多样性越高,种群遗传多样性就越丰富。本研究中,萼花臂尾轮虫种复合体的核苷酸多样性较高,单倍型多样性也很高;而萼花臂尾轮虫种复合体内隐种Ⅲ的平均核苷酸多样性和单倍型多样性均低于萼花臂尾轮虫种复合体的核苷酸多样性和单倍型多样性,尤其是核苷酸多样性指数;这可能是由于萼花臂尾轮虫种复合体已分化为3个隐种的缘故。
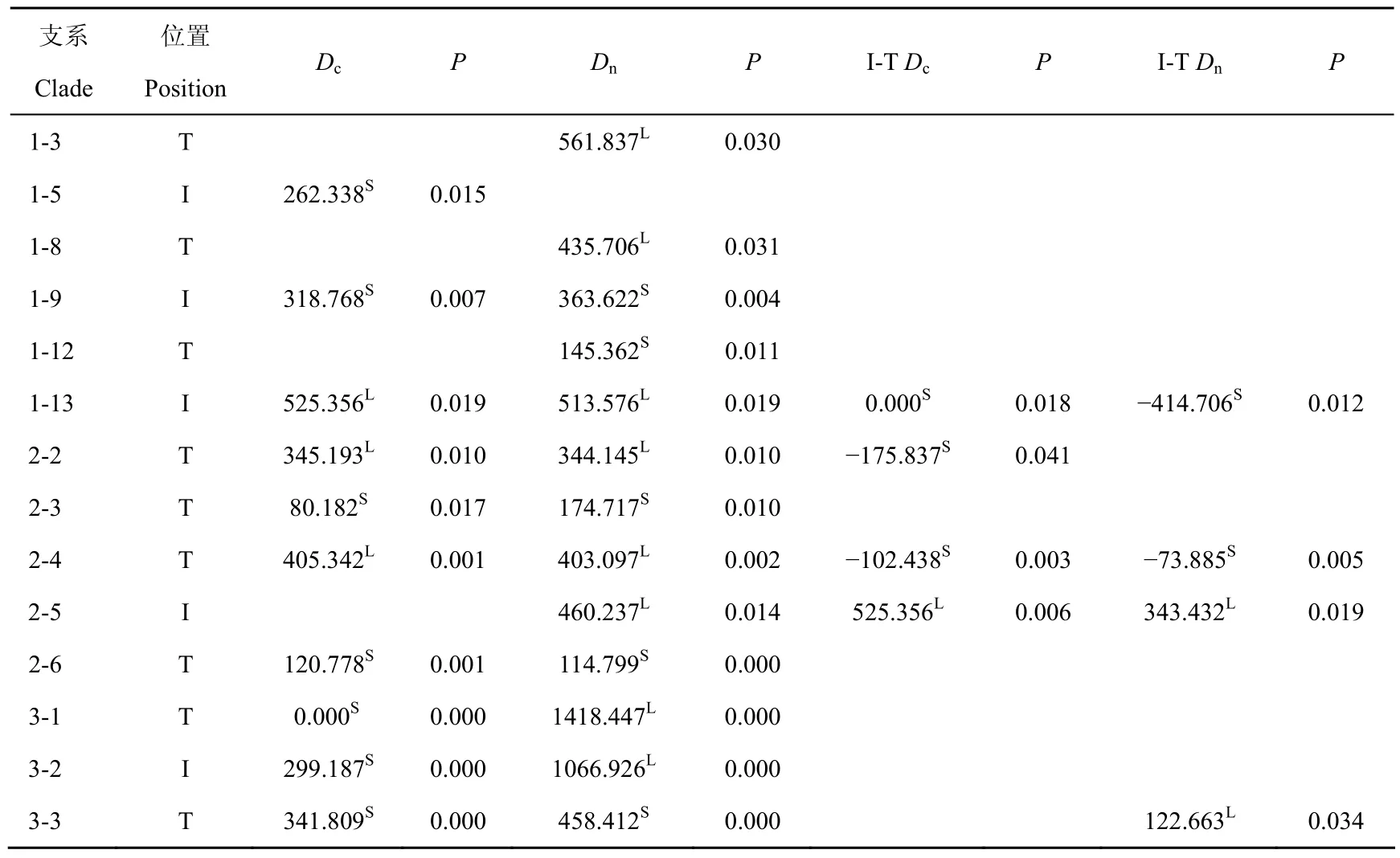
表 5 基于巢式支系图(图4),应用程序Geodis 2.5对萼花臂尾轮虫种复合体内73个单倍型数据进行巢式支系分析(NCA)得到的有显著差异水平的巢内距离(Dc)和巢间距离(Dn)Tab. 5 Two distances with significant difference obtained from the nested cladistic analysis (NCA) of 73 haplotypic data of Brachionus calyciflorus complex based on the nested cladogram given in Fig. 4 and Geodis 2.5 program*

表 6 基于对萼花臂尾轮虫种复合体内73个单倍型数据的巢式支系分析结果(表5),应用Templeton(2004)的检索表分析得到的一系列推论Tab. 6 Chain of inference from the nested clade analysis of 73 haplotypic data of Brachionus calyciflorus complex (Tab. 5) using Templeton’s (2004) inference key
3.2 萼花臂尾轮虫种复合体的系统发生关系
隐性物种形成在许多桡足类和枝角类等微型无脊椎动物中已被广泛研究(Taylor & Hebert, 1992; Lee, 2000; Knowlton, 2000; Lee & Frost, 2002; Dodson et al, 2003; Penton et al, 2004; Kim et al, 2006)。此前的分子生物学研究已经表明在世界性分布的轮虫种复合体内,核DNA ITS序列分歧较大,萼花臂尾轮虫为4%~6.8%(Gilbert & Walsh, 2005)和5.1%~8.8%(Cheng et al, 2008),褶皱臂尾轮虫的ITS1区间序列差异为3%~20%(Gómez et al, 2002b)。与此相似,本研究中萼花臂尾轮虫种复合体内单倍型间序列差异百分比为0%~25.3%,平均5.97%;3个支系间序列差异百分比为4.2%~25.3%,表明萼花臂尾轮虫实际上是一个包含3个隐种的种复合体。由于以其他种类无脊椎动物的分歧速率作为参考是不可靠的(Thomas et al, 2006),所以很难由ITS序列数据估测得到这3个隐种的分歧时间。在广州、儋州和芜湖采样点发现有萼花臂尾轮虫隐种的同域共存现象,在儋州采样点有3个隐种同域共存(隐种Ⅰ、隐种Ⅱ和隐种Ⅲ),广州和芜湖采样点各两个隐种(隐种Ⅱ和隐种Ⅲ),其他各采样点均只有一个隐种。
3.3 隐种Ⅲ的种群遗传分化和系统地理结构
栖息地片段化和有限的基因流是形成当前物种分布格局的主要原因,它们可以阻碍种群间的基因交流而使其产生遗传分化,甚至导致生殖隔离,形成新的物种。在本研究中,较高的遗传分化指数(Fst=0.3261)表明隐种Ⅲ在各地理种群间分化显著;根据Templeton(2004)检索表推测到的隐种Ⅲ地理分布格局的历史成因包括长距离拓殖并可能伴随后期的栖息地片段化以及在距离隔离情况下的有限基因流。此外,冰期瓶颈后拓殖种群优先到达并占领栖息地,快速的种群增长阻碍了来自种群间的有效基因流,从而加速了地理种群间的遗传分化。
有些环境因子,如水体的盐度和水温,对姐妹种的分布和种群的遗传分化程度有重要影响(Gómez et al, 1995; Lowe et al, 2007; Yu et al, 2008)。运用乙酸纤维素电泳法,Gómez et al(1995)研究了西班牙卡斯特隆沿海Torreblanca湿地的3个间歇性池塘的褶皱臂尾轮虫种群的遗传变异,结果发现克隆群之间的生态学特性存在特化现象,且对应着特定的盐度和温度。在本研究中,统计学分析表明,采样点年平均气温与萼花臂尾轮虫种复合体的核苷酸多样性指数(π)呈显著的正相关,与遗传分化指数(Fst)呈显著的负相关;而其余环境因子与遗传多样性指数间均没有显著的相关性,这表明萼花臂尾轮虫种复合体在各采样点间的遗传分化程度可能受到诸如气温等环境因子的影响。
一般来说,轮虫、桡足类、枝角类和介形类动物均具有持久的奠基者效应、地域性的特有分布现象以及伴随着基因流潜在减少而存在的显著地理格局(Boileau et al, 1992; Hebert & Wilson, 1994; Weider et al, 1999a; Gómez et al, 2000; Schon et al, 2000; Mills et al, 2007),轮虫种群的遗传谱系间具有较强的地理空间结构,基因流小,且地理距离和遗传距离间具有显著的相关性(Gómez et al, 2000)。然而,Hatton-Ellis et al(1998)研究的淡水苔藓动物Cristatella mucedo以及Dong & Niu(2004)研究的萼花臂尾轮虫却没有呈现出显著的系统地理格局。在本研究中,巢式支系分析表明,有些单倍型(如SH1、SH2和SH5)以较高的频率在多个采样点同时出现,这些单倍型可能是祖先单倍型,它们可能参与了冰期后的栖息地扩张,并作为奠基者在各采样点保留下来,从而形成了相似的地理分布格局。因此,遗传距离和地理距离间并无显著的相关性。
3.4 萼花臂尾轮虫种复合体的演化历史
生物种群内和种群间的遗传变异在地理上的分布模式一直是进化遗传学家关注的核心问题之一(Avise, 2000)。历史过程和环境因素均对物种分化和现有分布格局的形成具有重要影响。物种在进化史上发生的一些事件,如物种分布区的扩张与退缩、奠基者效应、生境的片段化和重大地质事件等都会对种群现存的遗传变异水平产生影响。另外,环境因素,如山脉、河流等自然地理条件对生物扩散具有一定的隔离屏障作用,维持甚至加速了种群的局域性分化(Hebert et al, 2003; Taylor et al, 1998; Cox & Hebert, 2001)。通过比较物种间或种群间的系统地理分布模式可以勘察物种或种群进化历史的一般模式,揭示物种或种群的进化进程(Bermingham & Avise, 1986; Hewitt, 2000)。
本研究发现,网络图部分巢支呈现出一定的系统地理格局,其所揭示的物种演化历史与通过分子系统学方法得到的萼花臂尾轮虫种复合体的遗传分化是一致的;但是种群遗传距离和地理距离间并无显著的相关性。在儋州采样点有3个隐种同域共存,而在广州和芜湖地区均有两个隐种同域共存。
广州、儋州和芜湖地区的隐种共存可能与这些地理种群的进化历史、扩散和适应能力有关。通过孢粉学研究发现,末次盛冰期以来的新仙女木事件(Younger Dryas Event,YD)在我国华南地区也有所表现,这一事件在欧洲、北美和我国北方都早有记载(Xiao et al, 1998)。约在10 400 a BP前后,在我国南方南岭地区(24°15′N,115°2′E)
——广东省和江西省的交界处(图1阴影部分)有一次持续数百年的气候降温波动,但这一事件在我国南北方不同的气候带内的表现形式是不一样的,南方地区不如北方地区明显和剧烈,南方地区表现为凉、湿,而北方地区表现为冷、干,这可能与东亚季风活动效应有关(Xiao et al, 1998)。因此,本研究中的3个萼花臂尾轮虫隐种可能是在YD时期退缩并遗存于包括儋州和广州在内的南岭以南地区的多个残遗种避难所。在南岭山地屏障阻碍下,3个隐种在儋州和广州地区共存。新仙女木事件之后,萼花臂尾轮虫种复合体开始向更远的中国北方地区扩散。隐种Ⅲ的少数具有高拓殖能力的休眠体可能首先到达并占领北方各栖息地,拓殖事件之后,这些休眠体对局域环境的高度适应能力和快速的种群增长减少了来自种群间的基因流,并且有效地增加了奠基者效应的持久性,使得最初的建群者所携带的等位基因频率可以延续上万代。由于初期的拓殖者有能力快速地增长到较大的种群数量,从而在若干代以后迅速饱和被占领的栖息地并独占特定的生态位,这样就冲淡了后来的迁徙者的影响。在隐种Ⅲ的“优先效应(priority effects)”(Boileau et al, 1992; Muñoz et al, 2008)作用下,隐种Ⅱ中只有两个单倍型通过长距离扩散拓殖到芜湖采样点,没有繁殖体拓殖到更远的长江以北地区,这可能与长江的阻隔或隐种Ⅱ的扩散和适应能力较差有关。相比较而言,隐种Ⅰ仅仅分布于儋州地区,连具有相似生境特点的栖息地,如广州地区也未能成功拓殖,这可能是由于种群过小、扩散能力差以及琼州海峡(图1)的屏障作用导致的。
浮游动物的世界性分布已在多个种类中被证实,这可能与其横贯大陆的长距离扩散或拓殖能力有关(Gómez et al, 2002b; De Gelas & De Meester, 2005)。本研究发现,萼花臂尾轮虫种复合体在全球范围内的地理分布还可能与大陆板块构造运动有关。中生代晚期,印度从马达加斯加分离,正加速撞向劳亚大陆(Laurasia)。值得注意的是,此时北美仍与欧亚大陆相连,澳大利亚仍然是南极洲的一部分。因此,推测广泛分布在我国境内的萼花臂尾轮虫由于近似的自然地理条件和无明显的天然阻碍可能时常与北美大陆种群间发生基因交流,并未发生隐种和种群间的遗传分化;但由于特提斯海(Tethys sea)的阻隔,劳亚大陆和澳洲大陆间的萼花臂尾轮虫发生了种群分化。新生代早期,印度−欧亚板块的碰撞导致了青藏高原和喜马拉雅山脉的隆升,使亚洲,甚至全球范围内古地理、古气候和生物区系格局发生了剧烈的调整,原本与南极洲相连的澳洲,此时也开始迅速向北移动,此后就再也未与其它大陆相连,因此推测澳洲板块上的萼花臂尾轮虫隐种即澳大利亚隐种形成的时间最早,与本研究结果吻合。此后全球大陆板块变化较小,北美大陆和欧亚大陆的萼花臂尾轮虫未发生隐种分化,同为隐种Ⅲ。本研究中Texas隐种、隐种Ⅰ和隐种Ⅱ的出现可能为萼花臂尾轮虫隐种Ⅲ在北美大陆和欧亚大陆的同域性物种形成的产物。
Allendorf F, Ryman N. 2002. The Role of Genetics in Ppopulation Viability Analysis [M]// Beissinger SR, McCullough DR. Population Viability Analysis. Chicago: The University of Chicago Press, 50-85.
Avise JC, Arnold J, Ball RM. 1987. Intraspecific phylogeography: The mitochondrial DNA bridge between population genetics and systematics [J].Annu Rev Ecol Evol S, 18: 489-522.
Avise JC, Hamrick JL. 1996. Conservation Genetics: Case Histories from Nature [M]. New York: Chapman and Hall, 1-490.
Avise JC. 1998. The history and preview of phylogeography: A personal reflection [J].Mol Ecol, 7: 371-379.
Avise JC. 2000. Phylogeography: The History and Formation of Species [M]. Cambridge: Harvard University Press, 447.
Bandelt HJ, Forster P, Röhl A. 1999. Median-joining networks for inferring intraspecific phylogenies [J].Mol Biol Evol, 16: 37-48.
Bazin E, Glémin S, Galtier N. 2006. Population size does not influence mitochondrial genetic diversity in animals [J].Science, 5773: 570-572.
Bermingham E, Avise JC. 1986. Molecular zoogeography of freshwater fishes in the southeastern United States [J].Genetics, 113: 939-965.
Boileau MG, Hebert PDN, Schwartz SS. 1992. Non-equilibrium gene frequency divergence: Persistent founder effects in natural populations [J].J Evol Biol, 5: 25-39.
Carvalho GR. 1994. Evolutionary Genetics of Aquatic Clonal Invertebrates: Concepts, Problems and Prospects [M]// Beaumont AR. Genetics and Evolution of Aquatic Organisms. London: Chapman and Hall, 291-322.
Castelloe J, Templeton AR. 1994. Root probabilities for intraspecific gene trees under neutral coalescent theory [J].Mol Phylogenet Evol, 3: 102-113.
Chen YF, Chen YY, He DK, Sui XY. 2006. Current status and perspective of biogeography study in Taiwan strait, China [J].Chn J Zool, 41(1): 118-122. [陈毅峰, 陈宜瑜, 何德奎, 隋晓云. 2006. 台湾海峡两岸生物地理学现状与展望. 动物学杂志, 41(1): 118-122.]
Cheng XF, Xi YL, Li HB. 2008. Seasonal changes in the genetic structure of aBrachionus calyciflorus population in Lake Liantang based on ITS sequences [J].Acta Zool Sin, 54(2): 245-255.[程新峰, 席贻龙, 李化炳. 2008. 基于rDNA ITS序列分析莲塘湖萼花臂尾轮虫种群遗传结构的季节变化. 动物学报, 54(2): 245-255.]
Ciros-Pérez J, Gómez A, Serra M. 2001. On the taxonomy of three sympatric sibling species of theBrachionus plicatilis(Rotifera) complex from Spain, with the description ofB. ibericusn. sp [J].J Plankton Res, 23: 1311-1328.
Cox AJ, Hebert PDN. 2001. Colonization, extinction, and phylogeographic patterning in a freshwater crustacean [J].Mol Ecol, 10: 371-386.
De Gelas K, De Meester L. 2005. Phylogeography ofDaphnia magnain Europe [J].Mol Ecol, 14: 753-764.
De Meester L, Gómez A, Okamura B, Schwenk K. 2002. The monopolization hypothesis and the dispersal–gene flow paradox in aquatic organisms [J].Acta Oecol, 23: 121-135.
De Meester L. 1993. Inbreeding and outbreeding depression inDaphnia[J].Oecologia, 96: 80-84.
De Meester L. 1996. Local genetic differentiation and adaptation in freshwater zooplankton populations: Patterns and processes [J].Ecoscience, 3: 385-399.
Derry AM, Hebert PDN, Prepas EE. 2003. Evolution of rotifers in saline and subsaline lakes: A molecular phylogenetic approach [J].Limnol Oceanogr, 48: 675-685.
Dodson SI, Grishanin AK, Gross K, Wyngaard GA. 2003. Morphological analysis of some cryptic species in theAcanthocyclops vernalisspecies complex from North America [J].Hydrobiologia, 500: 131-143.
Dong YW, Niu CJ. 2004. Sequence variability of mitochondrial COI region and population genetic structure of rotiferBrachionus calyciflorus[J].Oceanologia et Limnologia Sinica, 35: 473-480. [董云伟, 牛翠娟. 2004. 萼花臂尾轮虫(Brachionus calyciflorus) COI 基因序列变异及种群遗传结构分析. 海洋与湖沼, 35(5): 473-480.]
Edwards KJ, Gadek PA. 2001. Evolution and biogeography ofAlectryon(Sapindaceae) [J].Mol Phylogenet Evol, 20: 14-26.
Excoffier Laval G, Schneider S. 2005. Arlequin (version 3.0): An integrated software package for population genetics data analysis. version 3.0 [J].Evol Bioinformat Online, 1: 47-50.
Felsenstein J. 1985. Confidence limits on phylogenies: An approach using the bootstrap [J].Evolution, 39: 783-791.
Fernando P, Pfrender ME, Encalada SE, Lande R. 2000. Mitochondrial DNA variation, phylogeography and population structure of the Asian elephant [J].Heredity, 84: 362-372.
Gilbert JJ, Walsh EJ. 2005.Brachionus calyciflorusis a species complex: Mating behavior and genetic differentiation among four geographically isolated strains [J].Hydrobiologia, 546: 257-265.
Gilbert JJ. 1963. Mictic female production in the rotiferBrachionus calyciflorus[J].J Exp Zool, 153: 113-124.
Gómez A, Adcock GJ, Lunt DH, Carvalho GR. 2002a. The interplay between colonization history and gene flow in passively dispersing zooplankton: Microsatellite analysis of rotifer resting egg banks [J].J Evol Biol, 15: 158-171.
Gómez A, Carvalho GR, Lunt DH. 2000. Phylogeography and regional endemism of a passively dispersing zooplankter: Mitochondrial DNA variation in rotifer resting egg banks [J].Proc R Soc Lond B, 267: 2189-2197.
Gómez A, Montero-pau J, Lunt DH, Serra M, Campillo S. 2007. Persistent genetic signatures of colonization inBrachionus manjavacasrotifers in the Iberian Peninsula [J].Mol Ecol, 16: 3228-3240.
Gómez A, Serra M, Carvalho GR, Lunt DH. 2002b. Speciation in ancient cryptic species complexes: Evidence from the molecular phylogeny ofBrachionus plicatilis(rotifera) [J].Evolution, 56: 1431-1444.
Gómez A, Temprano M, Serra M. 1995. Ecological genetics of a cyclical parthenogen in temporary habitats [J].J Evol Biol, 8: 601-622.
Gómez A. 1997. Ecological factors affecting gene flow in theBrachionus plicatiliscomplex (rotifera) [J].Oecologia, 111: 350-356.
Gómez A. 2005. Molecular ecology of rotifers: From population differentiation to speciation [J].Hydrobiologia, 546: 83-99.
Hairston NG. 1996. Zooplankton egg banks as biotic reservoirs in changing environments [J].Limnol Oceanogr, 41: 1087-1092.
Hatton-Ellis TW, Noble LR, Okamura B. 1998. Genetic variation in a freshwater bryozoan. I: Populations in the Thames basin, UK [J].Mol Ecol, 7: 1575-1585.
Hebert PDN, Wilson C. 1994. Provincialism in plankton: Endemism and allopatric speciation in AustralianDaphnia[J].Evolution, 48: 1333-1349.
Hebert PDN, Witt JDS, Adamowicz SJ. 2003. Phylogeographical patterning inDaphnia ambigua: Regional divergence and intercontinental cohesion [J].Limnol Oceanogr, 48: 261-268.
Hebert PDN. 1987. Genetics ofDaphnia[J].Mem Ist Ital Idrobiol, 45: 439-460.
Hebert PDN. 1998. Variable Environments and Evolutionary Diversification in Inland Waters [M]// Carvalho GR. Advances in Molecular Ecology. Amsterdam: IOS Press, 267-290.
Hewitt GM. 2000. The genetic legacy of the quaternary ice ages [J].Nature, 405: 907-913.
Hutchinson GE. 1967. A Treatise on Limnology II: Introduction to Lake Biology and Limnoplankton [M]. New York: John Willey and Sons, 1-1115.
Innes DJ. 1991. Geographic patterns of genetic differentiation among sexual populations ofDaphnia pulex[J].Can J Zool, 69: 995-1003.
Ishida S, Taylor DJ. 2007. Mature habitats associated with genetic divergence despite strong dispersal ability in an arthropod [J].BMC Evol Biol, 7: 52.
Johnson WE, Slattery JP, Eizirik E, Kim J, Raymond MM, Bonacic C, Cambre R, Crawshaw P, Nunes A, Seuánez HN, Moreira MAM, Seymour KL, Simon F, Swanson W, O’brien SJ. 1999. Disparate phylogeographic patterns of molecular genetic variation in four closely related South American small cat species [J].Mol Ecol, 8: 79-94.
Kim K, Kotov AA, Taylor DJ. 2006. Hormonal induction of undescribed males resolves cryptic species of cladocerans [J].Proc R Soc Lond B, 273: 141-147.
Knowlton N. 1993. Sibling species in the sea [J].Annu Rev Ecol Evol Syst, 24: 189-216.
Knowlton N. 2000. Molecular genetic analyses of species boundaries in the sea [J].Hydrobiologia, 420: 73-90.
Koste W. 1978. Rotatoria - die Rädertiere Mitteleuropas [M]. 2nd ed. Berlin: Bornträger, 673.
Lee CE, Frost BW. 2002. Morphological stasis in theEurytemora affinisspecies complex (Copepoda: Temoridae) [J].Hydrobiologia, 480: 111-128.
Lee CE. 2000. Global phylogeography of a cryptic copepod species complex and reproductive isolation between genetically proximate‘populations’ [J].Evolution, 54: 2014-2027.
Li HB, Xi YL, Cheng XF, Xiang XL, Hu CB, Tao LX. 2008. Sympatric speciation in rotifers: Evidence from molecular phylogenetic relationships and reproductive isolation amongBrachionus calyciflorusclones [J].Acta Zool Sin, 54(2): 256-264. [李化炳, 席贻龙, 程新峰,项贤领, 胡存兵, 陶李祥. 2008. 轮虫同域性物种形成:来自萼花臂尾轮虫克隆间的分子系统发育关系和生殖隔离的证据. 动物学报, 54(2): 256-264.]
Li SH, Zhu H, Xia YZ, Yu MJ, Lin KE, Liu KS, Le ZY, Chen YX. 1959. The mass culture of unicellular green algae [J].Acta Hydrobiol Sin, 4: 462-472. [黎尚豪, 朱 蕙, 夏宜琤, 俞敏娟, 林坤二, 刘昆山, 乐正亚, 陈云霞. 1959. 单细胞绿藻的大量培养试验. 水生生物学集刊, 4: 462-472.]
Librado P, Rozas J. 2009. DnaSP version 5.0: A software for comprehensive analysis of DNA polymorphism data [J].Bioinformatics, 25: 1451-1452.
Lowe CD, Kemp SJ, Diaz-Avalos C, Montagnes DJS. 2007. How does salinity tolerance influence the distributions ofBrachionus plicatilissibling species? [J].Mar Biol, 150: 377-386.
Mantel N. 1967. The detection of disease clustering and a generalized regression approach [J].Cancer Res, 27: 209-220.
Mergeay J, Verschuren D, De Meester L. 2005. Cryptic invasion and dispersal of an AmericanDaphniain East Africa [J].Limnol Oceanogr, 50: 1278-1283.
Miao W, Yu YH, Shen YF, Zhang XY. 2003. Intraspecific phylogeography ofCarchesium polypinum(Peritrichia, Ciliophora) from China, inferred from 18S-ITS1-5.8S ribosomal DNA [J].Sci Chn Ser C:Life Sci, 47(1): 11-17. [缪 炜, 余育和, 沈韫芬, 张锡元. 2003. 螅状独缩虫种内分子系统地理学的研究. 中国科学(C辑), 33(2): 151-159.]
Mills S, Lunt DH, Gómez A. 2007. Global isolation by distance despite strong regional phylogeography in a small metazoan [J].BMC Evol Biol, 7: 225.
Muñoz J, Gómez A, Green AJ, Figuerola J, Amat F, Rico C. 2008. Phylogeography and local endemism of the native Mediterranean brine shrimpArtemia salina(Branchiopoda: Anostraca) [J].Mol Ecol, 17: 3160-3177.
Nei M, Li WH. 1979. Mathematical model for studying genetic variation in terms of restriction endonucleases [J].Proc Natl Acad Sci USA, 76: 5269-5273.
Okamura B, Freeland J. 2002. Gene Flow and the Evolutionary Ecology of Passively Dispersing Aquatic Invertebrates [M]// Bullock JM, Kenward RE, Hails RS. Dispersal. London: Blackwell Scientific Publications, 194-218.
Ortells R, Gómez A, Serra M. 2003. Coexistence of cryptic rotifer species: Ecological and genetic characterisation ofBrachionus plicatilis[J].Freshw Biol, 48: 2194-2202.
Ortells R, Snell TW, Gómez A, Serra M. 2000. Patterns of genetic differentiation in resting egg banks of a rotifer species complex in Spain [J].Arch Hydrobiol, 149: 529-551.
Penton EH, Hebert PDN, Crease TJ. 2004. Mitochrondrial DNA variation in North American populations ofDaphnia obtusa: Continentalism or cryptic endemism? [J].Mol Ecol, 13: 97-107.
Posada D, Crandall KA, Templeton AR. 2000. GeoDis: A program for the cladistic nested analysis of the geographical distribution of genetic haplotypes [J].Mol Ecol, 9: 487-488.
Posada D, Crandall KA. 1998. Modeltest: Testing the model of DNA substitution [J].Bioinformatics, 9: 817-818.
Ronquist F, Huelsenbeck JP. 2003. Mrbayes 3: Bayesian phylogenetic inference under mixed models [J].Bioinformatics, 19: 1572-1574.
Ruttner-Kolisko A. 1974. Plankton Rrotifers [M]// Elster HJ, Ohle W. Die Binnengewässer. Stuttgart: Schweizerbartsche Verlagsbuchhandlung, 1-146.
Schon I, Gandolfi A, Di Masso E, Rossi V, Griffiths HI, Martens K, Butlin RK. 2000. Persistence of asexuality through mixed reproduction inEucypris virens(Crustacea, Ostracoda) [J].Heredity, 84: 161-169.
Suatoni E. 2003. Patterns of Speciation in the Rotifer Species Complex, Brachionus Plicatilis [M]. New Haven: Yale University, 115.
Swofford DL. 2002. PhylogeneticAnalysis Using Parsimony (*and other methods) [M]. Sunderland: Sinauer Associates.
Taberlet P, Bouvet J. 1994. Mitochondrial DNA polymorphism, phylogeography, and conservation genetics the brow bear (Ursus arctos) in Europe [J].Proc R Soc Lond B,255: 195-200.
Taylor DJ, Finston TL, Hebert PDN. 1998. Biogeography of a widespread freshwater crustacean: Pseudocongruence and cryptic endemism in the North AmericanDaphnia leaviscomplex [J].Evolution, 52: 1648-1670.
Taylor DJ, Hebert PDN. 1992.Daphnia galeata mendotaeas a cryptic species complex with interspecific hybrids [J].Limnol Oceanogr, 37: 658-665.
Templeton AR, Boerwinkle E, Sing CF. 1987. A cladistic analysis of phenotypic associations with haplotypes inferred from restriction endonuclease mapping. I: Basic theory and an analysis of alcohol dehydrogenase activity inDrosophila[J].Genetics, 117: 343-351.
Templeton AR, Crandall KA, Sing CF. 1992. A cladistic analysis of phenotypic associations with haplotypes inferred from restriction endonuclease mapping and DNA sequence data. III: Cladogram estimation [J].Genetics, 132: 619-633.
Templeton AR, Sing CF. 1993. A cladistic analysis of phenotypic associations with haplotypes inferred from restriction endonuclease mapping. IV: Nested analysis with cladogram uncertainty and recombination [J].Genetics, 134: 659-669.
Templeton AR. 2004. Statistical phylogeography: Methods of evaluating and minimizing inference errors [J].Mol Ecol, 13: 789-809.
Thomas JA, Welch JJ, Woolfit M, Bromham L. 2006. There is no universal molecular clock for invertebrates, but rate variation does not scale with body size [J].Proc Natl Acad Sci USA, 103: 7366-7371.
Thompson JD, Gibson TJ, Plewinak F, Jeanmougin F, Higgins DG. 1997. The Clustal X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools [J].Nucleic Acids Res, 24: 4876-4882.
Vanoverbeke J, De Meester L. 1997. Among-populational genetic differentiation in the cyclical parthenogenDaphnia magna(Crustacea, Anomopoda) and its relation to geographic distance and clonal diversity [J].Hydrobiologia, 360: 135-142.
Wallace RL, Snell TW. 2001. Rotifera [M]// Thorp JH, Covich AP. Ecology and Classification of North American Freshwater Invertebrates. 2nd ed. San Diego: Academic Press, 195-254.
Weider LJ, Hobaek A, Colbourne JK, Crease TJ, Dufresne F, Hebert PDN. 1999a. Holoarctic phylogeography of an asexual species complex. I: Mitochondrial DNA variation in arcticDaphnia[J].Evolution, 53: 777-792.
Weider LJ, Hobaek A, Hebert PDN, Crease TJ. 1999b. Holarctic phylogeography of an asexual species complex. II: Allozymic variation and clonal structure in ArcticDaphnia[J].Mol Ecol, 8: 1-13.
Xi YL, Chen YQ, Zhuge Y, Huang XF. 2003. Sequence analysis of rDNA 18s - 28s intergenic spacer regions fromBrachionus calyciflorus,B. bidentata,B. diversicornisandB. ngularisin lake Donghu, China [J].Acta Hydrobiol Sin, 27(4): 427-430. [席贻龙, 陈月琴, 诸葛燕, 黄祥飞. 2003. 四种臂尾轮虫rDNA 18S—28S基因间隔区的序列测定与分析. 水生生物学报, 27(4): 427-430.]
Xiang XL, Xi YL, Hu HY. 2006. Phylogenetic relationships ofBrachionusrotifers based on rDNA ITS 1 gene sequences [J].Acta Zool Sin, 52(6): 1067-1074.
Xiao JY, Wang J, An ZS, Wu XH, Zhou WJ. 1998. Evidence for the Younger Dryas Event in the eastern part of Nanling Region [J].Acta Bot Sin, 40: 1079-1082. [萧家仪, 王 建, 安芷生, 吴锡浩, 周卫建. 1998. 南岭东部新仙女木事件的孢粉学证据. 植物学报, 40(11): 1079-1082.]
Yu Y, Yan Q, Feng W. 2008. Spatio-temporal heterogeneity of plankton communities in lake Donghu, China, as revealed by PCR-denaturing gradient gel electrophoresis and its relation to biotic and abiotic factors [J].FEMS Microbiol Ecol, 63: 328-337.
Zhang JY. 2009. Taxonomical status and ecological difference of twoBrachionus calyciflorusmorphotypes [D]. Master thesis, Anhui Normal University, Wuhu. [张晋艳. 2009. 两种形态型萼花臂尾轮虫的分类地位和生态差异研究. 硕士论文, 安徽师范大学, 芜湖.]
Spatial Patterns of Genetic Differentiation inBrachionus calyciflorusSpecies Complex
XIANG Xian-Ling, XI Yi-Long*, WEN Xin-Li, ZHANG Jin-Yan, MA Qin
(College of Life Sciences, Anhui Normal University; Key Laboratory of Biotic Environment and Ecological Safety in Anhui Province, Wuhu241000,China)
To understand spatial patterns of genetic differentiation in theBrachionus calyciflorusspecies complex, the rDNA ITS regions of 124 rotifer clones collected from eight geographic regions in East China were sequenced and analyzed. A total of 73 haplotypes were defined, and were grouped into three clades by the phylogenetic trees. The divergences of ITS sequence among the three clades ranged from 4.2% to 25.3%, indicating the occurrence of three cryptic species (cryptic species Ⅰ, cryptic species Ⅱ and cryptic species Ⅲ). The sympatric co-occurrence of these cryptic species was observed at Guangzhou, Danzhou and Wuhu. The nucleotide diversity inB. calycifloruscomplex was higher, and so was haplotype diversity. Within cryptic species III, the higher genetic differentiation might be attributed to fragmentation and restricted gene flow. In addition, the rapid increase of colonizers after an ambiguous glacial bottleneck might interfere with effective gene flow and accelerate genetic differentiation of geographic populations. The nested clade analysis suggested to some extent the geographic structure, and the non-significant correlation existed between the geographic distance and the average pairwise difference between populations (Da) as well asFst. The Younger Dryas(YD)Event after the last full glacial period might has considerable effect on the patterns of geographic structure and distribution of crypticB. calyciflorusspecies. During the YD event, the three cryptic species probably retreated and co-occurred in multiple relict refugia to the south of Nanling area. Long-distance colonization possibly coupled with subsequent fragmentation might be the main reason of the current patterns of geographic structure. The geographic distribution ofB. calycifloruscomplex on a global scale might be attributed to the motion of continental plates.
book=31,ebook=213
Brachionus calyciflorus; Species complex; Genetic differentiation; Spatial pattern; Nested clade analysis; Phylogeography
Q349.1; Q958.12;Q178.51
A
0254-5853-(2010)03-0205-016
10.3724/SP.J.1141.2010.03205
2009-12-04;接受日期:2010-04-20
国家自然科学基金(30770352, 30499341);安徽省优秀青年基金(08040106904);安徽省教育厅自然科学基金(KJ2009B089Z);“重要生物资源保护和利用研究”安徽省重点实验室专项基金资助;安徽师范大学青年基金资助项目(2008xqn71)
*通讯作者(Corresponding author),E-mail: ylxi1965@yahoo.com.cn
项贤领(1978 - ),男,博士生,讲师,主要从事分子生态学和系统地理学研究
