镉对中国林蛙变态和性腺分化的影响
2010-12-25黄敏毅王宏元张育辉
黄敏毅,王宏元,张育辉*
(1. 陕西师范大学 生命科学学院,陕西 西安 710062;2. 安庆师范学院 生命科学学院, 安徽 安庆 246011)
镉对中国林蛙变态和性腺分化的影响
黄敏毅1,2,王宏元1,张育辉1,*
(1. 陕西师范大学 生命科学学院,陕西 西安 710062;2. 安庆师范学院 生命科学学院, 安徽 安庆 246011)
将发育到26—27期的中国林蛙(Rana chensinensis)共200例蝌蚪分别暴露在0.05、0.1、0.2和0.4 mg/L Cd2+的水体中直至完全变态。解剖完全变态后的幼蛙,观察其性腺分辨性别,统计雌性比率。用免疫组织化学方法检测雌激素受体(estrogen receptors,ER)在肝细胞的表达定位。结果显示:①Cd2+诱导蝌蚪变态时出现肢体畸形,但畸形率与Cd2+处理浓度相关性较低,0.4 mg/L Cd2+组肢体畸形率较高。②Cd2+影响林蛙幼体的性腺分化。与对照组相比,0.05 mg/L Cd2+组的雌性比率明显增大,0.1、0.2和0.4 mg/L Cd2+组的雌性比率相对降低,其中0.2 mg/L Cd2+组差异显著。在0.2和0.4 mg/L Cd2+组中出现个别雌雄同体。 ③ER在Cd2+处理组的肝细胞质和细胞核中均有阳性表达,但ER的表达量与Cd2+浓度不呈现线性相关。以上结果表明,Cd2+可以通过干扰性激素的分泌而影响蝌蚪变态和性腺发育。
镉;中国林蛙;肢体畸形;性腺
重金属镉是动物体内的非必需元素,具有致癌、致畸和致突变的毒性,属于环境内分泌干扰物,具有激素效应,对生殖和内分泌功能具有较大的影响,但对其研究,大部分集中在哺乳动物(Byrne et al,2009;Iavicoli et al,2009)。据报道,两栖动物种群数量在急剧下降,环境化学污染是其重要的影响因素之一(Alford et al,2001;Hayes et al,2002;Kiesecker et al,2001)。有报道证明,许多外源性化学物质具有类雌激素作用,导致两栖动物性腺发育异常(Bögi et al,2003;Carey & Bryant,1995;Hayes et al,2003)。镉对于两栖动物的有关毒性研究大都集中在对其生长发育的影响(Gross et al,2007;Sharma & Patiño,2008),而对生殖活动的激素效应研究较少(Sharma & Patiño,2009)。中国林蛙(Rana chensinensis)是一种具有经济价值的两栖动物,广泛分布于中国北方各地。镉对于林蛙蝌蚪的急性毒性以及对生长发育影响的有关实验证实,镉对蝌蚪的安全浓度为1.22 mg/L Cd2+。在安全浓度以下,镉可抑制中国林蛙蝌蚪的生长发育,延缓变态(Huang & Zhang,2006)。本文就镉对于蝌蚪变态过程中的慢性毒性以及对性腺分化和性别决定的效应着重报道,以期探讨低浓度镉对于两栖动物幼体产生异常发育以及对生殖内分泌活动的影响,为中国林蛙生殖生态研究提供参考资料,并为环境保护和治理提供评价指标。
1 材料与方法
1.1 材 料
所用试剂氯化镉(CdCl2·2.5H2O),相对分子质量228.35,AR,纯度99%(西安化学试剂厂产品)。中国林蛙受精卵采于秦岭北坡的沟麓地带,室内孵化,蝌蚪发育到26—27期,适应2 d后,选取体质健康、大小相似的个体进行实验。
1.2 暴露实验样本处理
在Cd2+的安全浓度下(Huang & Zhang,2006),分别设浓度为0.05、0.1、0.2和0.4 mg/L Cd2+4个处理组和1个对照组。将蝌蚪暴露在35 cm×27 cm×12 cm水族箱含Cd2+的水体中,每组40例,共200例。用4 L曝气3 d以上的自来水,水温15—21℃。到尾退化后期,停止加Cd2+,改用500 mL水体;变态期在水族箱一角放入沙土,以便幼蛙活动。每2 d换1次水,同时加药,禁食0.5 d。所加食物有蛋黄、豆渣和菜叶,用AA-320型原子吸收分光光度计检测食物,未检测到Cd2+含量。
实验中观察出现畸形的蝌蚪及幼蛙行为,在蝌蚪完成变态后,统计幼蛙畸形率;剔除畸形个体肢体肌肉,用Leica体视显微镜观察畸形肢体的骨骼,Sony数码相机拍照。
用体视显微镜观察完全变态后幼蛙的性腺,统计雌性比率。部分不易分辨的性腺做常规石蜡切片,HE染色后,在显微镜下观察分辨。
1.3 免疫组织化学检测
从各组幼蛙中随机选取10例雄性个体,麻醉后剖腹, 摘取肝脏。 取材后置改良的Bouin’s液固定,常规石蜡切片,片厚5 μm。片经裱后烘干。
采用SABC免疫组织化学程序:(1)切片常规脱蜡至水。(2)将切片浸入用蒸馏水配置的3% H2O2,室温下处理5—10 min以灭活内源性酶,蒸馏水冲洗3次。(3)用0.01 M/L枸橼酸盐缓冲液(pH=6.0)热修复2—3次,即加热至沸腾(92—95℃),间隔10 min,PBS洗1—2次。(4)抗原修复液修复5—10 min,PBS洗3次。(5)山羊血清室温下封闭30 min。(6)甩去血清,滴加第一抗体稀释液,分别为兔抗人雌激素受体(ER)(1∶100,Boster产品)。4℃孵育24 h,PBS洗2 min×3次。(7)滴加即用型羊抗兔IgG (Boster产品),20—37℃孵育30 min,PBS洗2 min×3次。(8)滴加SABC复合物,20—37℃孵育30 min,0.1 mol/L PBS洗5 min×4次。(9)DAB显色5—30 min,用0.1 mol/L PBS冲洗以终止反应。(10)常规脱水,透明,封片。(11)镜检,拍照。用PBS代替一抗作阴性对照。
镜检阳性反应产物的标准:胞质和胞核内出现棕黄色颗粒,颗粒染色明显高于背景底色为阳性,阴性对照为无色。
1.4 图像分析处理
从各组随机选3张切片,用Leica DMLB2显微镜在每张切片上选5个视野,通过图像采集系统(Leica Qwin V3)采集图像,在同一条件下,每个视野内测定10个细胞的免疫阳性反应物灰度,灰度水平分0—256级,代表ER表达的相对值。阳性反应越强着色越深,其相对值越小。
1.5 数据统计分析
实验中所有数据采用SPSS 10.0统计软件分析,用平均值±标准差(Mean±SD)表示,总体比较采用单因素方差分析(one-way ANOVA),组间多重比较采用事件后分析(post-hoc,LSD)检验。
2 结 果
2.1 镉对于林蛙肢体发育的影响
统计镉处理后的幼蛙畸形率,结果在0.05、0.1、0.2和0.4 mg/L Cd2+组,幼蛙的畸形率分别为10%、5%、1%和18%(表1)。不同镉浓度处理组蝌蚪在不同发育时期的畸形各异,每个处理组均有部分蝌蚪的尾部出现弯曲变形(图1:1),而对照组则没有。在变态后,与对照组里正常的幼蛙(图1:2)不同,处理组一些幼蛙出现前后肢畸形,在0.05 mg/L Cd2+组出现两后肢交叉弯曲(图1:3);0.4 mg/L Cd2+组的畸形有的后肢一侧伸直,另一侧正常(图1:4),有的则双侧后肢均伸直(图1:5);有的两侧后肢不对称,出现倾斜(图1:6);在0.1 mg/L Cd2+组幼蛙的畸形为两侧后肢柔弱,在蹠骨和跗骨关节处出现弯曲(图1:7);在0.2 mg/L Cd2+组个别畸形表现为右前肢向左弯曲(图1:8)。
剥离正常幼蛙后肢,游离后肢骨:股骨、胫腓骨、跗骨、蹠骨和趾骨等5部分,股骨为一长骨,近端的股骨头膨大成球形,入髋臼构成髋关节,远端与胫腓骨相关节,两端均有软骨(图1:9)。胫腓骨由胫、腓两骨合并而成,胫骨较粗,腓骨较细,近端与股骨形成膝关节,远端与跗骨形成踝关节(图1:10)。在畸形幼蛙的后肢,股骨和胫腓骨之间无正常关节之间的凹凸相接,缺少关节腔(图1:11,12,13)。蹠骨和附骨之间的关节出现弯曲(图1:14,15)。
2.2 畸形个体的运动行为
畸形蝌蚪或幼蛙运动缓慢,对外界刺激反应迟钝。畸形肢体致使其跳跃运动障碍,一般多在浅水中静息,在外加刺激时才有所反应,一般刺激1次,可连续跳跃1—3次,而后休息。在对照组,正常的幼蛙,刺激1次会连续跳跃5—7次,寻找躲避位置。在两侧后肢均伸直的个体,其运动则依赖前肢匍匐拖动身体;在一侧后肢伸直另一侧正常的个体,依赖于正常后肢的弯曲做跳跃运动;在一侧前肢畸形的个体,依靠另一侧前肢与后肢跳跃,运动时身体常偏向畸形前肢的一侧。
2.3 镉对于林蛙雌性比率的影响
在完成变态后的正常幼蛙,雄性的精巢呈长棒状,乳白色,表面光滑,大小均匀,较卵巢小。组织切片观察,精巢内生精小管分化不明显,主要是精原细胞。雌性幼蛙卵巢呈扁平条状,乳白色,含半透明状颗粒。显微镜下观察,卵巢内有圆形、椭圆形的卵母细胞。
统计变态后幼蛙的雌性比率,对照组雌性为57.5%。与对照组相比,0.05 mg/L Cd2+组雌性比率显著增大(P<0.05,one-way ANOVA);0.1 mg/L Cd2+组差异不显著(P>0.05,one-way ANOVA);0.2 mg/L Cd2+组的雌性比率较低(P<0.05);0.4 mg/L Cd2+组差异不显著(P>0.05,one-way ANOVA)(表1)。在0.2和0.4 mg/L Cd2+处理组,出现个别雌雄同体,即一侧为精巢,另一侧为卵巢;还有的出现精卵巢现象(图2)。

表 1 镉的处理后林蛙的畸形率和雌性比率Tab. 1 Malformed rate and female rate of young frog R. chensinensis treated with cadmium
2.4 镉处理后幼蛙肝细胞中的ER表达
在对照和镉处理组雄性幼蛙的肝细胞中,ER在胞质和胞核均有阳性反应,着色由浅黄至棕黄色,阳性反应产物呈颗粒状聚集,阴性对照无阳性反应。通过对阳性反应产物的检测,分析其表达相对值,虽然在镉的处理组幼蛙的肝细胞内ER均有表达,但其表达的强弱与处理浓度之间并不呈现规律性关系(图3)。与对照组比较,0.05 mg/L Cd2+组 ER呈强阳性反应(P<0.05,one-way ANOVA);0.1和0.2 mg/L Cd2+组ER呈现弱阳性反应(P<0.05,one-way ANOVA);0.4 mg/L Cd2+组与对照组无明显差异(P>0.05,one-way ANOVA)。
3 讨 论
3.1 镉对于林蛙蝌蚪变态的影响

图 2 中国林蛙雌雄同体性腺Fig. 2 Hermaphrodite gonads in R. chensinensis
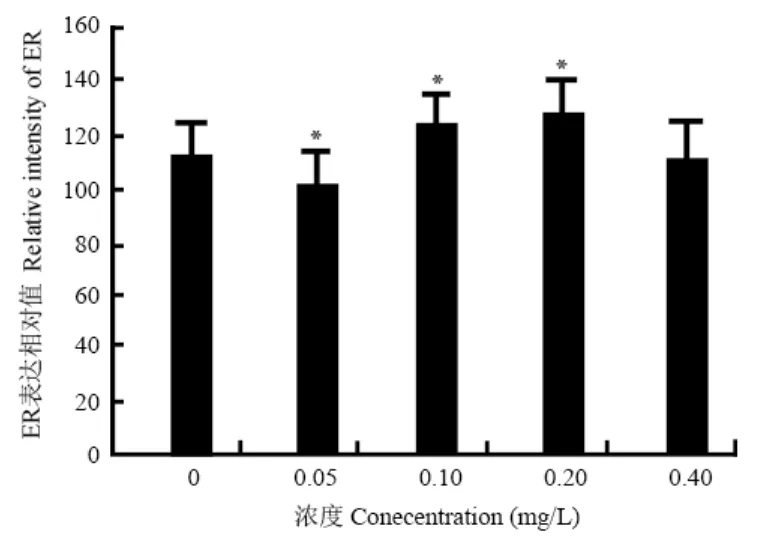
图 3 雄性幼蛙肝细胞ER表达的相对值(平均值±标准差)Fig. 3 Relative value of ER in liver cells of male young frog R. chensinensis (Mean±SD)
实验表明,镉是可以影响中国林蛙蝌蚪的生长发育,延缓发育。随着镉浓度的升高,蝌蚪完成变态的速度降低,变态所需的时间延长(Huang & Zhang,2006)。本实验结果可见,蝌蚪在发育变态为幼蛙的过程中,低浓度镉的处理后,幼蛙肢体出现畸形,但畸形率与镉浓度未呈现一定的规律性。目前已经知道,两栖动物的肢体发育是一个可塑性过程,许多环境因子都可能干扰肢体的发育程序,产生肢体畸形(Ankley et al,2004)。本实验中幼蛙肢体畸形仅出现镉处理组,对照组则没有,说明影响肢体发育造成畸形的主要是镉的干扰。但是肢体的畸形率并没有与浓度呈现相一致的关系,这可能与机体内存在的金属硫蛋白有关。一定浓度的镉离子可诱导金属硫蛋白快速表达,金属硫蛋白与镉离子的高度亲和后又可以降低镉的毒性(Klaassen et al,2009)。由于镉诱导产生金属硫蛋白是一个复杂过程,不同个体的反应能力可能存在差异,故畸形的发生率不一定与镉对林蛙的处理浓度相吻合,详细机制仍有待揭示。
两栖动物的变态依赖于体内甲状腺素的水平,甲状腺素对机体的新陈代谢、神经组织和骨的发育具有重要的调节作用,垂体−甲状腺轴可作为环境内分泌干扰物活动作用的靶目标(Gray et al,2002)。镉离子可通过影响甲状腺的活动,影响蝌蚪的变态(Sharma & Patiño,2008)。本实验结果可见,在蝌蚪变态过程中,镉可导致蝌蚪动作迟缓,尾部出现弯曲变形,肢体畸形。这些是否为镉离子通过干扰甲状腺活动所致,仍需实验证实。
3.2 镉对于林蛙蝌蚪性别分化的影响
两栖动物大多数物种的性腺分化不受基因决定,环境内分泌干扰物可通过影响性类固醇激素的活动而干扰性腺分化(Hayes, 1998)。Sharma & Patiño(2009)用浓度分别为1、8和85 µg/L Cd2+处理非洲爪蟾的胚胎直至变态,结果表明,镉可影响其生长发育,没有影响性别分化,可见镉对于非洲爪蟾未表现出强的激素效应,但该研究认为此结果不排除镉对于两栖动物具有弱的激素效应。中国林蛙的性腺分化从31期开始,37期完成卵巢分化,精巢分化在变态后完成,性腺分化对外界环境敏感(Li et al,2001)。本实验的镉暴露处理在蝌蚪26—27期至完全变态,处理过程历经性腺分化时期。实验结果表明,镉对于林蛙蝌蚪性腺分化有影响,具有一定的激素效应,但这种效应并不与镉的剂量呈现线性相关。这个结果与镉对非洲爪蟾性腺分化的影响存在差异,是由于物种的差异还是由于处理浓度和处理方式的不同,原因仍不明了。
Carey & Bryant(1995)报道,亚致死量的化学物质可使两栖动物的变态滞后,出现雌雄同体现象。Hayes et al(2003)在实验室内用阿特拉津诱导美洲豹蛙幼体出现雌雄同体,推测这种除草剂可能通过提高芳香化酶的合成,使幼体出现雌雄同体。含有烷基酚等具有雌激素活性的水体也可导致非洲爪蟾和欧洲林蛙会产生镶嵌型的性腺(Bögi et al,2003)。本实验的0.2和0.4 mg/L Cd2+处理组中,有个别雌雄同体。一般认为,环境化学污染物对性腺分化的影响是对类固醇激素合成的关键蛋白StAR分子或一些关键酶的影响,导致类固醇激素合成受阻,从而出现雌雄同体(Walsh et al,2000)。
3.3 镉对雄性个体肝细胞内ER表达的影响
雌激素对靶细胞的作用由雌激素受体(ER)介导,ER作为配体激活的转录因子调控靶基因表达。雌激素主要在肝细胞中代谢和分解,肝细胞内存在ER,分布在肝细胞质和细胞核中(Chamness et al,1975)。所以,肝对血液中雌激素水平较敏感(Vogiatzis & Loumbourdis,1998)。因此,通过检测肝细胞内ER的变化,可对内分泌干扰物的激素效应进行有效地评估(Lutz & Kloas,1999)。用17β–雌二醇(E2)处理雄性大鼠,肝内ER和ER mRNA水平提高(Koritnik et al,1995),说明E2可高调肝细胞ER水平,而ER的高调则可能与雄性个体雌性化有关(Villa et al,1988)。
镉属于环境内分泌干扰物,镉的激素效应已有报道,但在不同条件下,镉是雌激素效应还是雄激素效应占主导地位尚无确切定论,且在同一物种中,镉诱导的激素效应依赖于镉的剂量(Byrne et al,2009;Iavicoli et al,2009)。在本实验,较低浓度组的ER表达高调,较高浓度组的ER表达降低,而最高浓度组的ER表达却变化不明显。这可能与镉离子通过与ER相互作用抑制正常激素与ER的结合相关(Stoica et al,2000;Martin et al,2003)。所以虽然肝细胞ER表达水平的变化与镉对于林蛙剂量有关,但这种关系与在肢体畸形发生以及性腺分化中的效应类似,同样不是一种线性相关,这可能是激素效应的特性。
Alford RA, Dixon PM, Pechmann JH. 2001. Ecology. Global amphibian population declines [J].Nature, 412(6848): 499-500.
Ankley G, Degitz SJ, Diamond SA, Tietge JE. 2004. Assessment of environmental stressors potentially responsible for malformations in North American anuran amphibians [J].Ecotoxicol Environ Saf, 58(1): 7-16.
Bögi C, Schwaiger J, Ferling H, Mallow U, Steineck C, Sinowat F, Kalbfus W, Negele RD, Lutz I, Kloas W. 2003. Endocrine effects of environmental pollution onXenopus laevisandRana temporaria[J].Environ Res, 93(2): 195-201.
Byrne C, Divekar SD, Storchan GB, Parodi DA, Martin MB. 2009. Cadmium-a metallohormone [J].Toxicol Appl Pharmacol, 238(3): 266-271.
Carey C, Bryant CJ. 1995. Possible interrelations among environmental toxicants, amphibian development, and decline of amphibian populations [J].Environ Health Perspect, 103(suppl4): 13-17.
Chamness GC, Costlow ME, McGuire WL. 1975. Estrogen receptor in rat liver and its dependence on prolactin [J].Steroids, 26(3): 363-371.
Gray LE Jr, Ostby J, Wilson V, Lambright C, Bobseine K, Hartig P, Hotchkiss A, Wolf C, Furr J, Price M, Parks L, Cooper RL, Stoker TE, Laws SC, Degitz SJ, Jensen KM, Kahl MD, Korte JJ, Makynen EA, Tietge JE, Ankley GT. 2002. Xenoendocrine disrupters-tiered screening and testing: Filling key data gaps [J].Toxicology, 181-182: 371-382.
Gross JA, Chen TH, Karasov WH. 2007. Lethal and sublethal effects of chronic cadmium exposure on northern leopard frog (Rana pipiens) tadpoles [J].Environ Toxicol Chem, 26(6): 1192-1197.
Hayes T, Haston K, Tsui M, Hoang A, Haeffele C, Vonk A. 2002. Herbicides: feminization of male frogs in the wild [J].Nature, 419(6910): 895-896.
Hayes T, Haston K, Tsui M, Hoang A, Haeffele C, Vonk A. 2003. Atrazine-induced hermaphroditism at 0.1 ppb in American leopard frogs (Rana pipiens): laboratory and field evidence [J].Environ Health Perspect, 111(4): 568-575.
Hayes TB. 1998. Sex determination and primary sex differentiation in amphibians: genetic and developmental mechanisms [J].J Exp Zool,281(5): 373-399.
Huang MY, Zhang YH. 2006. Toxic effects of cadmium onRana chensinensistadpole growth and development [J].Chn J Ecol, 25(5): 535-540. [黄敏毅, 张育辉. 2006. 镉对中国林蛙蝌蚪生长发育的毒性效应. 生态学杂志, 25(5): 535-540.]
Iavicoli I, Fontana L, Bergamaschi A. 2009. The effects of metals as endocrine disruptors [J].J Toxicol Environ Health B:Crit Rev, 12(3): 206-223.
Kiesecker JM, Blaustein AR, Belden LK. 2001. Complex causes of amphibian population declines [J].Nature, 410(6829): 681-684.
Klaassen CD, Liu J, Diwan BA. 2009. Metallothionein protection of cadmium toxicity [J].Toxicol Appl Pharmacol, 238(3): 215-220.
Koritnik DR, Koshy A, Hoversland RC. 1995. 17 β-estradiol treatment increases the levels of estrogen receptor and its mRNA in male rat liver [J].Steroids, 60(8): 519-529.
Li XH, Zhao WG, Guo YM, Xue JH. 2001. Development of sexual gland and influence of temperature on sexual differentiation inRana chensinensis[J].Zool Res, 22(5): 351-356. [李新红, 赵文阁, 郭玉民,薛建华. 2001. 中国林蛙性腺的发育及温度对其性别分化的影响.动物学研究, 22(5): 351-356.]
Lutz I, Kloas W. 1999. Amphibians as a model to study endocrine disruptors:Ⅰ. Environmental pollution and estrogen receptor binding [J].Sci Total Environ, 255 (1-2): 49-57.
Martin MB, Reiter R, Pham T, Avellanet YR, Camara J, Lahm M, Pentecost E, Pratap K, Gilmore BA, Divekar S, Dagata RS, Bull JL, Stoica A. 2003. Estrogen-like activity of metals in MCF-7 breast cancer cells [J].Endocrinology, 144(6): 2425-2436.
Sharma B, Patiño R. 2008. Exposure ofXenopus laevistadpoles to cadmium reveals concentration-dependent bimodal effects on growth and monotonic effects on development and thyroid gland activity [J].Toxicol Sci, 105(1): 51-58.
Sharma B, Patiño R. 2009. Effects of cadmium on growth, metamorphosis and gonadal sex differentiation in tadpoles of the African clawed frog,Xenopus laevis[J].Chemosphere, 76(8): 1048-1055.
Stoica A, Katzenellenbogen BS, Martin MB. 2000. Activation of estrogen receptor-αby the heavy metal cadmium [J].Mol Endocrinol, 14(4): 545-553.
Villa E, Baldini GM, Rossini GP, Pasquinelli C, Melegari M, Cariani E, Tata C, Bellentani S, Ferrari A, Manenti F. 1988. Ethanol-induced increase in cytosolic estrogen receptors in human male liver: a possible explanation for biochemical feminization in chronic liver disease due to alcohol [J].Hepatology, 8(6): 1610-1614.
Vogiatzis AK, Loumbourdis NS. 1998. Cadmium accumulation in liver and kidneys and hepatic metallothionein and glutathione levels inRana ridibundaafter exposure to CdCl2[J].Arch Environ Contam Toxicol, 34(1): 64-68.
Walsh LP, McCormick C, Martin C, Stocco DM. 2000. Roundup inhibits steroidogenesis by disrupting steroidogenic acute regulatory (StAR) protein expression [J].Environ Health Perspect, 108(8): 769-776.
Effects of Cadmium on Metamorphism and Gonad Differentiation inRana chensinensis
HUANG Min-Yi1,2, WANG Hong-Yuan1, ZHANG Yu-Hui1,*
(1.College of Life Science, Shaanxi Normal University,Xi’an710062, China; 2.School of Life Science, Anqing Teachers College, Anqing246011,China)
200 tadpoles ofRana chensinensisat stage 26 − 27 were exposed to 0.05, 0.1, 0.2 or 0.4 mg/L Cd2+in tap water respectively until they’re fully metamorphic after which the heteromorphic young frogs in different treatments were anatomized, females and males were identified through gonad observation, and the female ratio was calculated. Localization of estrogen receptors (ER) in liver cells was investigated in different treatments using immunocytochemistry. The results showed that Cd2+might induce limb abnormality, however, there was little correlation between abnormality rate and cadmium concentration in lower Cd2+levels except for a higher limb abnormality ratio in the 0.4 mg/L group. On the other hand, Cd2+could affect gonad differentiation. Compared to the control group, the proportion of female population increased in the 0.05 mg/L group and decreased in the 0.1, 0.2 and 0.4 mg/L ones. The sex rate in the 0.2 mg/L group is significantly different from that in the control group. Hermaphrodite gonads appeared in the two treatments with 0.2 mg/L and 0.4 mg/L of Cd2+. Additionally, ER expression was positive in both cytoplasm and nucleolus of liver cells in Cd2+treated groups. But, there was no linear relationship between ER expressions levels and the concentration of Cd2+. These results suggested that cadmium can influence tadpole metamorphosis and gonad development by affecting the secretion of sex hormone.
Cadmium;Rana chensinensis; Limb abnormality; Gonad
X174:Q959.530.5;O614.242 ; Q954.5
A
0254-5853-(2010)03-0275-07
10.3724/SP.J.1141.2010.03275
2009-09-17;接受日期:2010-01-09
国家自然科学基金资助项目((130770243)
*通讯作者(Corresponding author),E-mail: yu-huizhang@163.com
黄敏毅,女,硕士研究生,主要从事动物生态毒理学研究
