土木香中纯化的五种倍半萜类化合物抑制肿瘤增殖活性的研究
2010-12-06李铁库温士旺张月峰田子强史清文铃木信夫
李 勇,李铁库,温士旺,张月峰,田子强,史清文,铃木信夫
(1.河北医科大学第四医院胸外科,河北石家庄 050011;2.河北易县妇幼保健院,河北易县 074200;3.河北医科大学药学院,河北石家庄 050017;4.千叶大学医学部环境影响生物化学教室,日本千叶市)
本文对从土木香的根中纯化的五种倍半萜内酯化合物[2]进行了体外抑制肿瘤细胞增殖活性实验和对小鼠移植性肝癌生长的抑制实验,并探讨了这五种化合物结构与活性之间的关系。
1 材料与方法
1.1 试验药物 五种倍半萜类化合物:Isoalantolactone(异土木香内酯,1);3,9-Diacetoxy1,10-epoxy,4(5)-germacraen-12,6α-olide(2);3,9-Diacetoxy1(10),4(5)-germacra-dien-12,6α-olide(3);2-Hydroxy-11,13-dihydroxy-isoalantolactone(4)和 11,13-Dihydroxyisoalantolactone(5)从土木香的根中分离得到,均为白色针晶,经一维和二维核磁共振光谱和质谱确定它们的结构(Fig 1),经HPLC和1H-NMR检查,纯度在99%以上。

Fig 1 Chemical structures of five sesquiterpenoids for experiment1:Isoalantolactone;2:3,9-Diacetoxy1,10-epoxy,4(5)germacraen-12,6α-olide;3:3,9-Diacetoxy1(10),4(5)germacra-dien-12,6α-olide;4:2-Hydroxy-11,13 dihydroxyisoalantolactone;5:11,13-Dihydroxyisoalantolactone
1.2 药品和试剂 噻唑蓝(MTT,Sigma,M-2128);RPMI 1640 培养基(Gibco);顺铂(Sigma,034k3693)。
1.3 细胞系和实验动物 肿瘤细胞株由日本千叶大学医学部第二生物化学教研室提供。U251SP和T-98:人脑神经胶质瘤细胞株;HLE:人肝癌细胞株;MM1-CB和HMV-1:人黑色素瘤细胞株;KT:人乳腺癌脑转移肿瘤细胞株。实验用小鼠为昆明小鼠,体质量18~22 g,合格证号冀动字805213号,河北医科大学实验动物中心提供。试验期间饲以该中心提供的饲料,自由饮水。
1.4 实验方法 参照文献[3]中的方法。细胞接种于96孔板,每孔含1×104个细胞,分别加入溶剂对照(终浓度0.5%DMSO)、阳性对照顺铂和化合物1~5,终浓度为 100、10 和 1 μmol·L-1,每组设 3 复孔,置于饱和湿度、37℃、5%CO2培养箱中培养48 h。于培养结束前4 h,各培养孔加入5 g·L-1MTT。实验终止测定各孔吸光度值(OD值),测定波长λ=570 nm,参考波长λ=630 nm,并计算细胞增殖抑制率。细胞增殖抑制率/%=(1-对照组OD值/对照组OD值)×100%。
[4]的方法,移植性肝癌 H22小鼠模型,随机分为5组,每组10只。空白对照组灌胃给予水(0.2 ml/10 g);环磷酰胺组腹腔注射环磷酰胺(30 mg·kg-1·d-1);给药实验组分为 1、10 和 100 mg·kg-1·d-13个剂量组,灌胃给予异土木香内酯(0.2 ml/10 g),每日给药1次,连续10 d。d 10处死小鼠,剥取瘤块,称取瘤质量,计算肿瘤抑制率。肿瘤抑制率/%=(1-对照组平均瘤质量/给药组平均瘤质量)×100%。
2 结果
2.1 化合物1~5对体外培养的人脑神经胶质瘤细胞增殖的抑制作用 结果如Fig 2所示,阳性对照顺铂和化合物1处理人脑神经胶质瘤细胞(U251SP)后,均显示较强的增殖抑制作用,与空白对照组比较差异有显著性。顺铂和化合物1对U251SP细胞增殖的半数抑制浓度(IC50)分别为12.97 μmol·L-1和10.55 μmol·L-1,但顺铂和化合物1对人脑神经胶质瘤细胞T-98的增殖只显示中等程度的抑制活性;化合物2~5对U251SP和T-98细胞的增殖不显示抑制活性,IC50均大于 100 μmol·L-1。

Fig 2 The effect of isoalantolactone on the proliferation of U251SP(A)and T-98(B)tumor cell lines*P<0.05,**P<0.01 vs control
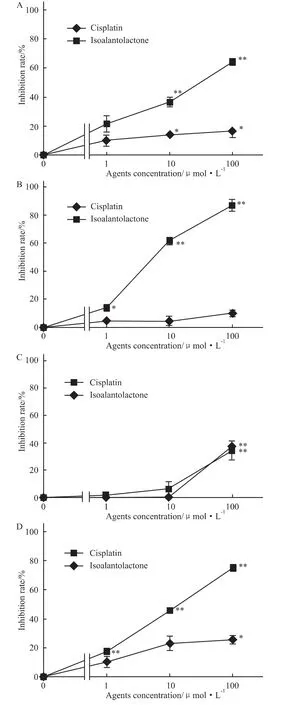
Fig 3 The effect of isoalantolactone on the proliferation of HLE(A)MM1-CB(B)HMV-1(C)and KT(D)tumor cell lines*P<0.05,**P<0.01 vs control
2.2 化合物1~5对体外培养的人肝癌细胞、黑色素瘤细胞和人乳腺癌脑转移肿瘤细胞增殖的抑制作用 顺铂对人乳腺癌脑转移肿瘤细胞(KT)的增殖显示较强的抑制活性,IC50仅为 8.20 μmol·L-1(Fig 3D),但对HLE、MM1-CB和HMV-1细胞增殖几乎不显示抑制活性(Fig 3A~C),而化合物1对HLE和MM1-CB细胞的增殖均显示明显抑制作用,与空白对照组及顺铂组比较差异均有显著性。化合物2仅在100 μmol·L-1剂量组对HLE细胞增殖显示中等程度的抑制活性,化合物2~5对HLE、MM1-CB、HMV-1和KT细胞的增殖不显示抑制活性,IC50均大于 100 μmol·L-1。
2.3 化合物1对小鼠移植性肿瘤H22增长的抑制作用 实验结果如Fig 4所示,腹腔给予环磷酰胺,明显地抑制小鼠肝癌 H22的生长,抑瘤率为67.56%,化合物 1 连续给药 10 d,100 mg·kg-1和10 mg·kg-1剂量组可明显抑制小鼠肝癌H22的生长,抑瘤率为65.50%和42.97%,与空白对照组相比差异具有显著性(P<0.01和P<0.05),并呈现较好的剂量依赖关系。
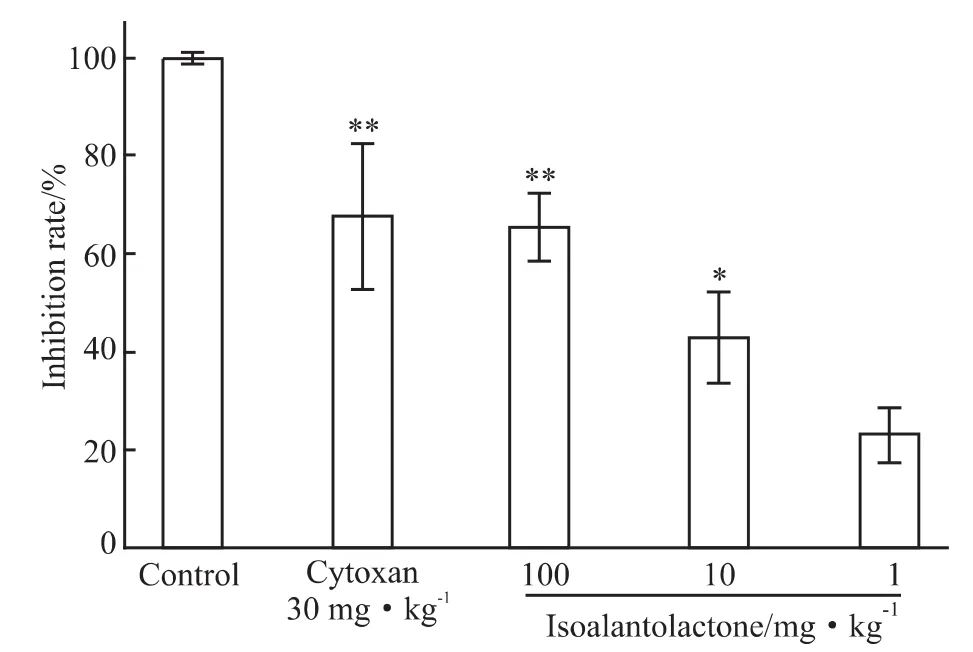
Fig 4 The anti-tumor activity of isoalantolactone on the H22 in mice*P<0.05,**P<0.01 vs control
3 讨论
癌症是威胁人类健康的一大杀手,目前临床上应用的抗癌药物74%来源于天然产物或是因受天然产物结构的启发而设计的合成药物。植物在其进化过程中合成了许多次生代谢天然产物[5],这些天然产物的发现和在临床上的广泛应用,极大地推动了化学家和药学家对抗癌药物的研发[6]。从包括植物在内的自然界中寻找高效低毒的抗癌活性成分或先导化合物成为国内外药物学家十分关注的课题和研究的热点[7-10]。
本实验结果显示,异土木香内酯对人脑神经胶质瘤细胞、肝癌细胞和人黑色素瘤的增殖均有明显的抑制作用,尤其是顺铂对人肝癌细胞和黑色素瘤细胞(MM1-CB)增殖几乎不显示抑制活性,而用异土木香内酯处理两种细胞后,与顺铂组相比差异具有显著性,并且呈现较好的剂量依赖关系;进一步的整体实验表明,异土木香内酯对小鼠肝癌H22生长具有抑制作用,有关作用机制的实验正在进一步研究中。异土木香内酯则对KT细胞增殖抑制作用较差,提示其对KT细胞具有不同作用机制,该实验正在进一步研究中。
同样从土木香根中提取得到的化合物2~5中,除了化合物2在100 μmol·L-1剂量组对人肝癌细胞的增殖具有抑制作用外,对本实验中其他所有肿瘤细胞株没有明显增殖抑制作用。从结构上分析异土木香内酯(1)属于桉叶烷型(Eudesmane)倍半萜内酯,A环和B环呈反式聚合,7,8位含有一个α,β-不饱和的五元内酯环,化合物3~5都含有饱和的五元内酯环,但没有环外双键;化合物2含有一个α,β-不饱和的五元内酯环,但A-环和B-环之间的键裂开,形成一个大10元环,改变了原来结构的构象,这可能是化合物2~5对人脑神经胶质瘤细胞、肝癌细胞(化合物2除外)、人黑色素瘤和人乳腺癌脑转移肿瘤细胞的增殖不显示抑制活性的原因。
随着土木香根提取物对其他肿瘤细胞株抗增殖作用的筛选以及对肿瘤细胞的增殖抑制作用机制的研究,会有更多新的发现。另外通过对化合物构-效关系的分析,对抗癌药物进一步的设计也具有指导意义。
参考文献:
[1]Konishi T,Shimada Y,Nagao T,et al.Antiproliferative sesquiterpene lactones from the roots of Inula helenium[J].Biol Pharm Bull,2002,25:1370-2.
[2]Yang C,Wang C M,Jia Z J.Sesquiterpenes and other constituents from the aerial parts of Inula japonica[J].Planta Med,2003,69:662-6.
[3]司徒镇强.细胞培养[M].北京:世界图书出版社,1996:134-8.
[3]Situ Z Q.Cell culture[M].Beijing:World Book Publishing Company,1996:134-8.
[4]杜德极,石小枫,冉长清,等.葛根的抗肿瘤作用[J].中药药理与临床,1994,10(2):16-9.
[4]Du D J,Shi X F,Ran C Q,et al.Anticancer activity of flos puerariae[J].Pharmacol Clin Chin Mat Med,1994,10(2):16-9.
[5]郑晓亮,刘雪莉,钱伯初.植物提取物诱导肿瘤细胞凋亡机制研究进展[J].中国药理学通报,2004,20(11):1201-5.
[5]Zheng X L,Liu X L,Qian B C.Progress in tumor cell apoptosis induced by plant extracts[J].Chin Pharmacol Bull,2004,20(11):1201-5.
[6]Clardy J,Walsh C.Lessons from natural molecules[J].Nature,2004,432:829-37.
[7]Shi Q W,Dong M,Huo C H,et al.New 17-hydroxy-taxane and 2,20-epoxy-11(15-1)abeotaxane from the needles of Taxus canadensin[J].Biosci Biotechnol Biochem,2007,71(7):1777-80.
[8]Altmann K H,Gertsch J.Anticancer drugs from nature-natural products as a unique source of new microtubule-stabilizing agents[J].Nat Prod Rep,2007,24:327-57.
[9]Lee K H.Current developments in the discovery and design of new drug candidates from plant natural product leads[J].J Nat Prod,2004,67(2):273-83.
[10]Saklani A,Kutty S K.Plant-derived compounds in clinical trials[J].Drug Discov Today,2008,13(3-4):161-71.
