左旋多巴甲酯对斜视性弱视猫模型的作用
2010-12-06李勇文张士军蒋伟哲黄仁彬
李勇文,林 兴,张士军,黎 荣,蒋伟哲,黄仁彬
(广西医科大学药理学教研室,广西南宁 530021)
弱视是影响儿童视力的主要疾病之一,不及时治疗可以导致终身视力低下,其形成与出生后早期的视环境不良或影响视觉发育的多种因素有关,其发病机制尚在探索中。90年代起,国内外学者[1]对药物治疗弱视进行了许多临床性的研究,目前临床上多采用左旋多巴治疗,取得了一定效果。然而,左旋多巴存在副作用多、耐受性差、效果不稳定等缺点。本实验组经过对左旋多巴进行结构得到左旋多巴甲酯(LDME),克服了左旋多巴的缺点,具有易溶于水、吸收快、易进入血脑屏障的特点。为观察LDME在相对单因素条件下对弱视眼的作用,我们以斜视性弱视猫模型作实验对象,探讨LDME对弱视发病机制的影响及对弱视的治疗作用。
1 材料与方法
1.1 主要仪器 眼电生理视觉诱发电位仪:德国罗兰RETI-Roland;包埋机:日本SAKURA FINETECHNICAL CO LTD,4590型;病理组织切片机:德国Leitz,2235型;病理图像分析仪:德国莱卡公司,DMR+550型;
1.2 主要试剂 c-fos原位杂交检测试剂盒(泰普生物科学有限公司,批号:09090630);DAB显色试剂盒(福州迈新生物技术公司,批号:DAB-0031);麻醉剂:乌拉坦20 g,加蒸馏水至100 ml;灌注液:NS;4℃ 40 g·L-1多聚甲醛;缓冲液:30 g·L-1柠檬酸,2 ×SSC,0.5 mol·L-1PBS;5 g·L-1多聚赖氨酸;DEPC:二乙基焦碳酸酯。
1.3 实验动物模型建立及分组 初生家养幼猫(4~6 wk)30只,体重约300~350 g。♀♂不分,常规检查双眼,确认外眼、屈光间质以及眼底无异常。随机分为6组,每组5只,即正常组(NC)、模型组(MC)、阳性对照组(PC)、盐酸左旋多巴甲酯低剂量组(LDMEL)、中剂量组(LDMEM)、高剂量组(LDMEH)。除正常对照组外,其余于4 wk时行眼外直肌切除术以造成人工斜视,饲养1 mon,经P-VEP确定形成弱视后,灌胃给与盐酸左旋多巴甲酯20、40、80 mg·kg-1,阳性对照组给左旋多巴 80 mg·kg-1,NC及MC均给与等量生理盐水,每天1次,连续30 d。动物饲养于符合医学实验动物环境设施要求的饲养环境中。
1.4 取材及脑片制作 取材前先将实验动物于给药后d 31,测定P-VEP实验结束后,各组猫均放入暗室内饲养48 h,然后暴露于正常视觉环境下2 h。用20%乌拉坦麻醉,将插管经左心室插入主动脉并切开右心房形成出口,首先经插管快速灌注4℃生理盐水400 ml,再灌注4%用DEPC处理过的多聚甲醛400 ml。开颅取脑,根据Snider猫立体定向图谱,分离出对应的视皮层17区,垂直矢状轴切取初级视皮层的脑组织,浸入多聚甲醛液中后固定6 h,经常规逐级脱水,二甲苯透明后,浸蜡包埋。切片厚6 μm。分别做Nissl染色和原位杂交组织化学染色。
1.5 脑片原位杂交组织化学染色程序 参照“c-fos原位杂交试剂盒使用说明”进行。
1.6 统计学处理 细胞胞质呈棕黄色者为阳性细胞。每张切片随机选出不重叠的3个视野进行计算机显微图像分析,计算每个视野中的阳性细胞数,换算成阳性细胞的密度。各组间阳性细胞数比较及各组猫P-VEP结果比较采用SPSS 13.0软件进行t检验。
2 结果
2.1 P-VEP检查结果各组猫P-VEP情况 从Tab 1可知,N75、P100、左右眼振幅比值、N75-135各组间均有不同程度的差异。在P100组中,MC组潜时延长,与正常组比较差异有统计学意义;治疗后各组与模型组比较,潜时均有不同程度缩短,以高剂量组最为明显,差异有统计学意义(P<0.01)。对于左右眼振幅比值,正常组的比值是0.85,斜视组为0.49,两者相比差异有统计学意义(P<0.01);经用药物治疗后左右眼振幅比值均有所恢复,弱视眼振幅升高,以高剂量组最为明显,与正常对照组比较,差异无统计学意义(P>0.05),结果见Tab 1。
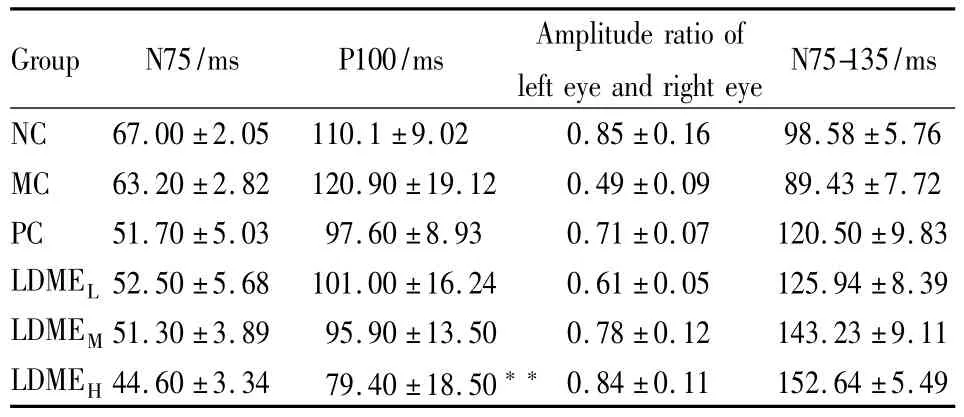
Tab 1 P-VEP of Each group(n=5)
2.2 Nissl染色光镜观察结果 Nissl染色中,视皮质神经元的尼氏小体呈深蓝色,细胞核淡蓝色。在40倍光镜下,正常对照组结构容易辨认,能够清楚的区分出视皮质4层结构:自外向内依次为分子层(Ⅰ)、外层(Ⅱ/Ⅲ)、颗粒层(Ⅳ)及内层(Ⅴ/Ⅵ ),神经元分布均匀,染色均一。以此作为原位杂交分层计数的基础。
2.3 左旋多巴甲酯对斜视性弱视猫视皮质c-fos基因表达影响 正常对照组猫视皮层c-fos mRNA阳性细胞分布广泛,表达活跃,杂交细胞在各层间的分布情况为:Ⅱ、Ⅲ、Ⅴ、Ⅵ层密度较高,Ⅳ层密度最低。与正常对照组相比较,模型对照组弱视猫视皮层cfos mRNA杂交细胞在各层均减少,差异有显著性(P<0.01)。与模型对照组相比,治疗组(包括PC、LDMEL、LDMEM、LDMEH)c-fos mRNA 杂交细胞在视皮质Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ层均有增加,除在Ⅳ外,其余各组差异有显著性(P<0.05),而其中以LDMEH组最为明显(P<0.01),见Tab 2。

Tab 2 Density of expression of positive staining neurons of c-fos mRNA in each of layers divisions of the striate cortex in normal and strabismic cats(cell·mm -2)
3 讨论
切断幼猫的外直肌,在术后4 wk后能观察到手术眼内斜视22°~35°,P-VEP检测 P100峰潜时,P100波幅值与对照眼比较,均有明显的潜时延长和波幅下降(P<0.05),说明斜视猫模型视路神经元生理特性己经发生改变,斜视性弱视猫模型建立成功。
PVEP是给与视觉刺激后,在枕骨所记录到诱发的生物电信号,反映了视觉信号从视网膜传导到视觉中枢的生物电活动,它主要反映视网膜、视路和视皮质的功能。弱视眼视皮质中枢对图形运动感觉及边界对比效应敏感的神经元存在异常[2~4],所以弱视眼图形VEP检查可出现明显的空间对比及时间特征方面的异常,与对侧眼或正常眼相比,可出现潜伏期延长及振幅降低[5,6]。Cleland 等[7]通过微电极技术测得弱视猫视皮质17区神经元空间敏感度下降与P-VEP改变相符。所以,P-VEP可以作为衡量弱视视皮质功能状态的间接依据,在弱视的诊疗中具有重要作用,而在基础研究中主要用于探讨弱视发生的机制及观察药物的作用[8]。本实验中正常猫的波形规整,有明显的波峰。MC组潜时延长,左右眼振幅比值降低,与正常组比较差异有显著性;治疗各组P100波幅值提升、P100峰潜时缩短,且与模型对照组比较差异有显著性,说明治疗药物左旋多巴甲酯不仅可以改善斜视性弱视猫的视敏度和视觉传导功能,斜视眼视功能有所恢复。其可能的机制:左旋多巴甲酯结构上与左旋多巴相似,其作用机制应该相似,左旋多巴是多巴胺的前体,多巴胺不能通过血脑屏障,而左旋多巴可穿过血脑屏障并转化为多巴胺,发挥其药理作用。故我们推测左旋多巴甲酯可能通过以下途径发挥作用:其一,弱视的发生可能与眼局部及中枢神经系统多巴胺等神经递质浓度相对不足,不能有效地传导该眼视觉细胞的神经冲动,造成视通道传导处于一种废用性休眠状态有关。通过给予脂溶性良好的LDME,LDME很容易进入脑内从而提高视觉通路DA的浓度,激活休眠状态的锥细胞及其视通道的功能,改善了该眼视路信息传导的状态,从而延长或恢复了视觉发育敏感期。另外,DA参与敏感期视皮质的发育,DA及儿茶酚胺代谢可以解除弱视眼的皮质抑制,从而改善视功能。
视皮质c-fos基因能够对突触刺激产生快速、短暂的表达,参与细胞内的信息传递过程的调节,视皮质c-fos基因反映神经细胞兴奋性的变化[9]。作为第一信使的外来刺激作用于胞膜上的受体,激活膜内的第二信使,后者与相应受体结合后产生兴奋性突触电位,引起神经元的兴奋,从而激活c-fos基因的转录,转录生成的mRNA逸出胞核到达胞质,翻译成Fos蛋白,并进一步与Jun蛋白结合形成异源二聚体-激活蛋白-1(AP-1),该异聚体蛋白重新转位至核内后,结合到靶基因的DNA调节区,作为一个转录调节因子进而控制晚期反应基因的表达,发挥信使作用,从而将细胞外的信息转换成细胞的一种持续功能变化[10,11]。谷氨酸受体、钙离子和cAMP的作用影响着该过程。出生后早期视觉环境通过影响神经元受刺激的水平来影响视皮质内cfos mRNA的表达。在视皮质内,c-fos mRNA的基础水平均较低[12],所以在暗环境下,免疫反应性不会有明显的改变而恢复自然环境短暂的时间后,c-fos mRNA会出现快速急剧短暂的增加,其数量相当于基础水平的4倍[13]。本试验预先将实验动物放入暗室内饲养48 h,然后暴露于正常视觉环境2 h,以诱导c-fos基因的快速转录。实验中各治疗组c-fos mRNA在斜视性弱视猫视皮质各层神经元的表达均增多,除在Ⅳ外,与模型组比较其余各组差异有显著性(P<0.05),说明给药后视皮质各层神经元出现一定程度恢复,甚至高剂量组在Ⅱ、Ⅲ、Ⅵ层与正常组比较,差异均无显著性(P>0.01)。提示c-fos mRNA能够反映视皮质细胞的功能状态。阳性对照组用药后,c-fos mRNA在斜视性弱视猫视皮质各层神经元的表达均增多,与左旋多巴甲酯低剂量组比较差异无统计学意义,但与左旋多巴甲酯中、高剂量组比较差异有统计学意义(P<0.01或P<0.05)。说明这两个剂量组猫视皮质各层神经元的表达或功能状态恢复比阳性对照组好。据此,我们推测:左旋多巴甲酯改善视功能可能与其介导视皮质c-fos基因的表达调控有密切关系,至于通过何种途径尚需进一步实验探讨。
[1]Gottlob I,Stangler-Zuschrott E.Effect of levodopa on contrast sensitivity and scotomas in human amblyoia[J].Invest Ophthalmol Vis Sci,1990,31(4):776-8.
[2]Levi D M,Manny R E.The pathophysiology of amblyopia:electrophysio logical studies[J].Ann NYA Cad Sci,1983,388:243- 63.
[3]邓大明,龙时先,麦光焕,等.左旋多巴对弱视眼视诱发电位影响的研究[J].眼科学报,1997,13:182-5.
[3]Deng D M,Long S X,Mai G H,et al.Effect of levodopa on visual evoked potential in amblyomia[J].Eye Sci,1997,13:182-5.
[4]Mohan K,Dhankar V,Sharma A.Visual acuities after levodopa administration in amblyopia[J].J Pediatr Ophthalmol Strabismus,2001,38:62-7.
[5]吴乐正,吴德正.临床视觉电生理学[M].北京:科学出版社,1999:362.
[5]Wu L Z,Wu D Z.Clinical visual electrophysiology[M].Beijing:Science Publing House,1999:362.
[6]马克明,徐宝玲,刘琳琳,等.图形视觉诱发电位在儿童弱视诊断中的应用[J].中国现代医生,2007,45(13):4-5.
[6]Ma K M,Xu B L,Liu L L,et al.The evaluation on the picture visual evoked potentials in diagnosis of children with amblyopia[J].China Mod Doct,2007,45(13):4- 5.
[7]Cleland G B,Crew ther D P.Normality of spatial resolution of retinal ganglion cells in cats with strabismic amblyopia[J].J Physiol,1982,326:235-49.
[8]杨崇清,马丽卿.视觉诱发电位在弱视发病机制研究中的应用[J].浙江医学,1999,21(10):636-7.
[8]Yang C Q,Ma L Q.The application of visual evoked potential in the study of amblyopia pathogenesis[J].Zhejiang Med,1999,21(10):636-7.
[9]Keyser S M.The induction of gene expression in mammalian cells by radiation[J].Sem Cancer Biol,1993,4(2):119-28.
[10]Kaczmarek L,Chaudhuri A.Sensory regulation of immediate-early gene expression in mammalian visual cortex:implications for functional mapping and neuralp lasticity[J].Brain Res Bev,1997,23(3):237-56.
[11]万旭英,罗 明,贺 平,吴孟超.苦参碱和氧化苦参碱体外对人肝癌细胞的诱导分化作用[J].中国药理学通报,2009,25(7):977-9.
[11]Wan X Y,Luo M,He P,Wu M C.Effect of matrine and oxymatrine on induction of differentiation of human hepatoma carcinoma cell linein vitro[J].Chin Pharmacol Bull,2009,25(7):977- 9.
[12]Zhang F,Halleux P,Arckens L,et al.Distribution of immediate early gene zif-268,c-fos,c-jun and jun-D mRNAs in the adult cat with special references to brain region related to vision[J].Neurosci Lett,1994,176(2):137- 41.
[13]Rosen K M,Mcormack M A,Villa-Komaroff L,Mower G D.Brief visual experience induces immediately early gene expression in the cat visual cortex[J].Proc Natal Acad Sci USA,1992,89(12):5437-41.
