P物质对哮喘大鼠神经内分泌功能的调节
2010-12-06薛德彬王月涵
董 榕,刘 悦,薛德彬,王月涵
(1.东南大学基础医学院生理学教研室,江苏南京 210009;2.浙江宁波戒毒研究所,3.浙江宁波第四人民医院,浙江宁波 315000)
哮喘是以气道高反应性和气流阻塞为特点的气道慢性炎症,其发病机制复杂,有多种炎性细胞、炎性因子参与[1,2]。目前引起气道炎症的机制主要有免疫源性炎症与神经源性炎性介质学说[3]。大量的细胞因子及气道感觉神经末梢释放的神经肽类递质都可以引起气道平滑肌收缩、腺体分泌等,导致气道高反应性。随着研究的深入,哮喘的发病并不仅仅表现为肺部独立器官的局部炎症,而是涉及中枢神经系统,构成以脑活动为主的神经内分泌免疫调节网络参与哮喘的发病过程[4]。P物质(substance P,SP)是广泛存在于神经系统中肽类递质,其在外周可作为神经源性炎症介质引起气道炎症,在脑内则广泛分布于30多个脑区。在大鼠延髓腹外侧区注入SP,则能引起大鼠呼吸幅度增加,呼吸频率减小。表明脑内SP能调控呼吸功能,但其对哮喘大鼠呼吸功能的调节作用报道甚少。故本实验观察脑内SP对哮喘活动的影响,并探讨其作用机制。
1 材料与方法
1.1 材料
1.1.1 试剂与器材 P物质与受体拮抗剂[D-pro2,D-Trp7.9]-SubstanceP(S0145),卵 蛋 白(Ovalbumin,OVA)均购自Sigma公司。Fos免疫组织化学试剂盒与SP放射免疫分析试剂盒购自北京中杉生物工程有限公司(进口分装)。促肾上腺皮质激素释放激素(corticotropin-releasing hormone,CRH)、促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)、皮质酮(corticosterone,CORT)放射免疫分析试剂盒购自美国DSL公司。Powerlab生物信号处理系统均购自澳大利亚AD Instruments pty Ltd公司。
1.1.2 动物与分组 健康♂成年SD大鼠,体重300~400 g,清洁级,由江苏省实验动物中心提供[合格证号:(苏)2008-0004]。大鼠随即分成两大组:(1)对照组:分为① 正常组(control,n=8),大鼠不行任何手术,在安静、温暖(18~25℃),避强光,昼夜光照节律(明暗周期为10/14)的实验室饲养,自由饮水和摄食;②假手术组(sham,n=8),大鼠在致敏吸入、静脉激发阶段及手术过程中仅进行操作,不涉及任何药物;③ 生理盐水组(NS,n=8),大鼠在致敏、吸入激发和静脉激发阶段均以NS代替卵蛋白混悬液,脑内PVN注射NS 1 μl。(2)哮喘模型组:① Fos检测组(OVA,n=8):哮喘模型大鼠行Fos免疫组织化学染色;② 模型对照组(OVA+NS,n=8):哮喘模型大鼠静脉注射OVA激发哮喘发作后,大鼠PVN内微量注射NS 1 μl;③SP组(OVA+SP,n=8):哮喘大鼠静脉注射OVA激发哮喘发作后,PVN 微量注射SP 8 μg(1 μl);④ S0145 组(OVA+S0145,n=8):哮喘大鼠 PVN 内注射 S0145 1 μg(1 μl),再静脉注射OVA激发哮喘发作;⑤ S0145+SP组(OVA+S0145+SP,n=8):哮喘大鼠静脉注射OVA激发哮喘发作后,PVN内先用S0145 1 μg预处理,然后再微量注射SP 8 μg。
1.2 方法
1.2.1 制备哮喘大鼠模型 实验d 1每只大鼠腹腔注射抗原致敏液1 ml,d 3再次腹腔注射抗原致敏液1 ml以强化,d 15~17用超声雾化器雾化吸入0.01 g·ml-1卵蛋白生理盐水溶液(2 ~3 ml·min-1,颗粒直径≤5 μm)20 min,每天 1 次,连续雾化3 d。大鼠出现烦躁不安、呼吸急促、用力呼吸、呼吸困难、喘息、腹肌明显收缩、咳嗽等哮喘症状。
1.2.2 PVN中枢立体定位术与核团微量注射 SD大鼠在戊巴比妥钠(30~40 mg·kg-1,ip)麻醉下,固定于脑立体定位仪上,按照George Paxinos and Charles Watson图谱,使切牙低于耳间线3.3 mm,以前囟为零点,PVN的坐标为 AP-1.8 mm,LR 0.2 mm,H-7.9 mm,在该处埋一外径为0.4 mm,带芯的不锈钢管作为注射引导管,用牙托水泥和502胶固定,用外径0.2 mm不锈钢管作为注射管,注射管尖端露出0.5 mm,在静脉注射OVA激发哮喘发作后,PVN内分别微量注射SP或SPR阻断剂S0145,生理盐水作为模型对照组(OVA+NS),实验中PVN内注射所用的 NS,SP,S0145均保持 pH:7.2~7.4,37℃,注射体积为 1 μl,注射速率为 1 μl·min-1,注射药物后留管20 min。
实验结束后,用相同给药法在原点注射等体积美蓝,常规切片后,对照大鼠脑立体定位图谱确定注射部位是否准确。定位不准者,数据不纳入统计。
1.2.3 放免法测定大鼠PVN内SP与正中隆起的CRH及血浆中ACTH与CORT含量 制备哮喘模型成功后(致敏后18 d),取大鼠下丘脑室旁核,匀浆离心后取上清,放入-70℃冰箱保存,待测SP,NS组与模型各组(除Fos组)大鼠均在每日上午8∶00开始实验,PVN处注射药物30 min后,每日定时取样:取正中隆起及尾静脉采血,离心取上清置入-70℃冰箱保存,待测 CRH、ACTH、CORT。上述各组大鼠中PVN中SP,与正中隆起中CRH与血浆中ACTH、CORT的含量检测均采用放射免疫分析方法,由东南大学放射免疫检测中心完成。
1.2.4 取材 大鼠经0.4%戊巴比妥钠(6 mg·kg-1,ip)麻醉后,用含 40 g·L-1多聚甲醛的 0.1 mol·L-1的PBS缓冲液常规经心脏灌流固定取材,后移入0.87 mol·L-1的蔗糖缓冲液中至标本沉降。恒冷箱冰冻连续冠状切片(片厚30 μm)。切片收集在盛有0.01 mol·L-1PBS的切片盒中,按试剂盒要求及步骤进行染色。
1.2.5 Fos免疫组织化学染色 切片入正常山羊血清封闭液,室温孵育20 min,勿洗。然后依次加入兔抗Fos血清(1∶300,Santa Cruz)室温孵育30 min,随后4℃孵育12 h,之后进入生物素标记的羊抗兔IgG及SAHRP,室温孵育2 h,各步骤间均用PBS充分洗涤。继之用DAB法室温呈色,显微镜下控制反应时间,终止显色后贴片,梯度乙醇脱水,二甲苯透明,中性树胶封片后镜下观察。阴性对照用PBS代替一抗,其它染色步骤同上。
1.2.6 免疫样阳性细胞计数 将待测切片置于连接计算机的显微镜下(×100),每张切片选取4个不同视野,用加拿大JD801图像分析系统观察计数,取该例动物各平面的平均数,即为该动物该核团的阳性细胞数,每组8个大鼠间再取平均值,即为该组大鼠该核团的免疫反应阳性细胞数。
1.2.7 肺功能测定 将麻醉大鼠连接呼吸流量换能器测定潮气量(tidal volume,VT)。将食管内压(intrapleural ppressure,IPP)代替胸内压(thoracic pressure,PTH)。将双铂金引导电极插入大鼠膈肌片内引导膈肌肌电活动。记录大鼠膈肌肌电,可准确记录大鼠呼吸运动情况以及测算呼气吸气时程比。呼吸流量、食管内压和膈肌肌电3种信号经PowerLab/400生物采集系统采集处理,得到以下指标:①膈肌肌电活动,包括膈肌放电频率(frequency diaphragmatic electric activity,FDEA)和膈肌放电积分幅值(integrated diaphragmatic electric activity,IDEA);② 呼吸功能,包括呼气/吸气时程(expiration time/inspiration time,TE/TI)。气道阻力(airway resistance,RAW)、肺顺应性(lung compliance,CL)、每分钟通气量(minute ventitation volume,MVV)。大鼠呼吸稳定后先连续记录30 min,注药后再连续记录60 min。
2 结果
2.1 哮喘急性发作时,大鼠下丘脑室旁核内Fos表达 光镜下观察哮喘时PVN内Fos蛋白的表达,正常组、假手术组和NS组大鼠PVN内均可见散在的Fos免疫反应阳性细胞分布,多为浅染,数量很少,且无密集分布区,组间无差别。哮喘发作后,PVN内Fos免疫反应阳性物质呈双侧分布,与正常组、假手术组和NS组的Fos表达数量在统计学上差异均有显著性(P<0.01,Fig 1)。所有Fos阴性对照切片上均呈阴性反应。

Fig 1 Fos-positive cells in PVN of asthmatic ratsA:Normal control group;B:Sham-operated group;C:NS control group;D:Asthma group.bar=50 μm
2.2 哮喘模型大鼠PVN内SP含量变化 利用放射免疫分析法发现,生理盐水对照组大鼠PVN内SP含量为(3.5±0.7)ng·g-1组织,哮喘模型组大鼠PVN内SP含量为(6.3±1.4)ng·g-1组织,表明哮喘发作时,大鼠下丘脑PVN内SP含量明显增多(P<0.01)。
2.3 哮喘模型大鼠PVN内PVN微量注射SP和(或)SPR 阻断剂 S0145、SP 对 CORT、ACTH、CRH含量的影响 利用放射免疫分析法测得哮喘模型大鼠下丘脑正中隆起内CRH,以及同一只动物的血液中ACTH与CORT均明显降低,表明哮喘时HPA轴功能明显下调,而SP组与模型对照组相比,血液中CORT及ACTH以及下丘脑正中隆起处CRH则进一步降低,而SP受体拮抗剂S0145组及S0145+SP组,CORT、ACTH与CRH含量均明显增加(P<0.05),表明SP受体拮抗剂可反转SP的作用,使HPA轴功能上调(Tab 1)。
Tab 1 Effects of microinjection SP or/and S0145 intoPVN on HPA axis in asthmatic rats( ± s,n=8)

Tab 1 Effects of microinjection SP or/and S0145 intoPVN on HPA axis in asthmatic rats( ± s,n=8)
**P<0.01 vs control group;△P<0.05,△△P<0.01 vs OVA+NS group;▲P<0.05 vs OVA+SP group
Group CORT/μg·L -1 ACTH/ng·L -1 CRH/μg·L -1 Control 159.6±11.1 110.5±14.1 1.80±0.15 OVA+NS 101.7±15.6** 78.2±8.8** 1.48±0.18**OVA+SP 78.2± 6.5△△ 64.4±6.6△ 1.20±0.11△△OVA+S0145 143.7±14.1△△ 98.9±12.7△△ 1.68±0.13△OVA+S0145+SP 97.5±11.2▲ 76.2±10.1▲ 1.46±0.20▲
2.4 哮喘发作时,PVN微量注射SP和(或)SPR阻断剂S0145对肺功能的影响 OVA+NS组与正常对照组比较,膈肌放电频率(FDEA)、呼气/吸气时程比和气道阻力增加;膈肌放电积分(IDEA)、每分钟肺通气量(MVV)、肺顺应性减小(P<0.01),表明哮喘大鼠具有肺通气功能障碍。OVA+SP组与OVA+NS组比较,肺通气障碍进一步增加,OVA+S0145组与OVA+NS组比较,反转了脑内SP对肺通气功能的影响。与正常对照组较为接近。OVA+S0145+SP组与OVA+NS组相比,各项肺功能指标差异均无显著性。而与OVA+SP组比较,膈肌放电频率(P<0.05)、呼/吸时程比(P<0.01)和气道阻力(P<0.01)减少,膈肌放电积分(P<0.01)增加(Tab 2)。
Tab 2Effect of microinjection SP and/or S0145 into Paraventricular nucleus(PVN)on pulmonary function in asthmatic rats(±s,n=8)
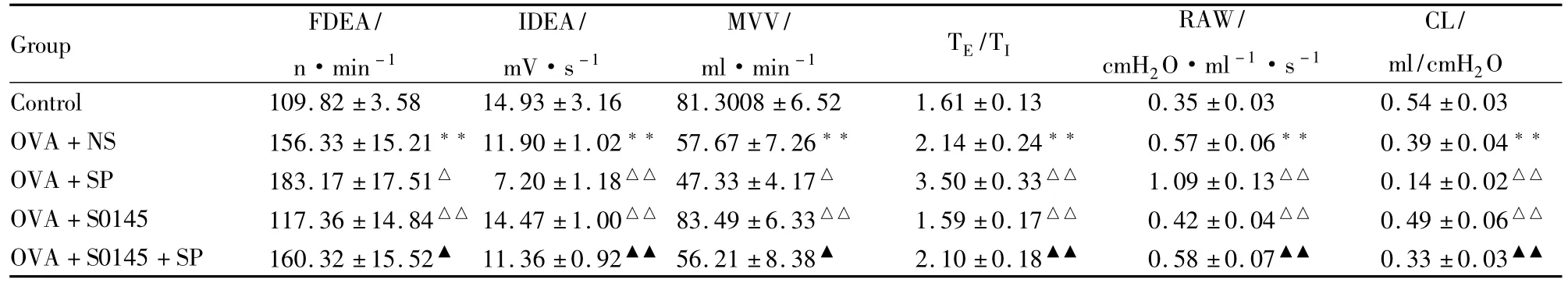
Tab 2Effect of microinjection SP and/or S0145 into Paraventricular nucleus(PVN)on pulmonary function in asthmatic rats(±s,n=8)
FDEA:Frequency diaphragmatic electric activity;IDEA:Integrated diaphragmatic electric activity;MVV:Minute ventilation volume;CL:Lung compliance;RAW:Airway resistance;TE/TI:Expiration time/Inspiration time.**P<0.01 vs control group;△P<0.05,△△P<0.01 vs OVA+NS group;▲P<0.05,▲▲P<0.01 vs OVA+SP group
Group FDEA/n·min-1 IDEA/mV·s-1 MVV/ml·min -1 TE/TI RAW/cmH2O·ml-1·s-1 CL/ml/cmH2O Control 109.82±3.58 14.93±3.16 81.3008±6.52 1.61±0.13 0.35±0.03 0.54±0.03 OVA+NS 156.33±15.21**11.90±1.02**57.67±7.26** 2.14±0.24** 0.57±0.06** 0.39±0.04**OVA+SP 183.17±17.51△ 7.20±1.18△△ 47.33±4.17△ 3.50±0.33△△ 1.09±0.13△△ 0.14±0.02△△OVA+S0145 117.36±14.84△△ 14.47±1.00△△ 83.49±6.33△△ 1.59±0.17△△ 0.42±0.04△△ 0.49±0.06△△OVA+S0145+SP 160.32±15.52▲ 11.36±0.92▲▲ 56.21±8.38▲ 2.10±0.18▲▲ 0.58±0.07▲▲ 0.33±0.03▲▲
3 讨论
P物质是由非肾上腺素能非胆碱能神经末梢所释放的一种神经肽,作为一种最早发现的神经肽,除了在疼痛感觉上传至相应脑区的传递过程中起重要作用外[5],还具有调控血压、呼吸、消化等多种生理功能。Mazzone等[6]研究发现在正常大鼠延髓孤束核区微量注射SP可引起潮气量增加,呼吸频率不变,神经解剖学研究亦发现,从延髓、脑桥有关呼吸调控的基本中枢,至下丘脑、皮层的高级整合中枢,由下至上的呼吸调控的机体结构中均含有SP及其受体的分布,提示中枢内SP与机体呼吸活动密切相关。本实验中利用免疫组织化学实验证实哮喘发作时,大鼠下丘脑室旁核神经元活动增强;电生理实验亦证实,哮喘发生时,利用玻璃微电极引导大鼠室旁核神经元单位放电明显增加(文章待发表);形态学与功能学的实验结果均表明PVN的兴奋与哮喘的发生密切相关。在外周组织中的气管、支气管和支配于肺的感觉c-纤维神经末梢,SP则作为一种神经源性炎症介质收缩气道平滑肌,增加微血管通透性,激活炎性细胞,引起哮喘气道的神经源性炎症的发生。放射免疫分析法检测在哮喘发生时PVN内SP含量明显升高,给予SP受体拮抗剂后,哮喘症状明显减轻,而给予外源性SP时,哮喘症状则进一步恶化,提示作为调控内脏功能的高级整合中枢,下丘脑室旁核内SP递质参与哮喘的发生发展。近年来有关哮喘的研究发现:外周的免疫源性炎性改变在脑组织内也同样发生,即脑内也出现了与外周同样的细胞因子改变[7],那么PVN内SP的变化也可能提示外周的神经源性炎症改变也在脑内出现,引起了脑内炎性反应,可称之为中枢致敏状态。室旁核与延髓呼吸调控中枢有密切的往返联系,哮喘发生时,室旁核内神经元兴奋,冲动可经延髓呼吸基本中枢反射性地调控外周气道的高反应性,影响哮喘的发生发展过程。
哮喘属于应激反应,机体可通过HPA轴分泌激素,来调节并完成对应激的适应。本实验中,采用同一种检测方法(放免法)在同一个体上检测了下丘脑-垂体-肾上腺皮质3个平面的激素分泌情况,并使动物在安静、避强光、明暗周期10/14,温度18~25℃,定时定量喂养的实验环境条件下,每天定时取血与组织,尽量排除了影响HPA轴活动的干扰因素,保证结果可信度。大多数应激伴有HPA轴的激活,糖皮质激素的增加,而在本实验中则可见哮喘发生时HPA轴受到抑制,临床上亦可见到哮喘病人肾上腺皮质功能低下的这类现象,但机制不清。故以激素治疗哮喘是普遍实施的治疗方法[8]。下丘脑室旁核是神经内分泌免疫网络调节的高级整合中枢,HPA轴的活动是神经内分泌的典型代表,Jeppop等[9]曾报道大鼠脑内SP可通过抑制HPA轴活动引起外周血中ACTH与CORT含量下降,而在下丘脑室旁核与正中隆起处均有SP及其受体分布,在哮喘发生时,随着PVN内SP含量增加,HPA轴功能下调导致ACTH与CORT血中浓度下降,抗炎作用减弱,哮喘症状进一步恶化,而给予SP受体拮抗剂预先干预后,上调了HPA轴活动,随着CRH-ACTH-CORT的激素水平升高,哮喘症状亦随之明显好转,表明哮喘大鼠下丘脑室旁核内肽类递质SP不仅可以通过延髓等脑区反射地调控气道与肺的活动,也可通过调控HPA轴活动来影响外周气道高反应性。SP作用于PVN内合成CRH的神经内分泌细胞,抑制CRH的合成与分泌[10],引起下游激素 ACTH与CORT合成分泌减少,导致CORT的抗炎作用减弱,加重哮喘。因此下丘脑室旁核内SP通过调控神经内分泌系统来影响气道炎症反应可能是哮喘病理发生过程中的一种重要环节。
[1]郑吉善,李昌崇,陈庆武,等.卡介菌多糖核酸对哮喘小鼠胸腺活化调节趋化因子及mRNA表达的影响[J].中国药理学通报,2007,23(5):666-71.
[2]Zheng J S,Li C C,Chen Q W,et al.Effects of BCG-PSN on the expression of thymus and activation-regulated chemokine and mRNA in a murine model of allergic asthma[J].Chin Pharmacol Bull,2007,23(5):666-71.
[3]封 瑞,李 智,滕 赞,曹 禹.哮喘豚鼠气道平滑肌细胞内钙释放通道的变化[J].中国药理学通报,2007,23(1):47-51.
[3]Feng R,Li Z,Teng Z,Cao Y.Altered intracellular Ca2+channel function of cultured asthmatic guinea pig airway smooth muscle cells[J].Chin Pharmacol Bull,2007,23(1):47-51.
[4]Barnes P J.Neurogenic inflammation in the airways[J].Respir Physiol,2001,125(1-2):145-54.
[4]Marshall G D.Neuroendocrine mechanisms of immune dysregulation:application to allergy and asthma[J].Ann Allergy Asthma Immunol,2004,93(2S1):S11-7.
[5]鲁显福,耿晓娟,张励才,曾因明.鞘内注射左旋布比卡因下调甲醛炎性痛大鼠远位触液神经元P物质的表达[J].中国药理学通报,2008,24(2):191-6.
[5]Lu X F,Geng X J,Zhang L C,Zeng Y M.Intrathecal levobupivacaine downregulates substance P expression in the distal cerebrospinal fluid contacting neuron for forma lin-induced inflammatory pain in rats[J].Chin Pharmacol Bull,2008,24(2):191-6.
[6]Mazzone S B,Geraghty D P.Respiratory actions of tachykinins in the nucleus of the solitary tract:characterization of receptors using selective agonists and antagonists[J].Br J Pharmacol,2000,129(6):1121-31.
[7]Mazzone S B,Canning B J.Central nervous system control of the airways:pharmacological implications[J].Curr Opin Pharmacol,2002,2(3):220-8.
[8]齐金萍,王巧玲,金 韵,胡 颖.地塞米松抑制哮喘小鼠SH2-Bβ 蛋白表达[J].中国药理学通报,2008,24(11):1501-4.
[8]Qi J P,Wang Q L,Jin Y,Hu Y.The inhibitory effect of dexamethasone on the expression of SH2-Bβ protein in a murine model of asthma[J].Chin Pharmacol Bull,2008,24(11):1501-4.
[9]Jessop D S,Renshaw D,Larsen P J,et al.Substance P is involved in terminating the hypothalamo-pituitary-adrenal axis response to acute stress through centrally located neurokinin-1 receptors[J].Stress,2000,3(3):209- 20.
[10]Chowdrey H S,Larsen P J,Harbuz M S,et al.Endogenous substance P inhibits the expression of corticotropin-releasing hormone during a chronic inflammatory stress[J].Life Sci,1995,57(22):2021-9.
