射干麻黄汤对哮喘大鼠气道炎症及外周血Th1/Th2平衡的影响
2010-12-03王长海魏亚强
赵 红 王长海 魏亚强
第四军医大学西京医院(西安 710032)
哮喘的本质是气道炎症,各种嗜酸性粒细胞、T淋巴细胞、单核细胞、中性粒细胞等免疫相关细胞反常聚集和激活参与了支气管哮喘的调节。此外,许多研究已证实T1亚群细胞/T2亚群细胞(Th1/Th2)平衡失调,Th2细胞活化亢进在哮喘发病机制中发挥重要作用[1]。
大量临床研究表明,中药射干麻黄汤治疗支气管哮喘疗效确切,具有远期疗效稳定、不良反应少、毒副作用罕见等特点。但对其作用机制的研究甚少。本实验通过观察射干麻黄汤对哮喘大鼠支气管肺泡灌洗液(BALF)中炎症细胞、白细胞介素4(IL-4)和γ-干扰素(IFN-γ)/IL-4比率的影响,探讨其对控制哮喘气道炎症和Th1/Th2细胞亚群失衡的影响,揭示其治疗支气管哮喘的作用机制。
1 材料与方法
1.1 材料 (1)动物:选取6周龄清洁级SD大鼠40只,雌性,体质量(180±20)g,由第四军医大学实验动物中心提供,许可证号:SCXK(军)2007-007。(2)药物及试剂:卵蛋白干粉由美国Sigma公司生产;地塞米松片(0.75mg/片),由上海信宜制药股份有限公司生产,批号020401;射干麻黄汤(射干9g,麻黄12g,半夏 12g,紫菀 9g,款冬花 9g,大枣 12g,细辛 3g,生姜 12g,五味子12g)组方药材由第四军医大学西京医院中药房提供;大鼠IL-4 ELISA试剂盒、IFN-γ ELISA试剂盒由北京晶美生物工程有限公司生产。(3)主要仪器:402型超声雾化器由上海四菱医疗器械厂生产;美国Beckman J 2型低温高速离心机。
1.2 方法 (1)造模:按文献[2]方法操作。实验用雌性大鼠40只适应性饲养1周后,随机分为正常对照组、哮喘组、地塞米松组和射干麻黄汤组,每组10只。除正常组外,第0、7天于大鼠腹腔注射1mL的抗原液 (含卵蛋白100mg、氢氧化铝干粉100mg、灭活百日咳杆菌5×109个)致敏,第7~21日用超声雾化器给大鼠雾化吸入10g/L卵蛋白生理盐水悬液,30min/d,至出现烦躁不安、呼吸急促、腹肌抽搐、挠鼻等哮喘发作表现。正常对照组:按哮喘组方法,用生理盐水代替卵蛋白雾化吸入与腹腔注射。地塞米松组:自造模第1日起灌服地塞米松,剂量为1mg/(kg·d)。射干麻黄汤治疗组:自造模第1日起,每日灌服射干麻黄汤剂20g/(kg·d),生药含量2g/mL,每日1次,各组均连续用药7d。(2)BALF收集:按文献[3]方法操作。造模及相应处理完成后24h,乌拉坦腹腔注射麻醉(1.5g/kg),结扎右肺门根部,行气管插管,4mL生理盐水缓慢注入肺内,轻轻按摩肺组织30s,缓慢回抽,回收BALF,反复3次,回收率大于90%。取摇匀的BALF少许滴于细胞计数板上,光镜下计数细胞总数,然后将BALF离心(1000r/min离心10min),取适量沉渣制备细胞涂片,采用瑞氏染色法染色,油镜下计数200个细胞并分类。(3)血浆标本的采集:从颈动脉取血3mL,加肝素钠抗凝,静置2h后,2000r/min离心15min,提取血浆保存于-20℃冰箱待测细胞因子。(4)细胞因子检测:采用酶联免疫吸附法行IL-4及IFN-γ水平检测,严格按试剂盒说明进行。
1.3 统计学处理 应用SPSS 12.0统计软件,计数资料以()表示。采用 t检验、Dunnett检验和S-N-K法检验。
2 结果
2.1 各组一般情况观察 见表1。

表1 各组大鼠一般情况变化
2.2 各组BALF中炎症细胞的比较 见表2。哮喘组大鼠细胞总数、嗜酸性粒细胞、中性粒细胞、淋巴细胞计数均显著高于正常对照组 (P<0.01),2个治疗组细胞总数及各炎症细胞数较哮喘组明显减少(P<0.01)。地塞米松组嗜酸性粒细胞、淋巴细胞数显著低于射干麻黄汤组(P<0.05),2个治疗组间细胞总数中性粒细胞数的差异无统计学意义(P>0.05)。
表2 各组BALF中炎症细胞的变化 (×106/L,)

表2 各组BALF中炎症细胞的变化 (×106/L,)
组 别正常对照组哮喘组地塞米松组射干麻黄汤组n 10 10 10 10细胞总数20.50±4.14 32.50±6.02*10.00±2.83△21.10±3.35△嗜酸性粒细胞0.40±0.20 3.94±0.53*1.71±0.54△2.25 ±0.68△▲中性粒细胞1.53±0.44 8.46±1.11*4.43±0.78△5.37±1.16△淋巴细胞1.32±0.43 8.05±1.07*2.76±0.91△3.66 ±0.68△▲
2.3 各组大鼠细胞因子水平的比较 见表3。哮喘组大鼠较正常组血清中IL-4明显增加(P<0.01),2个治疗组大鼠较哮喘组血清中IL-4明显减少(P<0.01),射干麻黄汤组与地塞米松组血清中IL-4相近(P>0.05)。哮喘组大鼠IFN-γ/IL-4较正常组明显减少(P<0.01),2个治疗组大鼠较哮喘组大鼠血清中IFN-γ/IL-4明显增加(P <0.01);射干麻黄汤组与地塞米松组血清中IFN-γ/IL-4相近(P>0.05)。
表3 各组外周血IL-4及IFN-γ/IL-4比较 (pg/mL,)
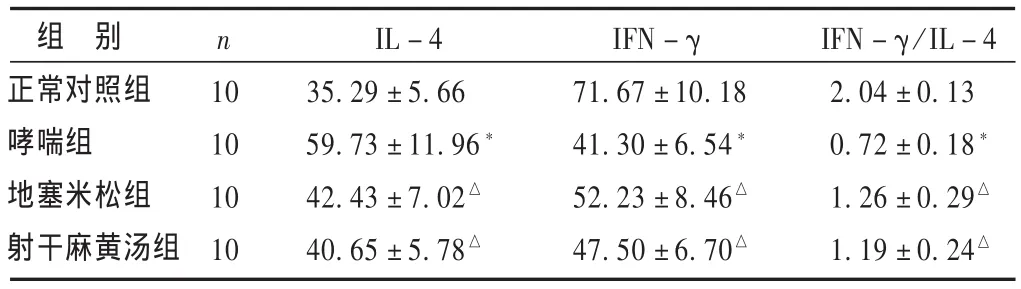
表3 各组外周血IL-4及IFN-γ/IL-4比较 (pg/mL,)
组 别正常对照组哮喘组地塞米松组射干麻黄汤组n 10 10 10 10 IL-4 35.29±5.66 59.73±11.96*42.43±7.02△40.65±5.78△IFN-γ 71.67±10.18 41.30±6.54*52.23±8.46△47.50±6.70△IFN-γ/IL-4 2.04±0.13 0.72±0.18*1.26±0.29△1.19±0.24△
3 讨论
支气管哮喘是由气道免疫相关细胞的反常活化和聚集以及T淋巴细胞、嗜酸性粒细胞、单核细胞等细胞的功能障碍为特点的慢性气道炎症性疾病。气道慢性炎症与气道高反应性密切相关,其不但可导致气短、声嘶、胸闷等症状,也决定了哮喘的严重程度。此外,研究表明,Th1/Th2免疫平衡决定机体对疾病的易感性,是哮喘发病和持续存在的主要免疫学基础。当Th2细胞反应占主导时,Th1/Th2平衡发生改变,并在哮喘气道炎症细胞的趋化、成熟、存活过程中起着重要作用。因此,抑制Th2型反应、增强Th1型反应被认为对哮喘的发病起防治作用[4]。
CD+4T淋巴细胞根据所分泌的细胞因子不同分为Th1和Th2两个亚群,不同亚群执行着不同的免疫功能。Th1分泌IFN-γ、IL-2、TNF-α和 TNF-β,介导细胞免疫应答。Th1通过增加细胞因子、趋化因子和黏附分子的表达,激活巨噬细胞,使炎症细胞募集增多并且可以通过多种途径扩增免疫反应,包括在抗原呈递细胞和内皮细胞上增加MHCⅠ和MHCⅡ分子水平。当感染中遇到较大的病原体而不被吞噬时,Th2细胞被激活。Th2主要产生 IL-4、IL-5、IL-10和 IL-13,介导体液免疫应答及Ⅰ型变态反应,在哮喘等过敏性炎症的发生发展中起重要作用[5]。事实上,免疫系统应对环境因素的反应,可以直接或间接影响CD+4T分化成Th1或Th2细胞,从而产生自身免疫性疾病和过敏。
IFN-γ、IL-4分别是Th1和Th2细胞的特征性细胞因子,二者在哮喘发病中从正反两方面控制CD+4T细胞的分化和功能[6]。IFN-γ由Th1细胞分泌,可以诱导CD+4T细胞分化为Th1细胞,还可以抑制Th2细胞的分化。另一方面,由Th2细胞分泌的IL-4可以诱导CD+4T细胞分化为Th2细胞,还可以抑制Th1细胞的功能。当Th2细胞反应占主导时,Th1/Th2平衡发生改变,引起各种过敏性疾病。对此方面的研究已成为哮喘免疫治疗的热点之一[7,8]。
本研究发现,哮喘大鼠BALF中嗜酸性粒细胞计数增多,提示发生了以嗜酸性粒细胞浸润为主的气道炎症,经灌服射干麻黄汤及地塞米松后,大鼠BALF中嗜酸性粒细胞、中性粒细胞、淋巴细胞较哮喘组明显减少,说明射干麻黄汤和地塞米松组均有抑制气道炎症作用,但与地塞米松比较,射干麻黄汤对嗜酸性粒细胞、淋巴细胞的作用较低。对外周血中IFN-γ、IL-4水平监测发现,哮喘大鼠BALF中IFN-γ蛋白水平明显下调,IL-4蛋白水平明显上调,表现出明显的Th2细胞因子分泌亢进和Th1细胞因子减少,再次证实哮喘中Th1/Th2的免疫失衡,Th2细胞活化亢进的存在。在灌服射干麻黄汤及地塞米松后发现IL-4水平下调,IFN-γ/IL-4明显增加,使IFN-γ/IL-4比例得以逆转,这与Deng等[9]在大鼠中观察到的现象相似。说明射干麻黄汤与地塞米松均可抑制Th2活化,影响Th1/Th2水平,且射干麻黄汤与地塞米松作用相当。
射干麻黄汤出自汉代张仲景《金匮要略》,由射干、麻黄、款冬花、细辛、紫菀、半夏、五味子、大枣、生姜等组成,可“宣肺散寒,化饮止咳,治外感风寒,痰饮上逆,咳而上气,喉中有水鸣声”。方中麻黄宣肺散寒,射干开结消痰,并为君药;生姜散寒行水,半夏降逆化饮,共为臣药;紫菀、款冬花温润除痰,下气止咳,五味子收敛耗散之肺气,均为佐药;大枣益脾养胃,为使药。诸药相配,融解表、温肺、利气、开痰于一方以分解病邪,共奏温肺散寒、化痰平喘之功。
综上所述,本实验通过射干麻黄汤干预哮喘大鼠模型,证实了射干麻黄汤可以缓解气道炎症,调节Th1/Th2的免疫失衡,抑制Th2细胞活化,这可能是其治疗支气管哮喘的作用机制之一,提示射干麻黄汤在治疗哮喘方面具有良好的应用前景。
[1]Ngoc PL,Gold DR,Tzianabos AO,et al.Cytokines,allergy,and asthma[J].Curr Opin Allergy Clin Immunol,2005,5(2):161 ~ 166.
[2]吕国平.介绍一种建立大鼠哮喘模型的实验方法 [J].中华结核病和呼吸杂志,1995,18(6):271 -281.
[3]李洧,叶茜.白细胞介素17抗体对哮喘大鼠中性粒细胞的影响[J]. 山东大学学报(医学版),2009,47(3):43 ~ 47.
[4]Leath TM,Singla M,Peters SP.Novel and emerging therapies for asthma[J].Drug Discov Today,2005,10(23/24):1647 ~ 1655.
[5]Yamagata T,Ichinose M.Agents against cytokine synthesis or receptors [J].Eur J Pharm acol,2006,533:289~301.
[6]Liu L,Jarjour NN,Busse WW,et al.Enhanced generation of helper T type 1 and 2 chemokinesin allergen induced asthma[J].Am J Resp ir Crit Care Med,2004,169(10):1118.
[7]Bisset LR,Schmid-Grendelmeier P.Chemokines and their receptors in the pathogenesis of allergic asthma:progress and perspective[J].Curr Opin Pulm Med,2005,11(1):35 ~ 42.
[8]Gibbons FK,Israel E,Deykin A,et al.The combined effects of zafirlukast, prednisone, and inhaled budesonide on IL -13 and IFNgamma secretion[J].J Clin Immunol,2005,25(5):437 ~ 444.
[9]Deng YM,Xie QM,Zhang SJ,et al.Changes of 5-lipoxygenase pathway and proin flammatory mediators in cerebral cortex and lung tissue of sensitized rats[J].Acta Pharmacol Sinica,2005,26(3):353 ~358.
