多囊肾病发病机制和治疗
2010-11-26许书添综述姚小丹审校
许书添 综述 姚小丹 审校
多囊肾病(polycystic kidney disease,PKD)是人类常见的单基因遗传性疾病之一。PKD按遗传方式可分为常染色体显性多囊肾病(autosomal dominant polycystic kidney disease,ADPKD)和常染色体隐性多囊肾病(autosomal recessive polycystic kidney disease,ARPKD),其发病率分别为 1/400~1/1 000和 1/10 000~1/40 000。ADPKD的主要病理特征为双肾出现许多大小不等的液性囊泡,囊肿进行性长大,破坏肾脏结构和功能,最终导致终末期肾病(ESRD)[1](图1)。ADPKD除累及肾脏外,还可引起肝脏囊肿、胰腺囊肿、心瓣膜病、结肠憩室和颅内动脉瘤等肾外病变。ARPKD的病理特征为双侧肾脏明显增大,肾内有放射状排列的梭形囊肿,伴胆小管细胞增殖、门脉区扩大、纤维化,患者常在婴幼儿期即死亡,少数能存活至成年。目前已经明确ADPKD的致病基因有 pkd1和 pkd2,分别编码多囊蛋白 1(polycystin 1,PC1)和多囊蛋白 2(PC2)。ARPKD的致病基因为 PKHD1,其编码蛋白为Polyductin。研究发现,这三种基因编码的蛋白在PKD发病机制中起着重要作用,且均位于肾小管上皮细胞的初级纤毛内,提示 PKD是纤毛结构和功能异常引起的肾小管上皮细胞的一类纤毛相关疾病。现将 PKD的发病机制和治疗的最新研究作一简要的概述。
初级纤毛
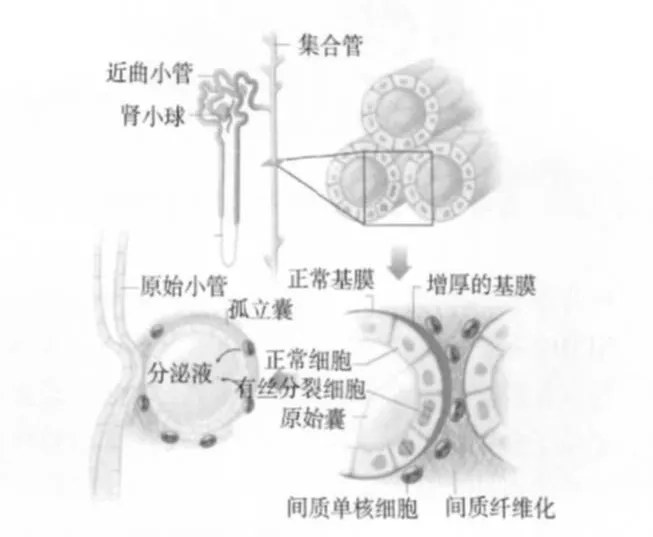
图1 常染色体显性多囊肾病囊肿生长模式图[3]
ADPKD和 ARPKD均源自于初级纤毛结构和功能异常的一类疾病[2]。纤毛大多数位于细胞表面呈细长的管状结构,其基底部称基体。按结构和功能分为初级纤毛(primary cilia)和运动纤毛(motile cilia)两种,具有运动和感知外界信号的功能。纤毛的基本结构包括轴丝(由微管组成的细胞骨架)和外被的纤毛膜。纤毛膜与胞质膜在结构上是延续的,含有多种特异性受体、离子通道及信号转导蛋白。根据微管组成及排列方式的不同,哺乳动物的轴丝主要有 9+2和 9+0两种类型,后者被称为初级纤毛。肾组织的初级纤毛位于上皮细胞的顶端表面构成肾小管组成部分(图2)。初级纤毛伸入管腔内,与尿液直接接触,其功能是作为机械感受器来感受尿流刺激。尿液流过小管上皮细胞顶端表面,机械刺激初级纤毛,产生化学信号,导致细胞内钙离子内流增加,进而调节细胞周期和分裂。Pazour等[4]2000年报道 Tg737突变的小鼠除了初级纤毛显著短于正常外,还出现类似于 PKD的肾囊肿表型。Tg737基因完全缺失的小鼠出生后不久即死于 PKD。该研究首次发现初级纤毛在维持肾脏形态和功能中起着关键性作用,初级纤毛装配的缺陷可导致 PKD。此后的研究进一步证实纤毛在维持多囊蛋白(PC)正常功能中起重要作用,任何引起纤毛功能缺陷的基因突变都会导致 PKD。
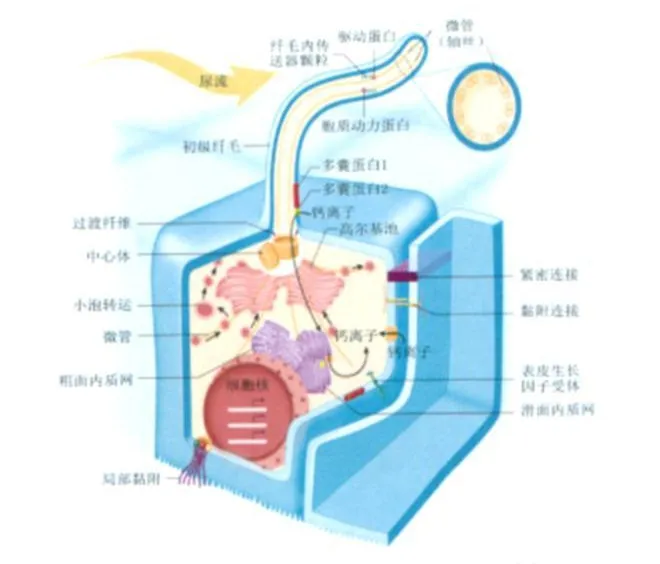
图2 肾小管上皮细胞初级纤毛模式图[5]
目前依据三点证实 PKD是由于纤毛疾病或初级纤毛结构和功能异常引起的疾病。首先,其他囊性肾脏疾病如青少年肾消耗病(nephronophthisis,NPHP)和巴-比二氏综合征(Bardet-Biedl syndrome)均存在着 PC1、PC2和fibrocystin的突变,而这些蛋白正位于初级纤毛[6]。其次,pkd1发生突变的初级纤毛功能紊乱可导致尿流刺激后钙离子内流障碍。通过抗体封闭 PC2和 fibrocystin可治疗野生型细胞,其原因在抑制尿流依赖性钙离子浓度增加[7]。以上研究表明 PC1、PC2和 fibrocystin均具与钙离子偶联的机械感受器功能。最后,纤毛合成的基因(Kif3a和 Ift88)失活致使初级纤毛丢失,最终导致PKD[8,9]。然而,异常的初级纤毛为何导致 PKD的分子机制仍不清楚。但已发现初级纤毛可调节钙离子内流、Wnt/β-catenin和 cAMP信号传导途径及细胞极性[10]。
细胞极性和 PKD
细胞极性(planar cell polarity,PCP)指垂直于顶端和基底轴的组织平面的细胞立体结构[11]。PCP最早在果蝇身上发现。基因突变可以干扰 PCP。PCP第一条信号途径,即所谓的核心 PCP途径,包括膜蛋白 frizzled,strabismus/van gogh和 flamingo/starry night和胞浆蛋白 dishevelled(Dsh),prickle和diego。PCP信号途径可产生含 frizzled、DSH和diego蛋白复合体以及含 strabismus和 prickle的复合体。这两个蛋白复合体在功能上相互对抗,但在细胞中分布不均匀[12]。PCP第二条信号传导途径包括两个原钙黏附蛋白、fat和 dachsous和另一条跨膜蛋白four-jointed和转录阻抑物 atrophin。PCP可调节胚胎期细胞转移、定位和分化方向以及形态形成。例如,PCP参与躯干伸长和神经管形成。一旦此过程出现缺陷则可致躯干变短和神经管闭锁。哺乳动物内耳中毛细胞分布于耳蜗管壁中。一旦内耳毛细胞PCP结构紊乱则产生立体感觉的缺失和耳聋。
肾小管上皮 PCP,以其细胞膜表面出现的两个不同的功能域(基膜区和顶膜区)为特征,以紧密连接为界线。小管上皮 PCP是小管吸收、分泌排泄和交换等功能的基础。如位于基膜的 Na-K ATP酶。此外,PCP的形成和维持有赖于细胞与细胞、细胞与基质之间接触的建立,及某特殊结构所决定,如细胞骨架、连接复合体和局部粘附,其中细胞骨架起决定作用。这些结构一旦发生改变,将导致 PCP的改变,进而引起细胞和器官功能紊乱。PKD就是一个由 PCP异常所致疾病的典型例子。PKD伴有明显的上皮 PCP异常,包括 Na-K ATP酶、表皮生长因子(EGF)受体易位至顶膜区,从而导致钠离子分泌增多和上皮细胞异常增生。
Fischer等[13]首次报道 PCP异常和 PKD有密切联系。他们在大鼠动物模型 PCK肾脏和特异性HNF-1β转录因子失活的小鼠肾脏中研究细胞分化方向,其实,这是 PCP的表现形式。他们采用谱系追踪和分裂细胞染色的方法,发现野生型肾小管细胞可沿轴向分布,且基本与肾小管平行。结论是细胞分化导致肾小管的延伸而肾小管直径并未发生变化。但在 PCK大鼠的囊性小管和 HNF-1β敲除的小鼠中,细胞分化的方向是随机的。以上结果表明早期囊肿形成存在 PCP异常。
此外,缺乏 Fat 4小鼠的研究进一步支持 PKD发病与 PCP异常有关。例如在耳蜗功能紊乱的静纤毛和神经管缺陷病中,敲除 Fat 4基因小鼠动物模型具有典型 PCP的基因型[14]。然而,Fat 4突变致使肾小管细胞分化出现随机性而最终发生 PKD。
初级纤毛和 PCP
PKD中 PCP缺陷可能与初级纤毛有关。耳蜗中纤毛基因的缺失产生静纤毛结构紊乱,预示着初级纤毛对于维持内耳 PCP具有重要作用。为证明初级纤毛具有调节 PCP的功能,有研究测量 Kif 3a基因缺陷的小鼠集合管细胞分化的方向,发现Kif 3a的失活会使肾囊肿形成前初级纤毛丢失[15]。在缺少初级纤毛的囊肿形成之前,肾小管上皮细胞分化的方向是随机的,这意味着 PCP发生异常。另一纤毛形成缺陷基因 Ift 20在集合小管细胞中失活也有类似的结果[16]。上述结论表明初级纤毛异常影响PCP功能并最终发生 PKD。
目前仍不知为何初级纤毛可调节 PCP。推测可能与Wnt信号传导途径有关。Wnt是一组参与生长和发育的糖蛋白。Wnt与细胞表面的frizzled受体结合,聚集和激活 Dsh,最终可通过两种途径传递信号:权威途径(β-catenin依赖)和非权威途径(非 βcatenin依赖)。非权威 Wnt信号通路研究表明 PCP的形成在多种微生物包括哺乳动物中起着重要作用。肾脏中初级纤毛缺失可激活 β-catenin依赖的信号通路,这是因为 β-catenin蛋白和下游中靶基因(c-Myc)表达增加。Corbit等[17]证实初级纤毛缺如可使权威 Wnt信号的传递失活。NPHPII型的囊性肾病中纤毛突变蛋白 inversin也参与其中[18,19]。inversin与 Dsh相互作用并使其降解,Dsh可以抑制权威 Wnt信号传递。这些研究表明 inversin可作为调节下游权威 Wnt信号传递途径并作为刺激 PCP信号传递的关键点。最近报道多种 PKD的突变蛋白在限制 Wnt信号和(或)促进 PCP信号传递中起关键性作用[17,20]。尽管 Fat 4位于 MDCK肾脏上皮细胞的纤毛上,但初级纤毛的丢失同样可以通过Fat/Dachsous途径来干扰 PCP的调节[14]。
囊肿形成与肾小管生长和修复有关
纤毛基因(如 Kif 3a和 pkd1)失活可使小鼠肾囊肿快速生长,可用于研究出生后肾脏纤毛基因的作用。因此,Cre/lox P重组基因的转基因小鼠可通过药物(如它莫昔芬)诱导产生,并与携带 lox P位点的基因交配。如果药物不起效,基因将激活;若药物起效,基因将失活。一旦 Kif 3a基因失活,出生后两周内,肾囊肿可快速生长。成年小鼠 Kif 3a基因的失活,6月内才形成囊肿。尽管成年小鼠纤毛也丢失,但 Kif 3a基因失活后,肾囊肿并未迅速产生[11,17,21]。处于发育阶段和成熟阶段的肾脏,二者最大区别就是细胞增殖速度。新生小鼠肾脏细胞增殖快,出生 10d后则增殖减慢。细胞增殖减慢与 Kif 3a基因失活的年龄密切相关,而缺乏肾纤毛的小鼠囊肿形成与细胞快速增殖有关。尽管细胞快速增殖可促进定向细胞分化异常肾小管的扩张,但此结果与异常 PCP在囊肿形成中的作用是一致的。
Piontek等[21]采用靶向诱导基因灭活另一纤毛蛋白 Pkd1。与灭活 Kif 3a相似,出生后早期 pkd1的失活,肾囊肿生长快速,而成年小鼠 Pkd1基因的失活,肾囊肿生长缓慢。14d前肾脏呈胚胎形态,14d后成年基因开始表达。总之,以上研究结论表明伴随细胞快速增殖和(或)细胞分化缺失的纤毛基因失活是肾囊肿快速生长的主要原因。
为验证刺激细胞增殖是否亦促进囊肿的形成及急性肾损伤(acute kidney injury,AKI)是否可造成敲除Kif 3a基因的成年小鼠肾纤毛的丢失。AKI发生后存活的上皮细胞可再次进入细胞周期并通过细胞增殖来修复肾小管。因此,假如敲除 Kif 3a基因的小鼠依赖细胞增殖,AKI则会促使囊肿形成。敲除 Kif 3a基因成年小鼠肾脏一旦经历缺血-再灌注损伤,肾囊肿的生长则加速[17]。以上发现证实上述假说伴随细胞的快速增殖的纤毛基因的功能紊乱促使囊肿形成。尽管 AKI与肾小管上皮细胞的去分化密切相关,然而这并不能排除在囊肿形成缺乏细胞分化。
AKI可刺激 PKD动物模型产生囊肿。肿瘤坏死因子 α(TNF-α)可诱导 AKI或感染的发生,亦可刺激成年Pkd2+/-杂合小鼠产生囊肿[22]。成年PKD囊肿的生长还受其他环境因素的影响,如亚临床肾损伤、肾感染或毒物接触。成熟肾脏的纤毛蛋白可在 AKI时进行修复以维持组织的稳态结构。因此可推测发育中的肾脏纤毛蛋白可维持 PCP并在肾修复时调整肾小管直径大小。
PKD的治疗
迄今,PKD仍无特效的治疗方法。主要治疗措施是控制并发症,延缓疾病进展。对症支持治疗包括止痛、控制囊肿感染、预防结石形成、控制高血压和避免咖啡因和雌激素等。PKD的基因治疗尚处试验阶段。这些药物主要针对细胞增殖失调、细胞分化、凋亡和囊液分泌异常以及异常细胞信号传递途径。下面将概括临床前期的部分研究结果(表1)。
V2受体拮抗剂 PKD大鼠的血管加压素水平升高。这与 PKD囊肿均源于集合小管,且集合小管上皮细胞均表达有 V2受体有关。血管加压素与V2受体结合激活腺苷酸环化酶导致 cAMP水平增加。cAMP通过刺激囊液分泌和增殖囊肿上皮细胞来促进囊肿形成(图3)。V2受体拮抗剂OPC-31260临床前期研究表明:不论 ARPKD(PCK大鼠)、ADPKD(Pkd2WS25/-),还是青少年肾消耗病(pcy小鼠)的动物模型,它都能明显抑制囊肿生长,其评估手段包括肾脏体积、囊肿体积、分裂和凋亡指数以及 BUN水平。托伐普坦为另一高亲和力 V2受体的拮抗剂,在治疗 ARPKD、ADPKD和青少年肾消耗病中也有同样的功效[23]。为了验证 V2受体拮抗剂的疗效,Wang等[24]采用 PCK大鼠与缺乏血管加压素 Brattleboro(AVP-/-)杂交。PCK;AVP-/-大鼠与 PCK;AVP+/+和 PCK;AVP+/-大鼠的肾脏相比,其 cAMP水平偏低且产生的囊肿减少。尽管如此,但当 V2受体拮抗剂治疗血管加压素缺乏大鼠却得到与之相反的结果,托伐普坦已进入 ADPKD患者临床研究。该研究观察终点指标是以 MRI测量肾脏体积。研究对象年龄在 18~50岁之间,肾功能正常且肾脏体积超过 750 ml,疗程 3年。值得注意的是,OPC-31260或者托伐普坦均可有效抑制肝脏纤维囊性病变进展。这可能与肝脏缺乏 V2受体有关。动物实验证实大量饮水可抑制血管加压素的分泌并延缓囊肿的发生和发展[25]。然而,MDRD研究表明尿量增多和低尿渗量与 PKD肾功能的迅速恶化密切相关[26]。因此,大量饮水是否可延缓 PKD进展的仍有待解决。

表1 多囊肾病治疗药物
奥曲肽 奥曲肽是生长抑素的长效类似物。奥曲肽与生长抑素受体结合并抑制 cAMP分泌。奥曲肽可有效降低 cAMP水平并抑制 PCK大鼠肝囊肿的形成[27]。一项纳入 12例研究、观察 6个月的随机对照研究结果表明,奥曲肽可减少肾体积但并不改善肾小球滤过率(GFR)[28]。
雷帕霉素 研究表明 PKD患者和小鼠囊肿上皮细胞激活哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)受体传递通路。PC1可与 Tuberin(TSC2)相互作用,作为 mTOR激活剂而抑制 Rheb(图3)。缺乏 PC1、去除 Rheb的抑制可导致 mTOR激活并促细胞生长。雷帕霉素是应用于器官移植领域中的一种作用于 mTOR受体的免疫抑制剂。为验证抑制 mTOR是否可抑制囊肿生长,将雷帕霉素和依维莫司(everolimus)应用于 PKD的 Han和 SPRD大鼠动物模型来观察囊肿的生长情况[29,30]。结果表明雷帕霉素有效治疗三种非同源PKD动物模型,如 Tg737Orpk/orpk(纤毛 Polaris蛋白突变)、bpk小鼠和肾脏特异性 BHD突变小鼠(Birt-Hogg-Dube′syndrome基因突变)[31,32]。治疗组在改善囊肿体积和 BUN水平方面均显著优于对照组。
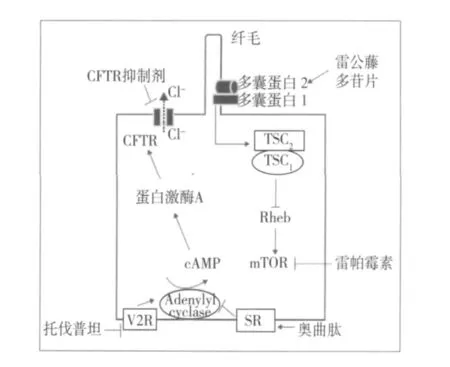
图3 多囊肾病新药治疗作用机制[23]
Shillingford等[32]回顾性研究一组因 PKD导致ESRD但仍存有原 PKD的肾移植患者。其中 4例接受雷帕霉素治疗,其原囊肿的肾脏体积比服其他免疫抑制剂的 3例患者明显减少(24%vs 8.6%)。由此证实,雷帕霉素和非雷帕霉素组之间肾脏体积具有显著性差异。Qian等[34]研究表明雷帕霉素可以减少肝脏体积和囊肿的数目,但对肾囊肿无效。
细胞周期调节蛋白 小鼠囊肿上皮细胞和PKD患者的细胞增殖迅速,这意味着细胞周期调控异常。为验证通过控制细胞周期是否可使囊肿停滞生长,人们将细胞周期调节蛋白应用于两种非同源PKD动物模型中(jck和 cpk小鼠)[35]。果然,细胞周期调节蛋白均可抑制囊肿的生长。间断用药可获较长的抗囊肿效应。
其他 雷公藤多苷片是从天然草本植物分离出来的药物,已在肾脏特异性 Pkd1突变小鼠中证实可延缓肾囊肿生长。雷公藤可与 PC2结合诱导钙离子释放。细胞内钙浓度增加可刺激磷酸二酯酶抑制腺苷酸环化酶导致 cAMP水平的下降,从而延缓肾囊肿生长(图3)[36]。囊性纤维化跨膜传导调节蛋白(CFTR)是一种 cAMP调节性氯离子通道,是氯离子进入囊肿的通道。CFTR抑制剂已在 PKD动物模型中证实可延缓囊肿的生长[37]。吡格列酮亦可改善肾功能并改善 Pkd1基因敲除小鼠的肾外表现[38],其具体机制可能与 Wnt/β-catenin信号传递有关。MAPK/ERK抑制剂在非同源 PKD动物模型中可以降低囊肿指数[39],但在同源 PKD动物模型则无效[40]。Src的活性受到抑制可以改善非同源bpk和同源 ARPKD同源 PCK动物模型囊肿形成[41]。最近发现 TNF-α可促使 PKD囊肿生长。采用 TNF-α抑制剂——依那西普治疗 Pkd 2突变小鼠的结果表明:对照组动物囊肿按预期速度发展,而非依那西普治疗组在 10周后均无一例发生肾囊肿。ACEI和 ARB药物并不能有效提高肾脏存活率或降低 PKD患者的死亡率。目前试图证实 ACEI和ARB是否可通过控制血压抑制 ADPKD的生长[42]。
结论:近期研究表明 PKD发病机制与初级纤毛发生异常有关,且初级纤毛可干扰肾脏异常 PCP信号传递通路。出生后纤毛蛋白失活的初级纤毛在调节细胞生长和修复损伤中发挥全新的作用。甚至表明肾小管损伤后修复缺陷可促进 PKD疾病的进展。
1 Igarashi P,Somlo S.Genetics and pathogenesis of polycystic kidney disease.J Am Soc Nephrol,2002,13:2384-2398.
2 Yoder BK.Role of primary cilia in the pathogenesis of polycystic kidney disease.J Am Soc Nephrol,2007,18(5):1381-1388.
3 Torres VE,Grantham JJ.The development of renal epithelial cysts//Brenner BM,Rector F C Jr,eds.The kidney,8th.ed.Philadelphia:WB Saunders,2008,1428.
4 Pazour GJ,Dickert BL,Vucica Y,et al.Chlamydomonas IFT88and its mouse homologue,polycystic kidney disease gene tg737,are required for assembly of cilia and flagella.J Cell Biol,J Cell Biol,2000,151(3):709-718.
5 Torres VE,Harris PC,Pirson Y.Autosomal dominant polycystic kidney disease.Lancet,2007,369(9569):1287-1301.
6 Hildebrandt F,Otto E.Cilia and centrosomes:a unifying pathogenic concept for cystic kidney disease?Nat Rev Genet,2005,6(12):928-940.
7 Wang S,Zhang J,Nauli SM,et al.Fibrocystin/polyductin,found in the same protein complex with polycystin-2,regulates calcium responses in kidney epithelia.Mol Cell Biol,2007,27:3241-3252.
8 Lin F,Hiesberger T,Cordes K,et al.Kidney-specific inactivation of the KIF3A subunit of kinesin-II inhibits renal ciliogenesis and produces polycystic kidney disease.Proc Natl Acad Sci U S A,2003,100(9):5286-5291.
9 Davenport JR,Watts AJ,Roper VC,et al.Disruption of intraflagellar transport in adult mice leads to obesity and slow-onset cystic kidney disease.Curr Biol,2007,17(18):1586-1594.
10 Masyuk AI,Gradilone SA,Banales JM,et al.Cholangiocyte primary cilia are chemosensory organelles that detect biliary nucleotides via P2Y12 purinergic receptors.Am JPhysiol Gastrointest Liver Physiol,2008,295(4):G725-G734.
11 Karner C,Wharton KA Jr,Carroll TJ.Planar cell polarity and vertebrate organogenesis.Semin Cell Dev Biol,2006,17(2):194-203.
12 Devenport D,Fuchs E.Planar polarization in embryonic epidermis orchestrates global asymmetric morphogenesis of hair follicles.Nat Cell Biol,2008,10(11):1257-1268.
13 Fischer E,Legue E,Doyen A,et al.Defective planar cell polarity in polycystic kidney disease.Nat Genet,2006,38(1):21-23.
14 Saburi S,Hester I,Fischer E,et al.Loss of Fat4 disrupts PCP signaling and oriented cell division and leads to cystic kidney disease.Nat Genet,2008,40(8):1010-1015.
15 Patel V,Li L,Cobo-Stark P,et al.Acute kidney injuryand aberrant planar cell polarity induce cyst formation in mice lacking renal cilia.Hum Mol Genet,2008,17(11):1578-1590.
16 Jonassen JA,San Agustin J,Follit JA,et al.Deletion of IFT20 in the mouse kidney causes misorientation of the mitotic spindle and cystic kidney disease.J Cell Biol,2008,183(3):377-384.
17 Corbit KC,Shyer AE,Dowdle WE,et al.Kif3a constrains beta-catenin-dependent Wnt signaling through dual ciliary and non-ciliary mechanisms.Nat Cell Biol,2008,10(1):70-76.
18 Simons M,Gloy J,Ganner A,et al.Inversin,the geneproduct mutated in nephronophthisis type II,functions as a molecular switch between Wnt signaling pathways.Nat Genet,2005,37(5):537-543.
19 Otto EA,Schermer B,Obara T,et al.Mutations in INVSencoding inversin cause nephronophthisis type 2,linking renal cystic disease to the function of primary cilia and left-right axis determination.Nat Genet,2003,34(4):413-420.
20 Lal M,Song X,Pluznick JL,et al.Polycystin-1 C-terminal tail associates with beta-catenin and inhibits canonical Wnt signaling.Hum Mol Genet,2008,17(20):3105-3117.
21 Piontek K,Menezes LF,Garcia-Gonzalez MA,et al.A critical developmental switch defines the kinetics of kidney cyst formation after loss of Pkd1.Nat Med,2007,13(12):1490-1495.
22 Li X,Magenheimer BS,Xia S,etal.Atumor necrosis factor-alphamediated pathway promoting autosomal dominant polycystic kidney disease.Nat Med,2008,14(8):863-868.
23 Wang X,Gattone V 2nd,Harris PC,et al.Effectiveness of vasopressin V2 receptor antagonists OPC-31260 and OPC-41061 on polycystic kidney disease development in the PCK rat.JAm Soc Nephrol,2005,16(4):846-851.
24 Wang X,Wu Y,Ward CJ,et al.Vasopressin directly regulates cyst growth in polycystic kidney disease.J Am Soc Nephrol,2008,19(1):102-108.
25 Nagao S,Nishii K,Katsuyama M,et al.Increased water intake decreases progression of polycystic kidney disease in the PCK rat.J Am Soc Nephrol,2006,17(8):2220-2227.
26 Hebert LA,Greene T,Levey A,et al.High urine volume and low urine osmolality are risk factors for faster progression of renal disease.Am JKidney Dis,2003,41:962-971.
27 Masyuk TV,Masyuk AI,Torres VE,et al.Octreotide inhibits hepatic cystogenesis in a rodent model of polycystic liver disease by reducing cholangiocyte adenosine 3',5'-cyclic monophosphate.Gastroenterology,2007,132(3):1104-1116.
28 Ruggenenti P,Remuzzi A,Ondei P,et al.Safety and efficacy of long-acting somatostatin treatment in autosomal-dominant polycystic kidney disease.Kidney Int,2005,68(1):206-216.
29 Wahl PR,Serra AL,Le Hir M,et al.Inhibition of mTOR with sirolimus slows disease progression in Han:SPRD rats with autosomal dominant polycystic kidney disease(ADPKD).Nephrol Dial Transplant,2006,21(3):598-604.
30 Wu M,Wahl PR,Le Hir M,et al.Everolimus retards cyst growth and preserves kidney function in a rodent model for polycystic kidney disease.Kidney Blood Press Res,2007,30(4):253-259.
31 Baba M,Furihata M,Hong SB,et al.Kidney-targeted Birt-Hogg-Dube gene inactivation in a mouse model:Erk1/2 and Akt-mTOR activation,cell hyperproliferation,and polycystic kidneys.JNatl Cancer Inst,2008,100(2):140-154.
32 Shillingford JM,Murcia NS,Larson CH,et al.The mTOR pathway is regulated by polycystin-1,and its inhibition reverses renal cystogenesis in polycystic kidney disease.Proc Natl Acad Sci U SA,2006,103(14):5466-5471.
33 Patel V,Chowdhury R,Igarashi P.Advances in the pathogenesis and treatment of polycystic kidney disease.Curr Opin Nephrol Hypertens,2009,18(2):99-106.
34 Qian Q,Du H,King BF,et al.Sirolimus reduces polycystic liver volume in ADPKD patients.J Am Soc Nephrol,2008,19(3):631-638.
35 Bukanov NO,Smith LA,Klinger KW,et al.Long-lasting arrest of murine polycystic kidney disease with CDK inhibitor roscovitine.Nature,2006,444(7121):949-952.
36 Leuenroth SJ,Okuhara D,Shotwell JD,et al.Triptolide is a traditional Chinese medicine-derived inhibitor of polycystic kidney disease.Proc Natl Acad Sci U S A,2007,104(11):4389-4394.
37 Yang B,Sonawane ND,Zhao D,et al.Small-molecule CFTR inhibitorsslow cyst growth in polycystic kidney disease.J Am Soc Nephrol,2008,19(7):1300-1310.
38 Muto S,Aiba A,Saito Y,et al.Pioglitazone improves the phenotype and molecular defects of a targeted Pkd 1 mutant.Hum Mol Genet,2002,11(15):1731-1742.
39 Omori S,Hida M,Fujita H,et al.Extracellular signal-regulated kinase inhibition slows disease progression in mice with polycystic kidney disease.J Am Soc Nephrol,2006,17:1604-1614.
40 Shibazaki S,Yu Z,Nishio S,et al.Cyst formation and activation of the extracellular regulated kinase pathway after kidney specific inactivation of Pkd1.Hum Mol Genet,2008,17(11):1505-1516.
41 Sweeney WE Jr,von Vigier RO,Frost P,et al.Src inhibition ameliorates polycystic kidney disease.J Am Soc Nephrol,2008,19:1331-1341.
42 Chapman AB.Approaches to testing new treatments in autosomal dominant polycystic kidney disease:insights from the CRISP and HALT-PKD studies.Clin J Am Soc Nephrol,2008,3:1197-1204.
