新型利巴韦林衍生物的合成*
2010-11-26张逸伟彭云铁林东恩
张逸伟, 王 琳, 彭云铁, 林东恩
(华南理工大学 化学与化工学院,广东 广州 510641)
利巴韦林是一种广谱抗病毒药物,自1972年美国加州核酸研究所Witkowski等[1]首次报道以来,国内外对利巴韦林的合成进行了广泛而深入的研究。由于大量口服或注射利巴韦林存在不良反应,如可逆性贫血、血小板升高、继发溶血及抑制血红蛋白合成[2~4],为此,对利巴韦林进行结构改造合成其衍生物,希望得到更高效低毒的广谱抗病毒药物。碱基对利巴韦林及其衍生物的抗病毒谱起着至关重要的作用,对碱基改造也成为研发利巴韦林衍生物的新热点。
本文以1-(2,3,5-三乙酰基-β-D-呋喃核糖基)-1,2,4-三氮唑-3-甲酸甲酯(1)为原料,经水解和氨化反应得中间体1-(β-D-呋喃核糖基)-1,2,4-三氮唑-3-碳酰肼(3);以3为母体与芳香醛反应,对三氮唑3-位上碱基进行改性,合成了6种Schiff碱利巴韦林衍生物(5a~5f, Scheme 1),其结构经1H NMR和IR表征,其中5b, 5c和5f为新化合物。
1 实验部分
1.1 仪器与试剂
Bruker Avance Digital型核磁共振仪(DMSO-d6为溶剂,TMS为内标);Bruker Tensor 27型傅立叶红外光谱仪(KBr压片);Merch German硅胶F254薄层板。
3,5-二叔丁基-4-羟基苯甲醛(4c),自制;1, 2,4-二氯苯甲醛(4f)和甲醇钠,化学纯;其余所用试剂均为分析纯。
1.2 合成
(1)3的合成
在装带有干燥管的单口烧瓶中加入1 38.5 g(0.1 mol),甲醇300 mL及2.7‰(5 mmol)的甲醇钠溶液100 mL,搅拌下于室温反应1.5 h{TLC[展开剂:A=V(乙酸乙酯) ∶V(乙醇)∶V(二氯甲烷)=12 ∶2 ∶5]监控反应未完全};补加固体甲醇钠0.54 g,继续反应1 h(TLC监控)。低于60 ℃减压蒸除甲醇得淡黄色黏稠液体1-(β-D-呋喃核糖基)-1,2,4-三氮唑-3-甲酸甲酯(2)。
在装带有干燥管的圆底烧瓶中加入2,甲醇300 mL和50%H2NNH2·H2O 12.0 g,搅拌下于室温反应2 h[TLC(展开剂:A=12 ∶6 ∶9)监控]。过滤,滤饼低于60 ℃干燥得白色固体3 23.4 g,收率90.7%;1H NMRδ: 9.72(s, 1H, NH), 8.85(s, 1H, CH=N), 5.81(d,J=3.9 Hz, 1H, CH), 5.61(s, 1H, OH), 5.23(s, 1H, OH), 4.89(s, 1H, OH), 4.52(s, 2H, NH2), 4.34(s, 1H, CH), 4.14(s, 1H, CH), 3.95(m,J=4.7 Hz, 1H, CH), 3.63(m,J=11.9 Hz, 1H, CH2), 3.5(m, 1H, CH2); IRν: 3 396, 2 960, 1 687, 1 490, 1 272, 1 105, 639 cm-1。

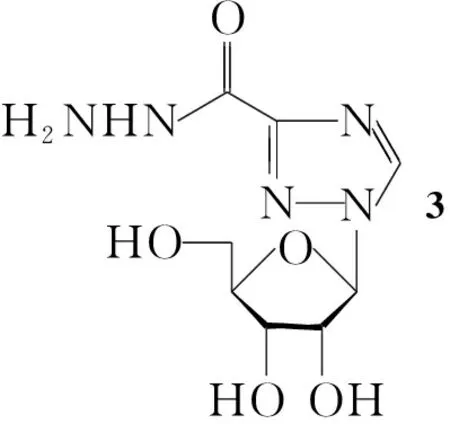
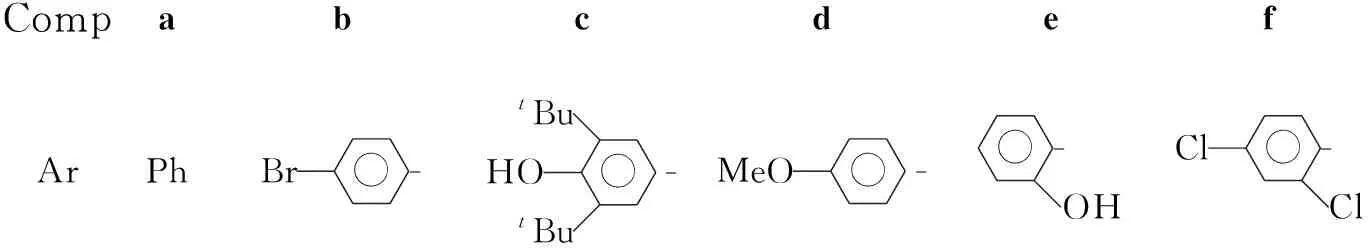
CompabcdefArPhBr-HO-tButBuMeO-OH-Cl-Cl
Scheme1
(2) 5的合成(以5a为例)
在装带有干燥管的单口烧瓶中依次加入32.6 g(10 mmol),苯甲醛(4a)1.6 g(10 mmol),乙酸5 mL和水20 mL,搅拌下于室温反应2.5 h[TLC(展开剂:A=12 ∶6 ∶9)跟踪]。过滤,滤饼用乙酸乙酯洗涤,低于60 ℃干燥得5a。
用类似的方法合成5b[室温反应过夜,展开剂:B=V(氨水) ∶V(乙酸乙酯) ∶V(乙醇) ∶V(二氯甲烷)=1 ∶24 ∶12 ∶18],5c[室温反应6.5 h后于50 ℃反应3 h,静置过夜,展开剂:B=2 ∶12 ∶6 ∶9],5d(室温反应0.5 h,展开剂:A=6 ∶2 ∶5),5e(室温反应10 h,展开剂:A=6 ∶2 ∶5)和5f(室温反应0.5 h,展开剂:A=6 ∶2 ∶5)。
(Z)-N′-{苯亚甲基-1-[(2R,3R,4S,5R)-3,4-二羟基-5-羟甲基-四氢呋喃-2-基]}-1H-1,2,4-三氮唑-3-碳酰肼(5a): 白色固体,收率86.2%;1H NMRδ: 11.98(s, 1H, NH), 8.99(s, 1H, CH=N), 8.56(s, 1H, ArCH), 7.70(dd,J=7.3 Hz, 2.2 Hz, 2H, ArH), 7.45(dd,J=5.0 Hz, 2.1 Hz, 3H, ArH), 5.86(d,J=3.9 Hz, 1H, CH), 5.60(d,J=5.6 Hz, 1H, OH), 5.21(d,J=5.6 Hz, 1H, OH), 4.94(t,J=5.5 Hz, 1H, OH), 4.40(dd,J=9.5 Hz, 4.9 Hz, 1H, CH), 4.15(dd,J=10.3 Hz, 5.2 Hz, 1H, CH), 3.97(q,J=4.6 Hz, 1H, CH), 3.72~3.60(m, 1H, CH2), 3.60~3.45(m, 1H, CH2); IRν: 3 458~3 129, 2 930, 1 694, 1 612~1 598, 1 544, 1 497, 1 129, 1 085, 602~686 cm-1。
(Z)-N′-{4-溴苯亚甲基-1-[(2R,3R,4S,5R)-3,4-二羟基-5-羟甲基-四氢呋喃-2-基]}-1H-1,2,4-三氮唑-3-碳酰肼(5b): 白色固体,收率85.4%;1H NMRδ: 12.06(s, 1H, NH), 8.99(s, 1H, CH=N), 8.53(s, 1H, ArCH), 7.65(s, 4H, ArH), 5.85(d,J=3.9 Hz, 1H, CH), 5.59(d,J=5.7 Hz, 1H, OH), 5.20(d,J=5.6 Hz, 1H, OH), 4.93(t,J=5.5 Hz, 1H, OH), 4.39(dd,J=9.4 Hz, 4.9 Hz, 1H, CH), 4.14(dd,J=10.3 Hz, 5.1 Hz, 1H, CH), 3.96(q,J=4.6 Hz, 1H, CH), 3.71~3.56(m, 1H, CH2), 3.56~3.45(m, 1H, CH2); IRν: 3 444~3 076, 2 930, 1 699, 1 614, 1 588~1 455, 1 491, 1 355, 1 085, 838, 684 cm-1。
(Z)-N′-{3,5-二叔丁基-4-羟基苯亚甲基-1-[(2R,3R,4S,5R)-3,4-二羟基-5-羟甲基-四氢呋喃-2-基]}-1H-1,2,4-三氮唑-3-碳酰肼(5c): 白色固体,收率41.4%;1H NMRδ: 11.67(s, 1H, 12-H, NH), 8.96(s, 1H, CH=N), 8.45(s, 1H, ArCH), 7.45(s, 2H, ArH), 5.85(d,J=3.9 Hz, 1H, CH), 5.59(d,J=5.6 Hz, 1H, OH), 5.19(d,J=5.6 Hz, 1H, OH), 4.93(t,J=5.4 Hz, 1H, OH), 4.39(dd,J=9.3 Hz, 4.8 Hz, 1H, CH), 4.14(dd,J=10.2 Hz, 5.1 Hz, 1H, CH), 3.96(dd,J=9.0 Hz, 4.5 Hz, 1H, CH), 3.65(m, 1H, CH2), 3.56~3.44(m, 1H, CH2), 1.40(s, 18H, CH3); IRν: 3 443~3 105, 1 672, 1 600, 1 559, 1 503, 1 364, 1 234, 894, 620 cm-1。
(Z)-N′-{4-甲氧基苯亚甲基-1-[(2R,3R,4S,5R)-3,4-二羟基-5-羟甲基-四氢呋喃-2-基]}-1H-1,2,4-三氮唑-3-碳酰肼}(5d): 白色固体,收率98.4%;1H NMRδ: 11.83(s, 1H, NH), 8.98(s, 1H, CH=N), 8.49(s, 1H, ArCH), 7.64(d,J=8.2 Hz, 2H, ArH), 7.01(d,J=8.2 Hz, 2H, ArH), 5.86(d,J=3.0 Hz, 1H, CH), 5.59(d,J=5.2 Hz, 1H, OH), 5.20(d,J=5.1 Hz, 1H, OH), 4.94(s, 1H, OH), 4.40(d,J=3.9 Hz, 1H, CH), 4.15(d,J=4.6 Hz, 1H, CH), 3.97(d,J=3.5 Hz, 1H, CH), 3.79(s, 3H, CH3), 3.72~3.58(m, 1H, CH2), 3.58~3.45(m, 1H, CH2); IRν: 3 445~3 234, 2 843, 1 697, 1 604, 1 553, 1 493, 1 086, 850, 681 cm-1。
(Z)-1-[(2R,3R,4S,5R)-3,4-二羟基-5-羟甲基-四氢呋喃-2-基]-N′-(2-羟基苯亚甲基)-1H-1,2,4-三氮唑-3-碳酰肼(5e): 白色固体,收率92.0%;1H NMRδ: 12.31(s, 1H, NH), 11.19(s, 1H, OH), 9.00(s, 1H, CH=N), 8.75(s, 1H, ArCH), 7.49(d,J=7.2 Hz, 1H, ArH), 7.30(t,J=7.3 Hz, 1H, ArH), 6.91(t,J=8.2 Hz, 2H, ArH), 5.87(d,J=3.6 Hz, 1H, CH), 5.60(d,J=5.5 Hz, 1H, OH), 5.21(d,J=5.4 Hz, 1H, OH), 4.94(t,J=5.3 Hz, 1H, OH), 4.40(d,J=4.3 Hz, 1H, CH), 4.15(d,J=5.0 Hz, 1H, CH), 3.97(d,J=4.3 Hz, 1H, CH), 3.65(m, 1H, CH2), 3.58~3.39(m, 1H, CH2); IRν: 3 380~3 128, 2 929, 1 692, 1 603, 1 546, 1 496, 1 084, 761, 687~572 cm-1。
(Z)-1-[(2R,3R,4S,5R)-3,4-二羟基-5-羟甲基-四氢呋喃-2-基]-N′-(2,4-二氯苯亚甲基)-1H-1,2,4-三氮唑-3-碳酰肼(5f): 白色固体,收率86.5%;1H NMRδ: 12.39(s, 1H, NH), 9.04(s, 1H, NH), 8.97(s, 1H, ArCH), 8.03(d,J=8.5 Hz, 1H, ArH), 7.72(d,J=1.9 Hz, 1H, ArH), 7.53(d,J=8.5 Hz, 1H, ArH), 5.88(d,J=3.9 Hz, 1H, CH), 5.62(d,J=5.6 Hz, 1H, OH), 5.23(d,J=5.5 Hz, 1H, OH), 4.96(t,J=5.4 Hz, 1H, OH), 4.42(d,J=4.6 Hz, 1H, CH), 4.16(dd,J=10.2 Hz, 5.1 Hz, 1H, CH), 3.98(d,J=4.5 Hz, 1H, CH), 3.75~3.62(m, 1H, CH2), 3.54(dd,J=11.2 Hz, 5.8 Hz, 1H, CH2); IRν: 3 253~3 092, 2 918, 1 697, 1 631, 1 589~1470, 1 498, 1 068, 913~856 cm-1。
2 结果与讨论
合成2时,用甲醇钠为催化剂效果较好,用量为5%(摩尔比)。合成3的方法与较文献[5]方法更为简单,收率高,副反应较少,产物容易提纯。
在5的合成中,由于4c为空间位阻较大的一个,其5c的收率最低。通过实验探索,对反应体系进行加处理,可降低反应的时间,并使反应更加完全。在合成这6种化合物的过程中,均采用水作为溶剂,乙酸为催化剂。
[1] Witkowski J T, Robins R K, Sidwell R W. Design,synthesis and broad spectrum antiviral activity of 1-β-D-ribofuranosyl-1,2,4-triazole-3-carboxamide and related nucleosides[J].J Medicinal Chemistry,1972,15(11):1150-1154.
[2] 张卫. 病毒唑的临床应用[J].新医学,1990,21(3):151.
[3] 凌美霞,熊开钧. 三氮唑核苷及与干扰素联合治疗乙肝的副反应[J].医药导报,1997,16(2):65-66.
[4] 陆建林. 三氮唑致白细胞减少2例[J].药物流行病学杂志,1997,6(1):34.
[5] Weiyong Liu, Haiying Li, Baoxiang Zhao,etal. Synthesis of novel ribavirin hydrazone derivatives and anti-proliferative activity against A549 lung cancer cells[J].Carbohydrate Research,2009,344:1270-1275.
