沙门菌分离技术关键点的研究和评价*
2010-11-14胡雪明杨兰萍金汇明许学斌
胡雪明,杨兰萍,金汇明,许学斌,冉 陆,阚 飙
2.上海市卢湾区疾病预防控制中心,上海 200025;
3.上海市疾病预防控制中心,上海 200336;
4.中国疾病预防控制中心,北京 102206
上世纪70年代的球磨培养基生产技术研发成功为国内实验室提供了与国际接轨的低成本沙门菌分离材料,使之能按照国标或行标开展沙门菌检测项目。90年代始,因持续升温的食源性疾病研究推动了对沙门菌分离材料和方法的创新,反观国内培养基产品滞后、原材料品质下降和腹泻患者口服抗菌药物史等多因素影响着实验室检测和监测沙门菌的敏感性。为提升实验室在肠道病原菌诊断中的影响力,维护国家参与全球沙门菌监测(GSS)中的利益,我们对沙门菌新型与传统培养基的效果评价基础上优化分离关键点技术,并验证、评价其可推广性。
1 材料和方法
1.1 实验菌株 敏感性测试菌株包括 26株非伤寒沙门菌和16株伤寒副伤寒沙门菌;特异性测试菌株148株均来自上海市疾病预防控制中心(CDC)菌种保藏室〔1〕。
1.2 试剂和仪器 亚硒酸煌绿增菌液自行配置〔2〕;罗伯特增菌液(RVS)和木糖赖氨酸胆酸盐琼脂平板(XLD,Oxoid,英国);CHROMagarTM沙门菌显色琼脂平板(CAS)(上海科玛嘉微生物技术有限公司);沙门菌分型诊断血清118种(S&A,Ltd,泰国);API-ATB生化鉴定仪(法国生物梅里埃公司);亚硒酸盐增菌液(SF)、沙门-志贺平板(S.S)、武汉S.S琼脂平板(WS)、Hektoen平板(HE)、肠道双支糖综合鉴别管和其他辅助生化鉴定试剂(上海市疾病预防控制中心试剂供应中心)。以上试剂避光10℃以下保存,均在有效期内使用。
1.3 敏感性与特异性 实验菌株经血平板纯化后挑取单个菌落转种富营养肉汤36℃过夜培养后调至0.5麦氏比浊管浓度,取 10μL 种于 CAS、WS、S.S、HE、XLD 划线分离,36℃培养24h记录平板菌落生长:判断典型阳性菌落CAS为酒红色圆而湿润菌落;WS、S.S、HE、XLD皆为中心黑色(硫化氢阳性)的半透明、原色、湿润菌落;反之阴性。标本分离平板若符合典型菌落生长者假设沙门菌阳性,挑取≤3个菌落接种肠道双支糖综合鉴别管36℃培养24h后生化符合(甘露醇+、葡萄糖+、尿酶-、蔗糖-、动力+、靛基质-、硫化氢+)者,经血清分型结合生化鉴定的“金标准”方法报告沙门菌血清型。统计敏感性和特异性。
1.4 选择性增菌液与平板组合使用的敏感性 回顾性在收集不同时期、不同标本(预防性职业体检粪便肛拭2 517件、食品增菌标本303件、腹泻病人粪便肛拭870件)直接平板分离、增菌液与平板配伍单盲检测的敏感性,见表1。2004年本市卢湾区疾病预防控制中心(CDC)实验室使用单盲法随机对流行与非流行季节的各1 000份预防性体检粪便标本比较SF和SBG分别与WS和CAS配伍检测的敏感性。
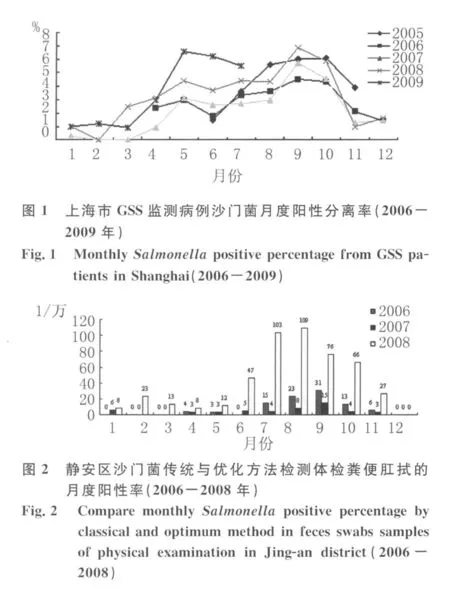
1.5 优化方法的验证 GSS监测项目:2005年6-11月上海市CDC使用 SBG-XLD/CAS(优化方法1)检测870份腹泻病人粪便标本的沙门菌月度阳性率为本底依据,制定《上海市沙门菌监测(GSS)方案.2006年》〔3〕培训各监测点CDC实验室人员检测卢湾(后改为黄浦)、长宁、金山、浦东新区共设置的12家监测点医院肠道门诊的腹泻病人粪便标本,其中一、二、三级医院各4家。优化方法1与传统方法的比较:统计2006和2007年静安区预防性体检粪便肛拭标本经传统方法(SF-WS)检测的沙门菌月度阳性率为基线值,以优化方法1替代检测2008年度静安区预防性体检肛拭标本,比较两法的月度阳性率。
1.6 优化方法在临床实验室的室间控制和方法学评估2008年4月培训GSS监测点8家二、三级医院的肠道门诊和微生物实验室医、技人员,2008年5月始,临床实验室使用SBG-XLD(优化方法2)和4个区CDC实验室使用优化方法1各自对腹泻标本进行平行检测。CDC根据各医院每月菌株符合数给予质量督导和阶段性效益评估。
2 结 果
2.1 平板的敏感性和特异性 42株伤寒和非伤寒沙门菌在CAS、WS 、S.S 、HE、XLD 上的总敏感性分别为 100%、57.1%、61.9%、47.6%、85.7%,3 种以单纯糖-指示剂为原理的平板(WS、S.S、HE)的假阴性绝大多数为伤寒、副伤寒沙门菌和部分非伤寒沙门菌,XLD上的假阴性则以伤寒、副伤寒沙门菌为主;148株非沙门菌在 CAS、WS、S.S、HE 、XLD上的总特异性分别为 96.6%、93.2%、93.92%、93.2%、92.6%。CAS上的假阳性有2株大肠埃希菌、1株溶血不动杆菌、1株铜绿假单胞菌、1株近平滑假丝酵母菌,培养时间延长至48h后假阳性菌落或挑之有粗糙感或在色度和湿润度上均有别于典型菌落。其余平板的假阳性菌落多由产硫化氢的7株枸橼酸杆菌和少数肠杆菌(1株迟缓爱德华肠杆菌、1株雷氏普鲁菲登肠杆菌、1株奇异变形杆菌、1株蜂房哈夫尼亚肠杆菌)及1株溶血不动杆菌产生〔1〕。
2.2 增菌液和平板配伍检测的敏感性 不同时期多基于粪便标本为主的不同增菌液之间和一种增菌液与不同平板单盲法检测沙门菌的敏感性显示CAS和 XLD优于 WS、S.S、HE;但临床肛拭标本用CAS直接检测的敏感性也仅为23.0%,说明对肛拭为主的粪便标本增加选择性增菌是必要步骤;而传统增菌液与平板配伍:SF-S.S的敏感性为0和35.9%,更换了SBG增菌液后用类似的WS平板检测敏感性也可达到71.8%,而临床肛拭标本用SBG增菌后用 CAS、XLD合并检测的总敏感性为100%,其中CAS以94.4%的敏感性优于XLD的89.7%。增菌后的平板分离效果显示,SBG效果最佳,RVS次之,国内常用的SF较差,见表1。
2.3 方法验证 2005年6-11月和2006年4月-2009年7月,优化方法1检测腹泻病人和GSS标本数和月度阳性数见表2,根据阳性率作图1:5年中检测沙门菌的月度阳性率符合肠道传染病在流行季节呈正态分布的曲线特征,各年的月度阳性率间的波动度相对较小,最高月度阳性率为2008年9月(6.9%),年度阳性率水平呈较低的是2006年,相对阳性率最高为2009年,高峰期保持在8-10月的5%~7%阳性率水平。
优化方法1检测2008年度静安区预防性体检肛拭标本共分离沙门菌129株(0.4%,129/29 687),分别是2006年22株(0.08%,22/29 005)的8倍和2007年12株(0.04%,12/30 577)的10倍。据3年中沙门菌月度阳性率绘制曲线将2008年与2006、2007年的结果进行比较,见图2:在6-10月的流行季节,2008年的月度阳性率是2006、2007年的2~10倍;其他非流行季节,2008年也均明显高于2006和2007年同期的月度阳性率。

表1 5种沙门菌选择性平板在菌株及3种增菌液配伍检测的敏感性(%)〔1,4〕Tab.1 The susceptibility test by stock of strainsand combiningthree Salmonella selective enrichment broth on five selective medium
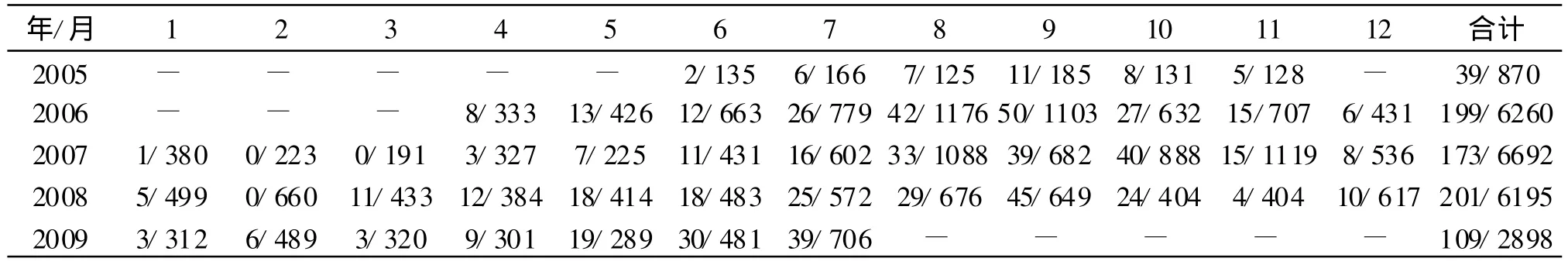
表2 2005-2009年月度检测腹泻标本数和沙门菌阳性数Tab.2 The nember of diarrheic specimen and isolates Salmonella in mouthly surveillance(2005-2009)
2.4 优化方法的室间控制 比较2008年5月-2009年8月上海市8家二、三级医院实验室用优化方法2和区CDC实验室使用优化方法1平行检测GSS标本的月度阳性菌株数,区CDC实验室检菌数为197高于临床实验室的155(假设CDC检测敏感性为100%则医院的敏感性为78.7%)。通过市、区CDC加强两级督导寻找产生误差原因、纠正认为因素和临床实验室对检测流程的熟练度逐渐增加等原因,使2009年两者的平行检测差距同比小于2008年同期,见图3。2009年8月高峰期出现的较大差异现象经调查为黄浦区中心医院肠道门诊人员更替造成的偏倚。在8家二、三级医院中以上海市第九人民医院的40株和黄浦区CDC的45株的检测符合率最高,敏感性达到88.9%,高于其他临床医院实验室结果,见图 4。优化方法 2因未使用CAS其成本仅为方法1的1/3,8家临床医院使用优化方法2历经2年检测的总敏感性为78.7%,其中第九人民医院最高88.9%的敏感性与前期2005年89.7%的结果接近。
3 讨 论
2008年通过国家大疫情网络直报的感染性腹泻(丙类传染病)人数较历史同期水平出现大幅增长,但自临床实验室诊断并报告为沙门菌的(多数没有分型)全国仅有280余例(其中包括上海市金山区1例食源性暴发的90多例)。通过2005-2009年的GSS监测数据证明,沙门菌在本市肠道病流行季节可达到5%~7%的临床分离率,说明国内多数临床医院肠道门诊可能存在采样率不足和实验室检测敏感性严重偏低的问题,也为临床实验室改革沙门菌检测现行标准提供了客观数据〔5〕。

影响沙门菌常规检测的因素有很多,本次的平板敏感性测试证实不同非伤寒沙门菌株间产硫化氢表型有很大差异,故可解释S.S在菌株测试和标本分离敏感性低的问题,缘于标本中大量产硫化氢的肠肝菌干扰严重降低平板筛检的阳性预测值、增加无效鉴定的人工和花费。CAS作为第三代沙门菌显色平板因含有双酶底物能明显克服产硫化氢等非沙门菌的干扰,提高平板筛检的准确性、减少工作量。除在体检标本分离到伤寒沙门菌外,还能避免少数硫化氢阴性的变异沙门菌引起暴发病例的漏检,唯一的缺点是价格较昂贵〔1,7〕。
选择性增菌液中的靶菌浓度低于106cfuml可能无法用平板分离到。SF因不可高压、需避光保存和最佳增菌时间为8~12h等苛刻条件使其受国外用户的限制;RVS现多用于食品沙门菌增菌;SBG配方中增加了修复损伤沙门菌的能力,RVS和SBG的最佳增菌时间皆为18~22h,即培养过夜后菌量基本都能达到最大值(109cfuml)易被平板筛检〔8〕。另外,由于SBG中添加的磺胺类药能提高抑制杂菌的能力也间接提高平板分离靶菌的敏感性。数据表明,使用SBG增菌后即使用WS平板分离的敏感性也可达到71.8%,说明增菌液的优化配伍可以提高传统平板分离的敏感性,间接降低检测成本。
沙门菌选择性增菌液和平板分别是影响分离敏感性的主次因素,两者互为因果且互为影响,在确认能够满足有效增菌的前提下进行平板分离是沙门菌分离技术的关键点。为国内高端的专业实验室提供满足不同能级沙门菌检测需要。
包括分子生物学、免疫学方法在内的诸多“快诊”方法已被应用于突发公共卫生事件的实验室应对,但源于食品加工者导致食源性暴发和潜在的、多点散发的沙门暴发病例的防控仍需高度依赖众多公共卫生和临床实验室基于操作简单、敏感、高效的常规方法所建立的常态监测网络〔3,9〕。
(对参与项目的上海市第九人民医院孙康德;黄浦区中心医院周耀忠;东方医院李永明;仁济医院浦东分院汪雅萍;金山医院吴丽桂;金山区中心医院沈秀珍;长宁区中心医院徐伟红;同仁医院徐斌等微生物检验同仁在此一并致谢!)
〔1〕许学斌,顾宝柯,杨兰萍,等.5种沙门菌分离培养基的应用和比较〔J〕.中国卫生检验杂志,2005,15:773-775.
〔2〕Parks LC.Handbook of microbiological media〔M〕.2th.CRC Press,Inc,2000:Boca Raton,Fla.1476.
〔3〕朱超,许学斌.沙门菌血清型诊断〔M〕.上海:同济大学出版社,2009:368-394.
〔4〕许学斌,顾宝柯,陈敏,等.沙门菌检测方法的优化〔J〕.检验医学,2007,22:677-680.
〔5〕顾宝柯,袁政安,金汇明,等.上海市沙门菌病流行特征分析〔J〕.环境与职业医学杂志,2008,253:245-247.
〔6〕卫生部.细菌性和阿米巴痢疾诊断标准(WS287-2008).
〔7〕许学斌,袁政安,金汇明,等.上海市山夫登堡沙门菌流行特征和分子分型研究〔J〕.中华流行病学杂志,2009,30:933-937.
〔8〕Feder I,Nietfeld JC,Kelly B.Evaluation of enrichment techniques for the isolation ofSalmonellacholeraesuis from swine feces〔J〕.J Microb Methods,1998,33:143-151.
〔9〕Kimura AC,Palumbo MS,Meyers H,et al.A multi-state outbreak ofSalmonellaserotype T hompson infection from commercially distributed bread contaminated by an ill food handler〔J〕.Epidemiol Infect,2005,133:823-828.
〔10〕Luo YP,Li JY,Ma Y,et al.Isolation and characterization of nontyphoidSalmonellafrom hospital food handlers in Beijing,China〔J〕.J Food Safety,2009,29 :414-423.
