刺糖多孢菌生长特性及培养条件的优化
2010-11-04丽罗莉斯王艳萍李能威郭伟群王洁颖张晓琳
李 丽罗莉斯王艳萍李能威郭伟群王洁颖张晓琳
(天津科技大学食品工程与生物技术学院1,天津 300457)
(国家粮食局科学研究院2,北京 100037)
(贵州大学生命科学学院3,贵州 550025)
刺糖多孢菌生长特性及培养条件的优化
李 丽1,2罗莉斯2,3王艳萍1李能威2郭伟群2王洁颖1,2张晓琳2
(天津科技大学食品工程与生物技术学院1,天津 300457)
(国家粮食局科学研究院2,北京 100037)
(贵州大学生命科学学院3,贵州 550025)
研究了多杀菌素生产菌株的生长特性及种子培养条件对其发酵产量的影响。采用单因素试验确定刺糖多孢菌C3-10-4的最优种子培养基和最佳培养温度,同时采用正交设计对刺糖多孢菌C3-10-4培养基装量、摇床转速和添加玻璃珠个数进行了优化,并运用Gompertz模型拟合其生长曲线。结果表明:最佳种子培养基为:胰蛋白酶大豆肉汤30 g、酵母提取物3 g、硫酸镁2 g、葡萄糖10 g、去离子水1 L;最优种子培养条件为:培养温度为29℃,摇床转速240 r/min、玻璃珠6个、培养基装量30 mL/250 mL,在该培养条件下,可获得最大生物量。
刺糖多孢菌 多杀菌素 正交实验 生长曲线
刺糖多孢菌(Saccharopolyspora spinosa)属糖多孢菌属,是一种好氧型革兰氏阳性的非抗酸性放线菌[1],其有氧发酵可产生次级代谢产物多杀菌素。多杀菌素是一种新型高效的生物杀虫剂,主要用于农林虫害、储粮虫害、卫生虫害、牲畜寄生虫害的防治,其产品目前主要用在棉花、果蔬、茶叶、烟草、中草药、粮食等作物上[2-7]。因其具有杀虫谱广、生物活性高、低毒、低残留,对哺乳动物、鱼类、鸟类和大多数益虫具有极高的安全界限等优点而获得美国“总统绿色化学品挑战奖”[8]。2005年美国环保署批准将多杀菌素用作储粮防护剂。
微生物发酵的生产水平不仅取决于生产菌株本身的性能,同时还要赋以合适的环境条件,才能使其生产能力充分表达。因此,了解生产菌株对环境条件的要求,如培养基,培养温度,氧的需求,搅拌速度等,对发酵生产控制具有重要的指导意义。从20世纪80年代末开始,国外学者对多杀菌素的发酵工艺和分离纯化工艺研究较多[9-11],进入21世纪之后,运用基因工程手段选育和改良菌株成为国外学者研究多杀菌素的主要方向[12-13]。国内对多杀菌素的研究起步较晚,主要研究侧重于筛选产多杀菌素的高产菌株及优化发酵培养基[14-16],而对其生长特性的研究很少。本试验对刺糖多孢菌的生长特性及种子培养条件进行了研究,旨在为多杀菌素的工业化生产提供理论依据。
1 材料与方法
1.1 菌株
刺糖多孢菌C3-10-4为本实验室筛选和保藏菌种。
1.2 培养基
斜面培养基:葡萄糖5 g/L,牛肉膏3 g/L,酪蛋白胨0.25 g/L,琼脂18 g/L。
种子培养基组分见表1。
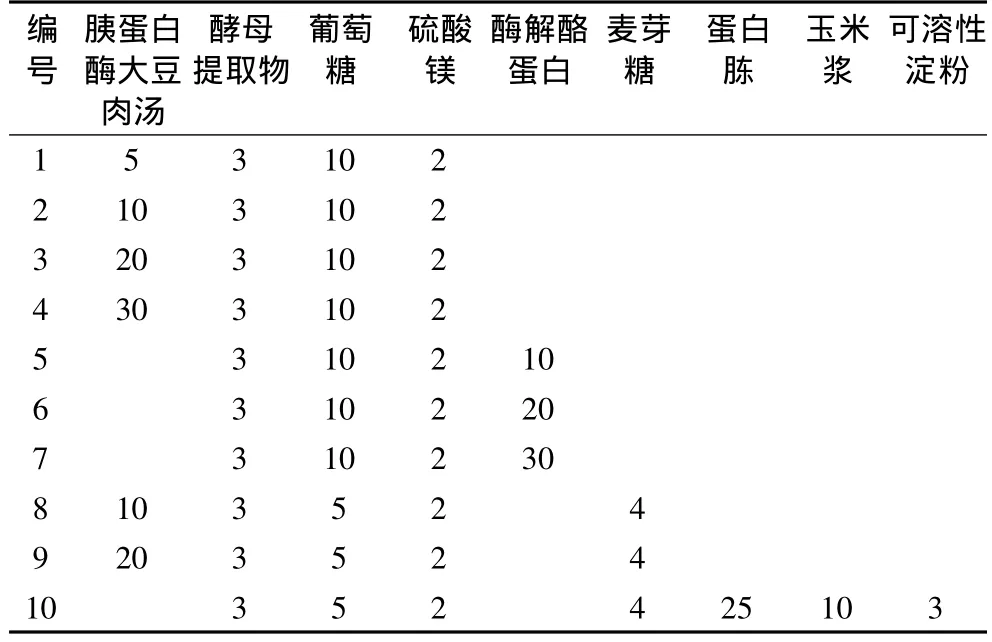
表1 种子培养基组分/g/L
发酵培养基:葡萄糖50 g/L,棉籽蛋白25 g/L,氯化钠3 g/L,硫酸亚铁0.05 g/L,碳酸钙1 g/L,磷酸氢二钾1 g/L。
培养基消毒前pH均为7.2,115℃湿热灭菌25 min。
葡萄糖、可溶性淀粉、麦芽糖、硫酸镁:国药集团;牛肉膏、酪蛋白胨、蛋白胨、玉米浆:北京奥博星生物技术公司;胰蛋白酶大豆肉汤、酶解酪蛋白、酵母提取物:美国BD公司。
1.3 仪器
Delta320型pH计:瑞士Mettler Toledo公司;Eppendorf AG 22331 Hamburg型离心机:德国Eppendorf公司;YS100光学显微镜:日本Nikon公司。
1.4 刺糖多孢菌的培养
将保藏菌种接到新鲜斜面培养基中,29℃培养7 d,用无菌水制备成数量级为108个/mL的孢子悬液,按1%接种量接入种子培养基,在试验设计的温度条件下摇床培养,试验均设定3次重复。
1.5 生物量测定方法
采用菌体干重法测定生物量[17]。取10 mL培养液于离心管中,3 500 r/min离心15 min,弃去上清液,将菌体于105℃下干燥至恒重,称量总质量,减去离心管质量,即为菌体生物量。
1.6 生长曲线的测定
将试验菌种接种于新鲜斜面培养基中,29℃培养7 d,用无菌水制备成数量级为108个/mL的孢子悬液,按1%接种量接入种子培养基,于29℃摇床培养7 d。摇瓶装液量为30 mL/250 mL,玻璃珠6个,摇床转速为240 r/min,偏心距为26 mm。每12 h取样,测定样品的生物量和pH,以上试验设3次重复。
2 结果与讨论
2.1 最优种子培养基的筛选
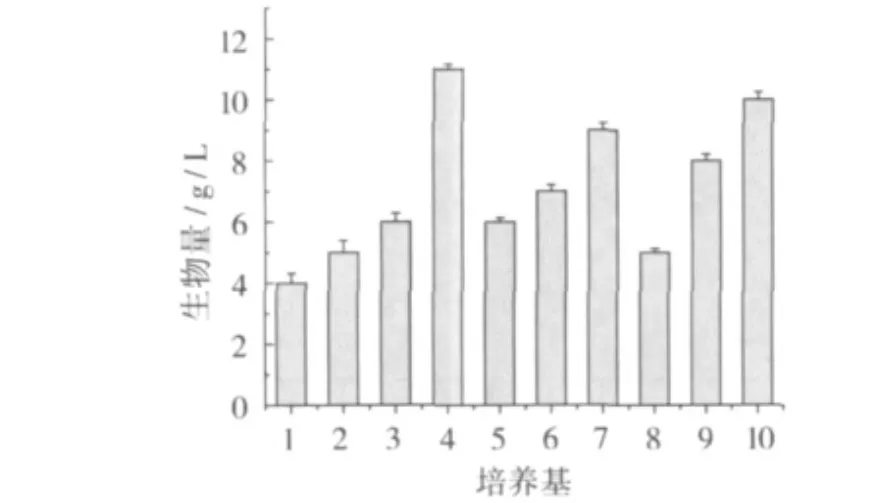
图1 培养基与生物量的关系曲线
图1为刺糖多孢菌在10种不同种子培养基中生长72 h后生物量的变化情况。结果表明,刺糖多孢菌在4号配方种子培养基中的生物量最大。同时,观察4号配方的菌丝体形态,其菌丝较长且茁壮,生长旺盛,符合种子要求。因此,选用4号培养基作为基础培养基,考察不同培养条件对菌株生长的影响。
2.2 温度对刺糖多孢菌生长的影响
将接种后的种子培养基分别置于27、29、32和35℃环境下培养,接种量为1%,培养72 h后测定生物量,并镜检观察菌丝形态,结果如图2和图3所示。
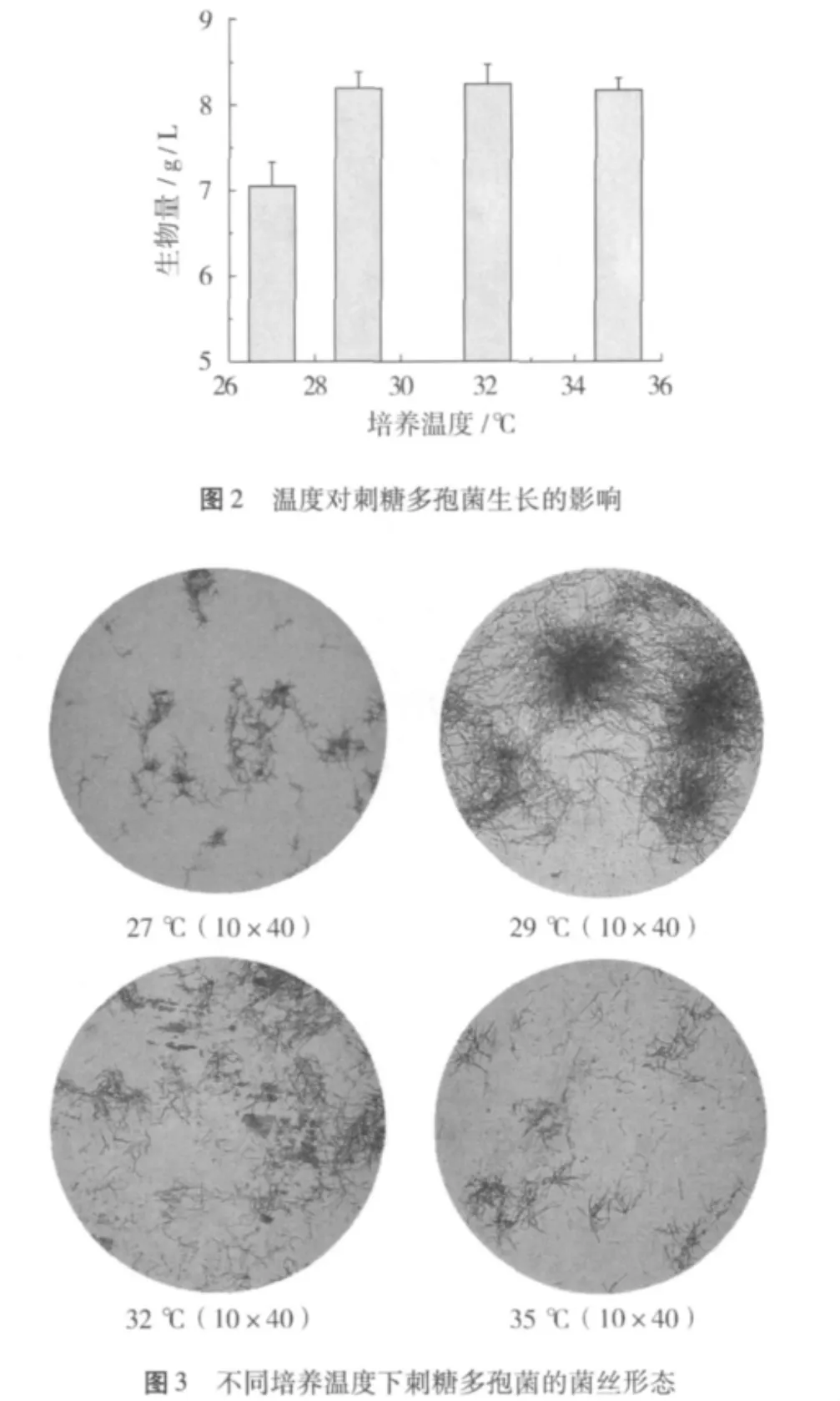
由图2可知,随着培养温度逐步升高,刺糖多孢菌的生物量在29~35℃范围内变化不明显,且高于27℃培养温度下的生物量;从图3镜检的结果来看,当培养温度提高时,菌丝体断裂现象越来越严重。这可能是因为高温下,菌株的生物活性物质蛋白质、核酸等发生变性,酶活性受到影响,细胞功能下降,甚至死亡[18]。刺糖多孢菌在29℃培养温度下其菌丝体生长最好,菌丝无断裂现象。因此选择29℃作为其最适生长温度。
根据试验结果,在培养温度29℃下,考察其他培养条件对菌株生长的影响。
2.3 培养基装量、摇床转速和添加玻璃珠个数对刺糖多孢菌生长的影响
刺糖多孢菌是一种好氧放线菌,培养基装量和摇床转速对氧的供给具有重要影响。玻璃珠的加入可以减少菌丝体的抱团,增加氧利用率[19]。通过正交设计考察上述3种培养条件对生物量的影响。采用混合正交表L16(42×3),正交因素水平见表2,试验结果及方差分析分别见表3和表4。
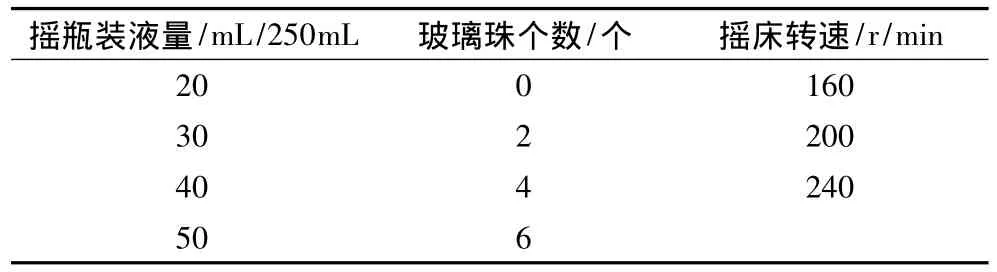
表2 正交试验因素水平表
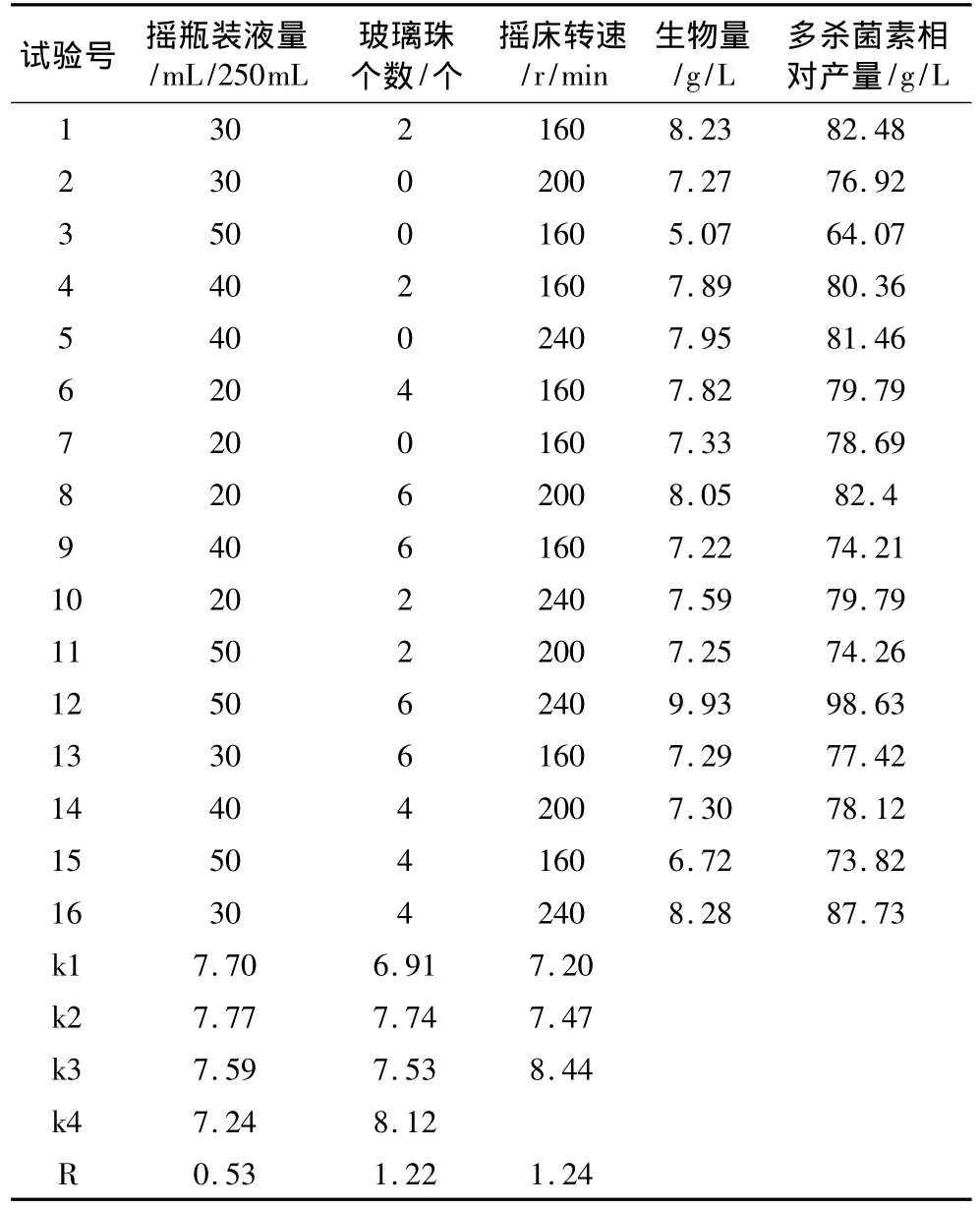
表3 正交试验结果
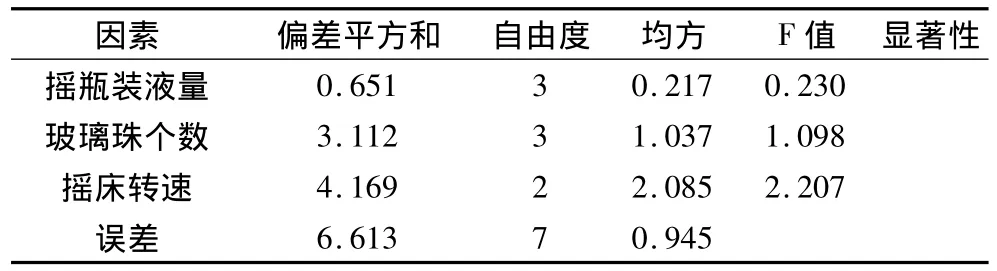
表4 正交试验方差分析表
运用SPSS16.0对生物量与多杀菌素相对产量进行相关性考察,结果表明,生物量与多杀菌素相对产量之间呈高度正相关性,相关系数达0.970(P<0.001)。
正交试验结果表明,在不同培养条件下,相对应的生物量在P=0.05时不显著,几个影响因素的主次关系依次为:摇床转速>玻璃珠个数>培养基装量。从表3看出,摇床转速和玻璃珠个数对生物量影响相对较大,在培养过程中,提高摇床转速和增加玻璃珠个数,增强了打碎气泡的能力,气液接触表面积增加,供氧能力提高[17]。氧利用率的增加,有助于菌丝体的生长。同时,增加摇床转速和玻璃珠个数,菌丝受到的剪切力增强。过强的剪切力易导致菌丝体受到机械损伤,生理状况发生异常,从而抑制菌体生长[20,21]。观察菌丝形态,随着玻璃珠个数的增加,菌丝体未发现断裂情况,菌丝粗细相当。说明该菌株对剪切力的耐受性较强。发酵工业中,为了提高供氧能力,会增加发酵罐搅拌速度,但同时也增强了菌株受到的剪切力,该菌株对剪切力有较强的耐受性,这一结果对发酵调控具有重要的指导意义。
由正交试验得最优方案为摇床转速240 r/min、玻璃珠6个、摇瓶装液量30 mL/250 mL。验证试验结果表明,在此培养条件下,菌体生物量达到9.98 g/L,高于正交试验生物量。
2.4 刺糖多孢菌的生长曲线及其 Gompertz方程拟合
2.4.1 生长曲线的测定
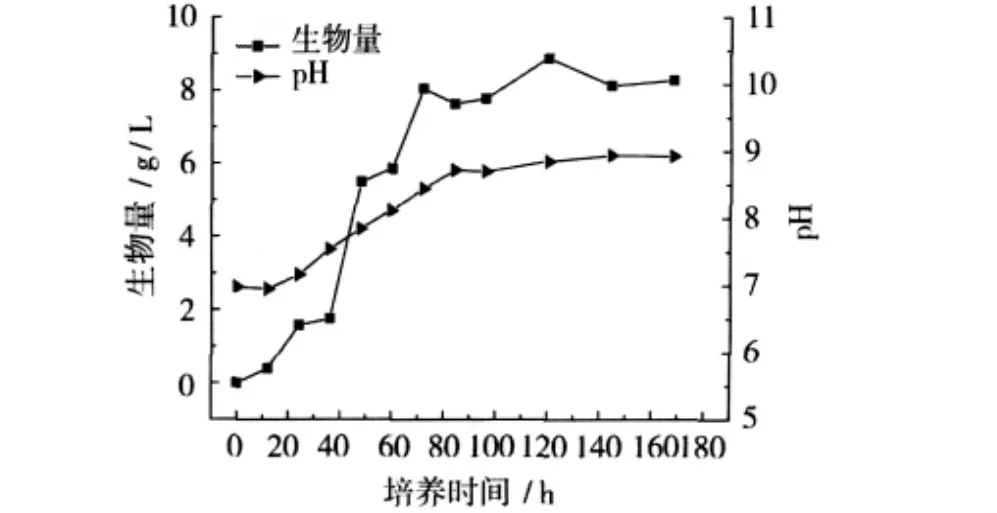
图4 刺糖多孢菌的生长曲线
刺糖多孢菌C3-10-4的生长曲线见图4。从图4中可以看出,菌株在生长36 h后进入对数生长期,72 h后进入平稳期。pH呈现稳步增长的趋势,变化范围从pH 6.9到8.9,当pH>8.7时,菌丝体出现断裂,开始自溶。pH是影响菌株体内各种酶活性的重要因素,pH的变化会引起酶活力的改变,从而影响菌株在培养过程中的代谢速度,甚至改变其代谢途径和细胞结构[18]。菌丝繁殖到一定程度后,由于养分的耗尽以及代谢产物的积累,菌体量不再增加,菌丝体逐渐老化,工业发酵生产中,要选择菌体处在生命力极为旺盛的对数生长期,且培养液的菌体量未达到高峰的时期作为移种时间。从生长曲线来看,刺糖多孢菌最适种龄在60~70 h为宜。
2.4.2 Gompertz方程拟合曲线
根据模型分类方法,微生物生长曲线的模型属于初级模型,它描述了微生物的数量与时间变化之间的关系,从曲线上可以得出有关微生物生长的参数,如初始菌液浓度、延滞期、生长率、菌液最大浓度等。Gompertz模型是一种描述光滑S型曲线,且有一个固定拐点的方程。为了考察刺糖多孢菌的生长特性,运用Gompertz方程模拟实验菌株的生长趋势[22-24]。Gompertz方程如式:
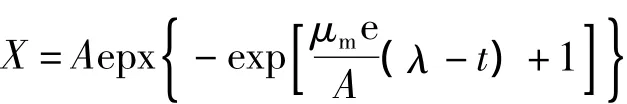
式中:X为生物量的质量浓度/g/L;μm为最大的比生长速率,即生长曲线上通过拐点的切线/g/h;λ为延滞期时间,即切线在x轴上的截距/h;A为即渐近线值,就是可能达到的相对最大的菌浓度/g/L;t为菌株培养时间/h;e为常数2.718 28。
根据最小二乘法原理,运用统计软件SPSS16.0对生长曲线进行曲线拟合,拟合后的Gompertz曲线见图5。
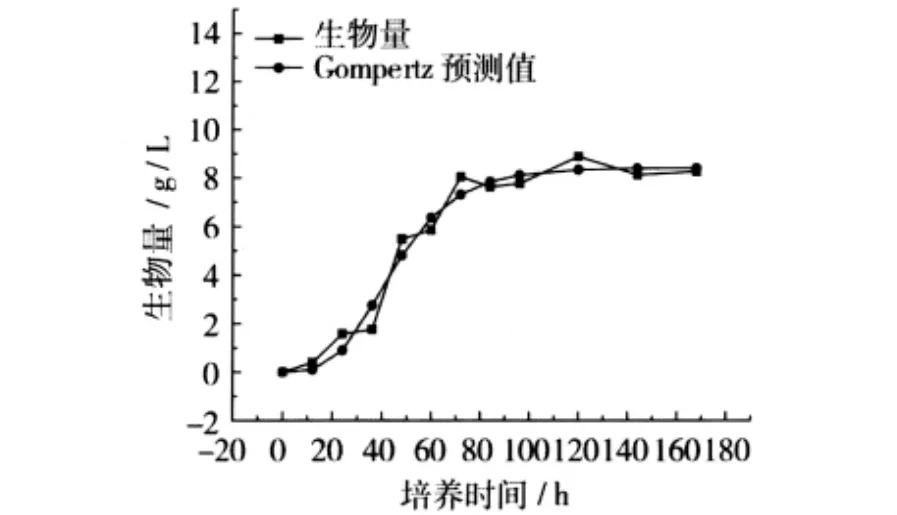
图5 Gompertz拟合生长曲线图
Gompertz方程对菌株生长曲线方程进行回归,其相关系数R=0.974,可见该模型回归效果较好。因此,可以用Gompertz方程来拟和并预测刺糖多孢菌的生长曲线,拟合后的生长曲线方程为:
X=8.420exp[-exp(2.183-0.057 5t)]
此时,延滞期λ=20.589 h,最大比生长速率μm= 0.187 g/h,相对最大菌质量浓度A=8.420 g/L。
3 结论
种子的质量是发酵能否正常进行的重要因素之一,通过对刺糖多孢菌种子培养基的筛选,以及对培养温度、培养基装量、摇床转速和添加玻璃珠个数的研究,确定其最佳培养温度29℃、摇床转速240 r/min、玻璃珠个数6个、摇瓶装液量30 mL/250 mL。利用Gompertz方程对生长曲线进行拟合,得到拟合曲线方程为:
X=8.420exp[-exp(2.183-0.057 5t)]
本研究为进一步了解刺糖多孢菌菌种特性及提高其代谢产物多杀菌素的产量提供了重要的参考依据,为多杀菌素的工业化生产奠定了一定的基础。
[1]Frederick P M,Raymond C Y.Saccharopolyspora spinosa sp.nov.Isolated from Soil Collected in a Sugar Mill Rum Still[J].International Journal of Systematic Bacteriology,1990,40(1):34-39
[2]Thompson G,Michel K.The discovery of Saccharopolyspora spinosa and a new class of insect products[J].Down to Earth,1997,52(1):1-5
[3]李荣贵,王普,梅建凤,等.新型生物杀虫剂——刺糖菌素[J].微生物学通报,2003,30(1):77-81
[4]陈小龙,郑裕国,沈寅初.农用抗生素刺糖菌素(Spinosads)的研究进展[J].微生物学报,2002,41(1):4-7
[5]Thompson G D,Robert D,Sparks T C.Spinosad-a case study:an example from a natural products discovery programme[J].Pest Management Science,2000,8:696-702
[6]吴霞.多杀菌素——以天然产物开发新农药的范例[J].世界农药,2004,1:24-28
[7]李姮,汪清民,黄润秋.多杀菌素的研究进展[J].农药学学报,2003,5(2):1-12
[8]徐志红,蒋志胜.生物杀虫剂多杀菌素的中毒症状和作用机理[J].农药科学与管理,2004,25(2):25-28
[9]Baker P J.Process for isolating A83543 and its components: USA,5227295[P].1993-07-13
[10]Mynderse J S,Mabe J A,Turner J R,et al.A83543 compounds and process for production thereof:USA,5670486[P].1997-09-13
[11]Boeck L D,Greenfield H C,Michel K H,et al.Process for producing A83543 compounds:USA,5362634[P].1994-11-08
[12]Madduri K,Waldron C,Matsushima P,et al.Genes for the biosynthesis of spinosyns:applications for yield improvement in Saccharopolyspora spinosa[J].Journal of Industrial Microbiology and Biotechnology,2001,27:399-402
[13]Waldron C,Matsushima P,Rosteck P R,et al.Cloning and analysis of the spinosad biosynthetic gene cluster of Saccharopolyspora spinosa[J].Chemistry and Biology,2001,8:487-499
[14]代鹏,徐雪莲,贺玉平,等.多杀菌素生产菌株发酵配方及条件的优化[J].华中农业大学学报,2006,25(3):245-248
[15]梁艳,卢文玉,闻建平.Minitab软件在多杀菌素发酵条件优化中的应用[J].中国抗生素杂志,2008,33(11):659-622
[16]Jin Z H,Wu J P,Zhang Y,et al.Improvement of spinosad producing Saccharopolyspora spinosa by rational screening[J].Journal of Zhejiang University,2006,7:366-370
[17]李福.刺糖菌素产生菌的菌种选育及发酵条件优化研究[D].浙江:浙江工业大学,2004
[18]邬行彦,熊宗贵,胡章助.抗生素生产工艺学[M]..北京:化学工业出版社,1985:123~125
[19]顾觉奋.抗生素[M].上海:上海科学技术出版社,2001: 84-87
[20]Giannuzzi L,Pinotti A,Zaritzky N.Mathematical modeling of microbial growth in packaged refrigerated beef stored at different temperatures[J].International Journal of Food Microbiology,1999,16:269-279
[21]周建,王军峰.剪切力对必特螺旋霉素发酵的影响[J].食品与药品,2008,10(1):18-21
[22]李秋蕊.富锗羊肚菌菌丝体深层发酵的研究[D].吉林:吉林大学,2005
[23]徐天宇.食品微生物生长预测模型[J].食品科学,1995,16(1):17-23
[24]周康,刘寿春.食品微生物生长预测模型研究新进展[J].微生物学通报,2008,35(4):589-594.
Growth Characteristics and Culture Conditions of Saccharopolyspora spinosa
Li Li1,2Luo Lisi2,3Wang Yanping1Li Nengwei Guo Weiqun2Wang Jieying1,2Zhang Xiaolin2
(College of Food Engineering and Biotechnology,Tianjin University of Science and Technology1,Tianjin 300457)
(Academy of State Administration of Grain2,Beijing 100037)
(College of Life Sciences,Guizhou University3,Guizhou 550025)
Gowth of Saccharopolyspora spinosa was studied and its culture conditions were optimized.Single factor experiments and orthogonal test were chosen to determine the optimal seed medium,culture temperature and fermentation medium.Additionally,its growth curve was predicted by Gompertz equation.Results:The optimal seed medium is tryptic soy broth 30 g,yeast extract 3 g,MgSO42 g,glucose 10 g and deionized water 1 L.The optimal seed culture conditions are culture temperature 29℃,volume of medium 30 mL/250mL flask,rotation speed 240 r/min and 6 glass beads.Under the optimal culture conditions,the biomass reaches the maximum.
Saccharopolyspora spinosa,spinosad,orthogonal design,growth curve
Q939.97 文献标识码:A 文章编号:1003-0174(2010)11-0089-05
国家科技支撑计划(2006BAD08B02)
2009-10-26
李丽,女,1984年出生,硕士,食品科学与工程
张晓琳,女,1975年出生,副研究员,博士,微生物发酵和基因工程研究
