多糖分子质量对大豆蛋白聚集体/葡聚糖混合体系微观结构的影响
2010-11-04李向红华欲飞刘展李
李向红华欲飞刘 展李 伟
(长沙理工大学食品科学省级重点学科预备学科1,长沙 410114)
(江南大学食品学院 食品科学与技术国家重点实验室2,无锡 214122)
(宁波中普检测技术服务有限公司3,宁波 315192)
多糖分子质量对大豆蛋白聚集体/葡聚糖混合体系微观结构的影响
李向红1华欲飞2刘 展3李 伟3
(长沙理工大学食品科学省级重点学科预备学科1,长沙 410114)
(江南大学食品学院 食品科学与技术国家重点实验室2,无锡 214122)
(宁波中普检测技术服务有限公司3,宁波 315192)
采用共聚焦激光扫描显微镜观察了室温下、pH 7.0时不同尺寸大小的大豆蛋白热聚集体和不同分子质量的葡聚糖混合体系的微观结构,并以天然大豆蛋白和葡聚糖混合体系的微观结构作对照。结果表明:葡聚糖分子链的排空相互作用使得蛋白质聚集体间产生了有效而不均匀的交联;蛋白质聚集体的尺寸增加和/或葡聚糖分子质量的增加促进了蛋白质富集区域的交联。对其共聚焦激光扫描图像进行灰度水平变化方差分析和灰度直方图分析表明,不同混合物间微观结构上具有显著性差异。
相分离 微观结构 共聚焦激光扫描显微镜 交联 排空相互作用
相分离普遍存在于食品加工中,控制生物大分子混合物间的相分离是进行产品微结构设计的最基本手段之一[1-2]。Sperry[3]在乳胶粒子和羟乙基纤维素的模型体系中发现,体系的微观结构取决于ξ (聚合物与胶体粒子的粒径比),ξ的临界值是 0.3~0.6,高于这个范围时,体系形成球滴状微观结构,而低于此范围时会形成聚集网状结构,因此在实际体系中可以根据想要得到的微观结构选择合适尺寸的蛋白质粒子和多糖聚合物。Hua等[4]研究发现,随着多糖性质的变化,大豆蛋白/多糖混合物与不同条件下形成的大豆蛋白凝胶一样,呈现出不同程度的相分离形态,因此选择不同性质的多糖对聚集大豆蛋白相分离性质及其相分离体系的结构控制具有一定意义。
显微镜技术被认为是评价相分离体系全面微观结构最好的方法[2],因此本研究拟采用共聚焦激光扫描显微镜 (CLS M)来表征不同尺寸大豆蛋白聚集体和不同分子质量葡聚糖的混合体系所形成的特定微观结构,并结合灰度水平变化方差分析和灰度直方图 2种分析方法从客观的角度解释不同混合体系其微观结构的差异性。
1 材料与方法
1.1 材料和仪器
低变性脱脂豆粕:山东谷神有限公司;葡聚糖和异硫氰酸酯 (FITC):Sigma公司;所有其他化学试剂均为分析纯。
PHS-3C pH计:上海精密科学仪器有限公司; HH-4数显恒温水浴锅:江苏金坛市环宇科学仪器制造厂;DW-9802型多功能电动搅拌器:郑州市上街华科仪器厂;TGL-16B高速台式离心机:上海安亭科学仪器厂;90-1恒温磁力搅拌器:上海沪西分析仪器厂;0.45μm、0.8μm醋酸纤维膜:德国Merck公司;Leica TCS 4D共聚焦激光扫描显微镜:德国Leica Lasertechnik GmbH公司。
1.2 试验方法
1.2.1 热诱导大豆蛋白聚集体的制备
大豆蛋白和热诱导大豆蛋白聚集体的制备方法参照文献[5]。本研究选择 1%的大豆蛋白溶液经热处理后形成的体系(1%的大豆蛋白聚集体,1%A)和5%的大豆蛋白溶液经热处理后形成的体系(5%的大豆蛋白聚集体,5%A)来研究大豆蛋白聚集体/葡聚糖的相分离,两种聚集体的尺寸相差较大,可以作为代表性的聚集体来研究与多糖的相分离。1%A和5%A是平均粒径分别为 56.5 nm和 144.9 nm、聚集体部分分别为14.7%和74.7%的多分散性体系。本研究中将预先加热聚集的样品溶液浓缩至一定浓度以备相分离研究,聚集体在稀释与浓缩过程中均保持稳定,可在不同阶段采用不同仪器进行分析[6]。
1.2.2 葡聚糖溶液的制备
由于葡聚糖分子在水溶液中以随机卷曲状存在,不存在温度或盐浓度不同时构象的改变,因此制备葡聚糖溶液时直接将不同分子质量的葡聚糖粉末(葡聚糖 1号样:DT1#,Mw100 000~200 000;葡聚糖 2号样: DT2#,Mw 500 000~4 000 000)分散于去离子水中,在室温下搅拌 2 h,让其充分溶解后加入 0.02%的叠氮钠防止微生物生长。DT1#溶液通过 0.45μm的醋酸纤维素膜以除去任何不溶性物质,DT2#分子质量较大,采用 0.8μm的醋酸纤维素膜将溶液过滤。
1.2.3 微观结构观察和图像分析
因为蛋白质本身不能发射很强的荧光,因此在显微观察前,先用溶于二甲基亚砜中的 2%的 FITC对蛋白质进行标记,标记方法是每100 mL蛋白溶液中加入 25μL的 FITC并用磁力搅拌器搅拌 90 min[7-8]。混合物的配制是将不同颗粒大小的蛋白质 (1%A、5%A和天然蛋白)与葡聚糖混合,配制成蛋白质质量分数4%、多糖质量分数1%的混合物。取少量相分离混合物溶液滴在载玻片上,并用盖玻片小心密封,以防气泡产生。制好的玻片用 CLS M观察,Ar/Kr激光发生器发射波长确定为 485 nm。
大豆蛋白/葡聚糖混合物的共聚焦激光扫描图像(CLS M图)是一种数字图像,它们的灰值分布和差异性分析采用Matlab6.5程序进行分析。数字图像是指由被称作象素的小块区域组成的二维矩阵,对于单色即灰度图像而言,每个象素的亮度用一个数值来表示,通常数值范围在 0到 255之间,即可用一个字节来表示,0表示黑、255表示白,而其他表示灰度。本研究中用于图像分析的Matlab6.5集数值分析、矩阵运算、信号处理和图形显示于一体,可以通过编制计算机程序,然后在Matlab中进行运算来得到每个图像的灰度分布以及差异分析的特征值。
具体操作是首先将相分离混合体系的CLS M图转变成灰度图像,图像中将会包含高灰值区域(白色区域)和低灰值区域 (黑色区域),这些灰值的差异通过计算图像的灰度水平变化方差得到,见公式[9]:
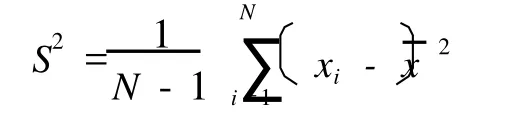
式中,S2为图像各象素点的灰度水平变化方差; xi为图像某象素点的灰度水平 (≤255);?x为图像各象素点的灰度水平总和的平均值;N为图像的象素数。其编程原理是对灰度图像进行一一计算,其中N为图像的象素数,是固定的 106个,以 5个象素点为单位,切割图像,xi是 5个象素点的小格子中象素值的平均值(即这个小格子中所有象素点的值之和除以 25),计算图像的每一个以 5个象素点为单位的小格子,求出 S2。
灰度直方图是灰度级的函数,它表示图像中具有每种灰度级的象素的个数,反映图像中每种灰度出现的频率。灰度直方图的横坐标是灰值,纵坐标表示该灰值出现的频率,是图像最基本的统计特征,对图像某一象素的灰度水平而言,其值越大即越亮,表明这一部分物质的交联密度比较大、浓度比较高。具体分析方法如下:利用图像工具把图像改为灰度图像,并转变成 1000×1000象素大小的正方形,然后通过编程用Matlab分析运算得到灰度直方图。
2 结果与分析
2.1 大豆蛋白/DT1#混合体系的微观结构及图像分析
大豆蛋白/DT1#混合体系的 CLS M图见图 1。
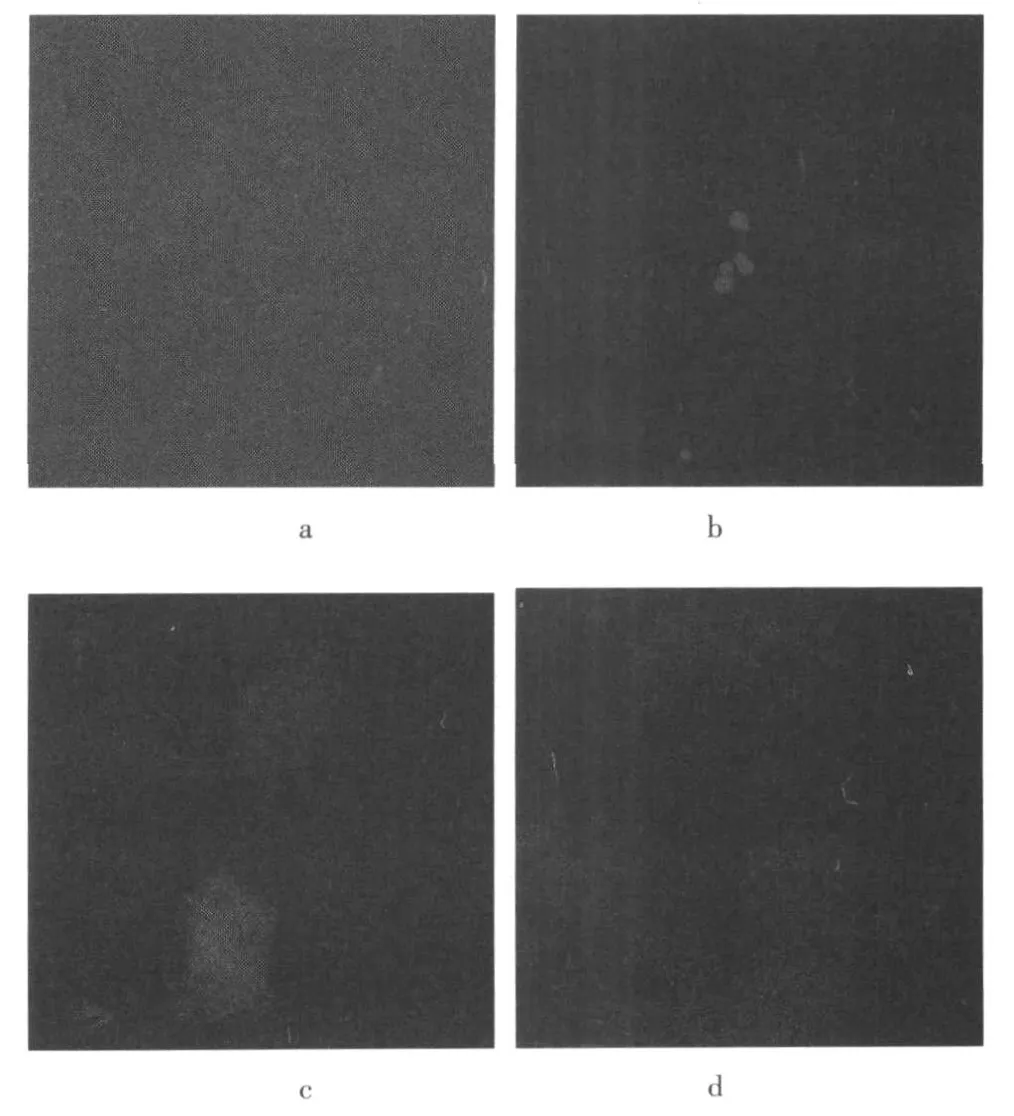
图1 大豆蛋白/DT1#的CLS M图像
图1a为大豆蛋白与葡聚糖混合后形成的均相体系的微观结构,图中白色区域代表 FITC标记的区域,荧光区域均匀的分布在整个体系中;而在蛋白质4%,多糖 1%的混合体系中,不管蛋白质颗粒粒径的大小,3种体系都表现出相分离,即蛋白富集区域在图中清晰可见,黑色区域即为多糖所在的区域,两种生物大分子组分分布在分开的两相中。在本研究条件下,pH中性时,大豆蛋白所带电荷为负电荷,而葡聚糖为中性多糖,分子不带电荷,二者间不存在相互聚合的作用,体系中发生了互斥相分离。
相分离后的大豆蛋白/DT1#混合体系的 CLS M图揭示出蛋白质组分间的相互交联,蛋白质富集区域的大小取决于蛋白质颗粒粒径的大小。两个相互靠近并叠加的大的聚集体间具有较大的叠加区域,这一区域里葡聚糖的浓度明显低于溶液中葡聚糖的浓度,从而产生较大的渗透压,促进了蛋白质粒子的进一步交联;对于天然大豆蛋白和 DT1#而言,相对较大的聚合物和尺寸较小的胶体粒子混合时,构象熵的减少有限,渗透压较小,蛋白质交联较少,说明是由于葡聚糖分子链的排空相互作用使得蛋白质聚集体间产生了有效而不均匀的交联。
天然大豆蛋白和DT1#的相分离体系中(图 1b),蛋白质存在于较小的体积中,DT1#组成了体系的连续相,蛋白质富集区域形成了球形微观结构 (Droplet -like structure);在大豆蛋白聚集体/葡聚糖混合体系中(图 1c和图 1d),蛋白质交联区域大块的存在并显示出与天然大豆蛋白和 DT1#混合体系不同的微观结构,其原因是当聚合物与胶体粒子的粒径比以不同值存在时,相分离后体系会形成不同的微观结构[10-13],粒径比较大,形成球形微观结构;当胶体粒子(大豆蛋白聚集体)的尺寸增加时,粒径比减小,则形成蛋白质富集区域彼此交联的结构。
根据图 1的 CLS M图得到了图像分布的灰度直方图(图 2)。在天然蛋白/DT1#体系的整个灰度值范围内(0~255),在灰度值 10左右处有一个宽峰存在,即为蛋白质交联的区域;1%A/DT1#混合体系图像的灰值范围内,灰度值 30处有一个尖峰,灰度值60处有一个小峰,说明体系中存在不同灰值的区域;而对于 5%A/DT1#体系,在整个灰度范围内,分别在灰度值 10和 30处有较明显的峰存在,在灰度值 65左右有一个小峰存在,说明在其混合体系中,存在灰度值比较小的葡聚糖富集区域,以及灰值较大的蛋白质富集区域;在 30和 65两个灰值处分别有一个峰,说明蛋白质组分的交联很不均匀,既有蛋白质交联浓度相对较低的区域,也有蛋白质浓度很高的区域,蛋白质富集区域的分布较无规则。
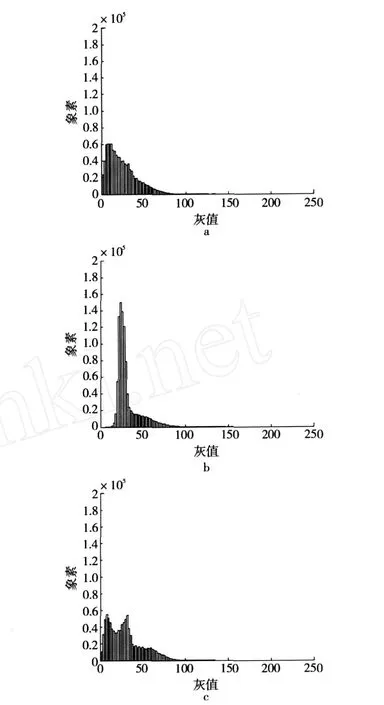
图2 大豆蛋白/DT1#CLS M图的灰度直方图
2.2 大豆蛋白/DT2#混合体系的微观结构及图像分析
图 3是大豆蛋白/DT2#混合体系的 CLS M图,从图 3中可观察到蛋白质富集区域明显增加,天然蛋白/DT2#混合体系的微观结构也不再是球形微观结构。一般来说,DT2#分子质量远大于 DT1#,其粒径也大于后者,说明DT2#和天然蛋白粒径比增加了,应该会形成球形微观结构,而实际是形成了蛋白质彼此交联的结构,Wang等[14]把这种交联结构的形成也归结于排空相互作用,他们在研究β-乳球蛋白和普鲁兰多糖的混合体系(β-乳球蛋白的粒径远小于普鲁兰多糖的粒径)时,观察到网状结构的形成,并引入常数 K来表征蛋白质和多糖聚合物不相容的程度。
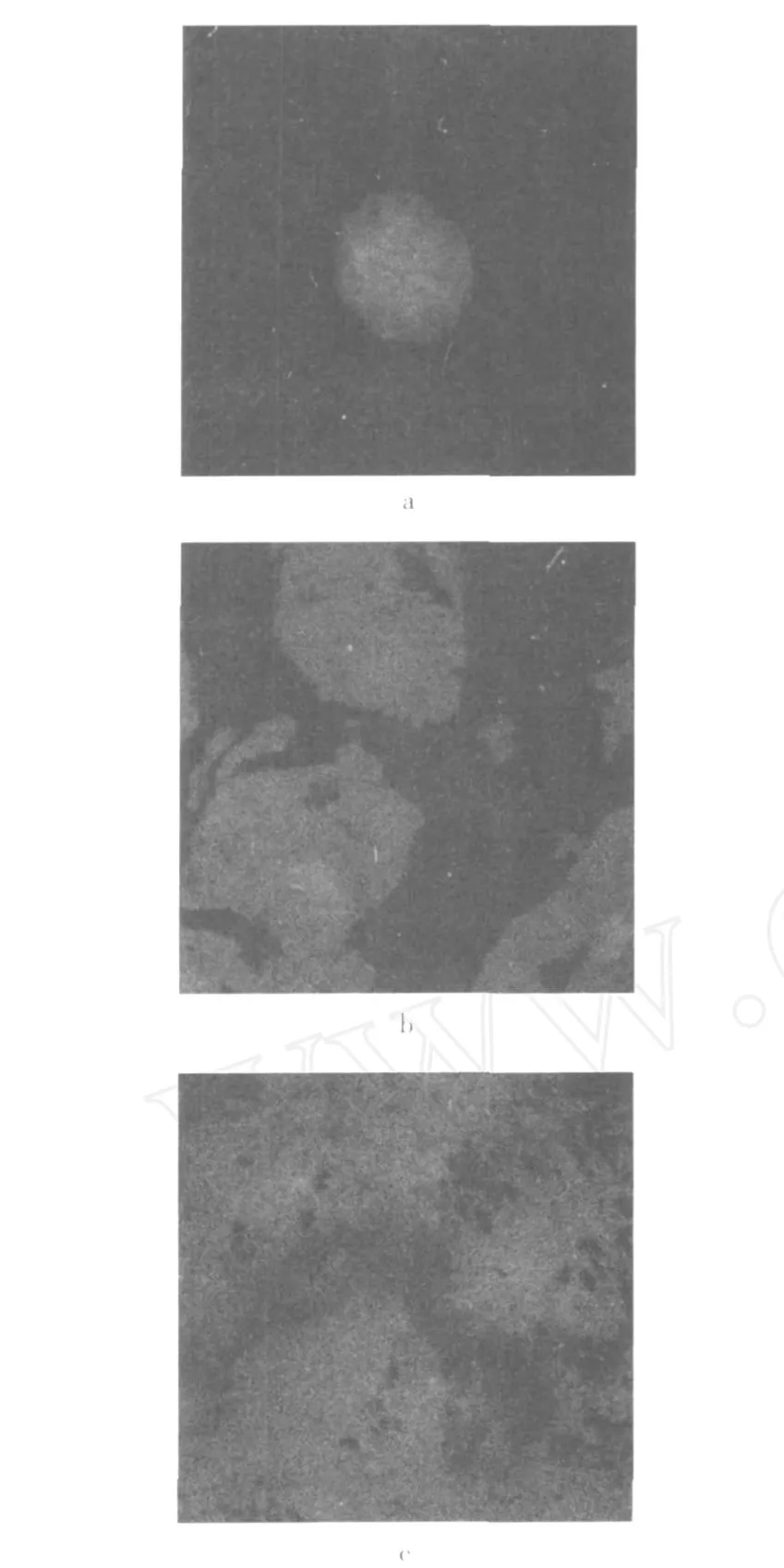
图3 大豆蛋白/DT2#的CLS M图像
1%A/DT2#混合物中的荧光区域也明显增加,而在 5%A/DT2#的混合体系内,蛋白质富集区域分布在整个体系内,FITC荧光标记的蛋白质组分组成了整个体系的连续相;通过往体系的 z轴方向 (大约40μm)观察发现,蛋白质富集区域彼此交联(即网络结构的形成),同时发现多糖分子被截留在网络结构中。从宏观角度观察,体系形成了高度黏稠的凝胶状结构,而没有形成蛋白质富集相和多糖富集相。从相分离产生的不同阶段来说,经过相分离初始阶段后,成熟期体系的结构以较快的速度演变,体系中蛋白质组分较快交联形成凝胶 (葡聚糖不能形成凝胶),使得相分离停留在第二阶段,而没有演变到宏观相分离,此时混合体系的结构演变变得缓慢[2],所以对构造特定的食品体系来说,可以很好的利用相分离的这个阶段。在实际食品结构的构造中,例如色拉调味料的生产时,可以利用这种机理生产出具有独特连续性质构的产品[15]。对于单一蛋白质体系来说,因为加热聚集会造成体系中大的粒子和小的颗粒并存,这是一种典型的动力学不均匀体系,很容易在这种体系中观察到相分离现象的产生,因此当浓度足够高或者离子强度很高或 pH值接近等电点时,单一蛋白质体系的凝胶形态将和混合体系一样,取决于相分离和胶凝作用竞争的结果。

图4 大豆蛋白/DT2#CLS M图的灰度直方图
在灰度直方图上也观察到不同大豆蛋白粒子和DT2#混合后呈现不同的微观结构(图 4)。在天然蛋白/DT2#体系的整个灰度值范围内,灰度值 10左右处的峰仍旧存在,但变得较窄而尖,同时可以观察到在灰度值 20~40间有一个较宽的分布,说明其微观结构的改变;1%A/DT2#的灰度直方图中,有两个峰存在,同时灰度值的频率增加说明蛋白质富集更为稠密,区域浓度增加[16];而在 5%A/DT2#的灰度直方图中可以看到一个灰度值较大的宽峰分布在整个灰度范围内,说明蛋白质富集区域极为稠厚。
CLS M图像的灰度水平变化方差 (S2)分析结果见表 1,基本上与图像表面特征一致。5%A/DT2#较小的变化方差可能的原因是,灰值较高的区域分布在整个体系中,多糖存在的黑色区域只是镶嵌于其中,整个灰度值的离散程度较小,因此反而得到了较小的灰度水平变化方差结果;也说明相对其他发生了宏观相分离的体系来说,这种微相分离结构的表面连续性及均匀程度更高。

表 1 CLS M图像的灰度水平变化方差(变化方差/平均强度)结果
3 结论
CLS M对微观结构的观察结果显示,葡聚糖分子链的排空相互作用,导致蛋白质聚集体间产生了有效而不均匀的交联。蛋白质聚集体的尺寸增加和/或葡聚糖分子质量的增加促进了蛋白质富集区域的交联;灰度水平变化方差和灰度直方图的分析也表明不同的混合物间具有显著性差异。当体系中蛋白质粒子间的相互作用较强且两种生物大分子的浓度足够高时,宏观上体系转变成均匀的高度黏稠的凝胶状结构,微观角度上观察形成了蛋白质组分间彼此交联,多糖分子被截留在蛋白质网状结构中的不均匀结构,相分离和胶凝的竞争导致了这种微相分离结构的产生。在本研究中,胶凝速度大于相分离速度,在发生宏观相分离前,整个体系结构已经由于胶凝而被“冻结”,是食品微结构设计的基础。推测单一蛋白质体系的凝胶形态将和混合体系一样,取决于相分离和胶凝作用竞争的结果。
[1]Damodaran S,Paraf A.Food proteins and their applications [M].New York:MarcelDekker,1997,171-198
[2]McKenna B M.Texture in Food,Volume 1:Semi-Solid Foods[M].Cambridge:Woodhead PublishingLi mited,2003
[3]Sperry P R.Morphology and mechanis m in latex flocculated by volume restriction[J].Journal of Colloid and Interface Science,1984,99(1):97-108
[4]Hua Y,CuiW,WangQ.Gelling property of soy protein-gum mixtures[J].Food Hydrocolloids,2003,17:889-894
[5]李向红,华欲飞,裘爱泳,等.不同浓度大豆分离蛋白热诱导聚集体的研究 [J].中国油脂,2007,3:74-77
[6]Croguennoc P,Nicolai T,Durand D,et al.Phase separation and association of globular protein aggregates in the presence of polysaccharides:2.Heatedmixturesof nativeβ-lactoglob2 ulin andκ-carrageenan[J].Langmuir,2001,17:4380-4385
[7]Schorsch C,JonesM G,Norton IT.Ther modynamic incompat2 ibility and microstructure of milk protein/locust bean gum/ sucrose systems[J].Food Hydrocolloids,1999,23:89-99
[8]Donato L,Garnier C,Novales B,et al.Gelation of globular protein in presence of low methoxylpectin:effectofNa+and/ or Ca2+ions on rheology and microstructure of the systems [J].Food Hydrocolloids,2005,19:549-556
[9]KendallM G,Stuart A.Advanced theory of statistics[M]. New York:Charles Griffin,1977
[10]GastA P,RusselW B,Hall C K.An experimental and theo2 retical study of phase transitions in the polystyrene latex and hydroxyethylcellulose system[J].Journal of Colloid and In2 terface Science,1986,109:161-171
[11]Lekkerkerker H N W,PoonW C K,Pusey P N,et al.Phase behavior of colloid +polymer mixtures[J].Europhysics Letters,1992,20:559-564
[12]PoonW C K,Pirie A D,Pusey P N.Gelation in colloid-pol2 ymermixtures[J].FaradayDiscussions,1995,101:65-76
[13]Verhaegh N A M,Lekkerkerker H N W.Transient gels in colloid-polymermixtures studiedwith fluorescence confocal scanning laser microscopy[J].Physica A,1999,264: 64-74
[14]Wang S,van Dijk J A,Odijk T,et al.Depletion induced demixing in aqueous protein-polysaccharide solutions[J]. Biomacromolecules,2001,2:1080-1088
[15]De Kruif C G,Tuinier R.Polysaccharide protein interactions [J].Food Hydrocolloids,2001,15:555-563
[16]张佑生,彭青松,汪荣贵.一种新的数字图像灰度直方图及其应用研究 [J].系统仿真学报,2002,14(12):1655-1658.
Effect ofMolecularWeight of Polysaccharide onMicrostructures of Heat Induced Soy Protein Aggregate/DextranMixtures
Li Xianghong1Hua Yufei2Liu Zhan3LiWei3
(Pre-Key Subject of Food Science,Changsha University of Science&Technology1,Changsha 410114)
(State KeyLaboratory of Food Science and Technology,School of Food Science and Technology,Jiangnan University2,Wuxi 214122)
(Ningbo Product Technology Service Co.,Ltd3,Ningbo 315192)
The microstructures ofmixed systems of heat-induced soy protein aggregateswith different size and dextran with differentmolecularweight have been observed by confocal laser scanning microscopy(CLS M)at room temperature(25℃)and pH 7.0,with native soy protein/dextran system as the comparison.Results:The depletion interaction of the dextran chains induces the inhomogeneous association of protein-rich areas.The increasing of the size of soy protein aggregates and/or the molecularweightof dextran accelerate the association of protein-rich areas. The image analysis based on the CLS M images shows that the variance of the grey values and the histograms of the grey values are different significantly among the differentmixed systems.
phase separation,microstructure,confocal laser scanningmicroscopy,association,depletion interaction
TS201.2+1 文献标识码:A 文章编号:1003-0174(2010)03-0016-06
863计划(2008AA100801),国家自然科学基金(20476 040)
2009-03-23
李向红,女,1979年出生,讲师,博士,粮食及植物蛋白的理论及应用研究
