大豆皂苷A和B对结肠癌细胞增殖和凋亡的影响
2010-11-04许惠仙全吉淑
孙 权 李 天 许惠仙 全吉淑
(延边大学医学院,延吉 133000)
大豆皂苷A和B对结肠癌细胞增殖和凋亡的影响
孙 权 李 天 许惠仙 全吉淑
(延边大学医学院,延吉 133000)
采用 C18反相柱层析法从大豆胚轴提取大豆皂苷,研究其抗结肠癌细胞增殖的作用。采用MTT比色法观察大豆皂苷对结肠癌 HT-29细胞增殖的影响,采用 TUNEL染色法检测其对 HT-29细胞凋亡的影响。结果表明,大豆皂苷呈时间和浓度依赖性地抑制结肠癌细胞增殖和诱导细胞凋亡。大豆皂苷可通过诱导结肠癌细胞凋亡发挥抗结肠癌作用。
大豆 皂苷 结肠癌 凋亡
流行病学调查证实,常食大豆对预防癌症和心血管疾病、增进人体健康有益。这些功效均与大豆中的异黄酮和皂苷等生物活性物质密切相关。大豆皂苷是存在于大豆中的一类五环三萜的糖苷,主要分为A类、B类、E类和DDMP皂苷,其中A类为双糖链皂苷,B类、E类和 DDMP皂苷为单糖链皂苷。已有很多研究表明,大豆皂苷具有多种药理作用,如抗癌、防治心血管疾病、抗病毒及保肝等作用[1-5],其中皂苷的抗癌作用尤其引起人们的关注。已证实大豆皂苷可抑制 S180、YAC-1和 P815细胞的DNA合成,并对人红白血病细胞系 K562及 YAC-1细胞有明显的细胞毒作用[6-7]。也有文献报导大豆皂苷具有抗结肠癌作用,其抗癌作用可能是通过直接细胞毒作用和生长抑制作用[8]、抑制免疫活性[9-10]和诱导癌细胞自噬[11]。本试验以从大豆胚轴提取的大豆皂苷为原料,研究大豆皂苷对结肠癌细胞增殖及细胞凋亡的影响。
1 材料与方法
1.1 细胞株
HT-29细胞:南京凯基生物技术公司。
1.2 药物和试剂
大豆:中国东北产大豆;噻唑兰:美国 Sigma公司; DME M培养基:美国 GI BCO公司;小牛血清:北京华美生物工程公司;胰蛋白酶美国D IFCO公司;细胞凋亡原位检测试剂盒:北京中金桥生物技术有限公司。
1.3 仪器设备
H ITACH IU-2010型紫外分光光度仪、H ITA2 CH I高效液相色谱系统:日本日立公司;OLY MPUS倒置显微镜:日本奥林巴斯公司;RT-2100型酶标仪:深圳雷杜公司;YPS2000真彩色病理图像分析仪:上海华岩仪器设备有限公司。
1.4 试验方法
1.4.1 大豆皂苷的提取及水解
将大豆胚轴研磨粉碎,用 50%甲醇加热提取,提取液经喷雾干燥得粗粉。将粗粉用等体积正丁醇 -水溶液萃取,取正丁醇层,经减压蒸馏、冷冻干燥,得富含大豆异黄酮和皂苷的总糖甙试样。将总糖苷用30%甲醇溶解,上 C18层析柱 (Y MC,ODS-A60-S150,5 cm×74 cm),依次用 30%、50%和 80%甲醇梯度洗脱,收集富含大豆皂苷的 50%和 80%甲醇流出部分。经减压蒸馏、冷冻干燥得干粉,分别称为F50和 F80。
大豆皂苷的分析采用薄层色普法(MERCK,Kie2 selgel 60 F254)和高效液相色普法 (Y MC,ODS-AM -303,4.6mm×250mm,5μm)[12]。
1.4.2 MTT比色
结肠癌细胞贴壁生长,培养于含 10%灭活小牛血清的DMEM培养液中,置 37℃、相对湿度 90%、5%CO2孵箱内培养。取对数生长期的HT-29细胞按每孔 1×105个细胞接种于 96孔板中,每孔体积200μL。待细胞贴壁后,药物组加入药物使其终质量浓度分别为 40、80和 160 mg/L,另设不加药物的阴性对照组以及不接种细胞的空白对照组。分别培养 24、48和 72 h,每个浓度每个时点均设 4个复孔。于终止前 4 h,每孔加入 5 g/L MTT溶液 20μL,继续孵育 4 h后弃去上清液,加入 150μL DMSO,轻轻振荡 10 min,使结晶物完全溶解,于490 nm波长处在酶联分析仪上测光吸收值(A值),计算生长抑制率。
抑制率 =(对照组A值 -实验组A值)/对照组A值 ×100%
1.4.3 HT-29细胞形态学观察
取对数生长期 HT-29细胞按 1×105个/瓶接种于 96孔细胞培养板中,24 h后换液,加入含 160 mg/L药物的10%新生小牛血清DME M培养液 200μL,另设不加药物的阴性对照组。置5%CO2孵箱内培养72 h。在倒置显微镜下观察细胞生长状态。
1.4.4 TUNEL染色
取经 160 mg/L大豆皂苷作用 72 h的细胞爬片,按试剂盒操作说明进行处理,光镜下观察凋亡细胞并计数。染色后细胞核呈棕褐色的细胞被判为凋亡细胞。随机选取 5个高倍镜视野,分别计数凋亡细胞数和总细胞数,计算凋亡指数(A I)。
A I=(凋亡细胞数 /总细胞数)×100%。
1.4.5 统计学分析
2 结果与分析
2.1 大豆皂苷的提取结果
大豆胚轴提取粉用正丁醇萃取,得到总糖苷粗品,含大豆异黄酮 19.4%和皂苷 58.1%。总糖苷用30%甲醇充分溶解后上 C18层析柱,依次用 30%、50%和 80%甲醇梯度洗脱,可按极性大小将大豆异黄酮、A类皂苷与B类皂苷分开,使其依次分别分布在 F30、F50和 F80中 (表 1)。试样 F30为较纯的异黄酮样品,其异黄酮主要形式为丙二酰化糖苷;F50含A类双糖链皂苷 80.1%,另含少量异黄酮糖苷;F80含 B类单糖链皂苷 72.7%,与常温提取相比,F80中DDMP皂苷明显减少。这可能与DDMP结构的加热降解有关,DDMP皂苷是天然存在的大豆皂苷形式,加热提取使DDMP皂苷中的DDMP结构以麦芽醇形式水解脱离,剩余部分转化为B类皂苷。

表1 C18柱层析分离大豆总糖甙结果
2.2 对 HT-29细胞增殖的影响
不同质量浓度皂苷处理组分别培养 24、48和72 h时,大豆皂苷 A和 B对 HT-29细胞生长均有抑制作用(P<0.01,表 2)。二者对肿瘤细胞生长的抑制率呈时间和浓度依赖性,随着时间的延长和浓度的增加,抑制效果更明显。但二者对结肠癌细胞增值的抑制率却无明显差异 (P>0.05,表 2),且非常接近于大豆总皂苷提取物的抑制效果。
表 2 大豆皂苷对 HT-29细胞增殖的抑制作用(±s)
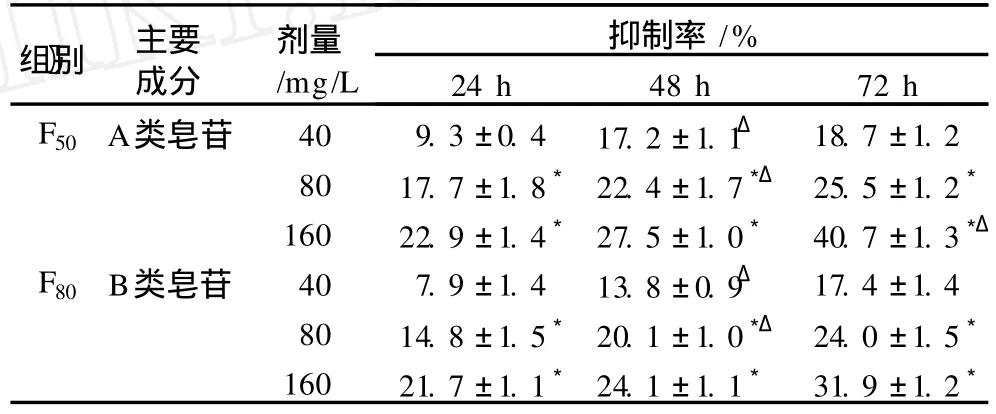
表 2 大豆皂苷对 HT-29细胞增殖的抑制作用(±s)
注:同一时间时与前一剂量相比,3表示 P<0.01;同一浓度时与前一时间相比,Δ表示 P<0.01
抑制率/%剂量/mg/L〗组别 主要成分24 h 48 h 72 h F50A类皂苷 40 9.3±0.4 17.2±1.1Δ18.7±1.2 80 17.7±1.8322.4±1.73Δ25.5±1.23160 22.9±1.4327.5±1.0340.7±1.33ΔF80B类皂苷 40 7.9±1.4 13.8±0.9Δ17.4±1.4 80 14.8±1.5320.1±1.03Δ24.0±1.53160 21.7±1.1324.1±1.1331.9±1.23
2.3 HT-29细胞的形态学观察
图 1为对照组和大豆皂苷 A处理组的 HT-29细胞光镜照片。倒置显微镜观察显示对照组 HT-29细胞生长旺盛,折光率高,胞体大。大豆皂苷A和B处理组则均表现为细胞增殖减慢,折光率减弱,变小浮起,部分脱落漂浮于培养瓶中,但细胞膜完整。大豆皂苷组作用时间越长,上述表现越明显。

图1 HT-29细胞形态学改变
2.4 对 HT-29细胞凋亡的影响
用大豆皂苷处理细胞 72 h后,细胞凋亡数明显增加,棕褐色染色颗粒定位于细胞核内。大豆皂苷组凋亡指数与对照组相比,差异均具有统计学意义(P<0.01,表 3)。
表 3 大豆皂苷对 HT-29细胞凋亡的影响(±s)

表 3 大豆皂苷对 HT-29细胞凋亡的影响(±s)
注:与前一时间相比,3表示 P<0.01
组别 主要成分 凋亡指数/% 24 h 48 h 72 h F50A类皂苷 4.7±1.5 10.7±0.7312.9±1.0 F80B类皂苷 5.4±1.7 9.4±0.8314.2±0.93
3 讨论与结论
在大豆胚轴中异黄酮和皂苷主要以糖苷形式存在,只有极少量异黄酮以游离苷元形式存在。利用大豆异黄酮皂苷的此组成特点,首先采用 C18反相柱层析法分离大豆胚轴中异黄酮糖苷和 A类、B类皂苷。抽提总皂苷时采用加热提取方法,与常温提取相比,加热法提取的分级产物中 B类皂苷含量大大增高,而DDMP皂苷明显减少。这可能与DDMP皂苷的加热降解有关。DDMP皂苷是天然存在的真正大豆皂苷,加热提取使DDMP皂苷中的DDMP结构以麦芽醇形式水解脱离,剩余部分转化为 B类皂苷。
细胞凋亡普遍存在于大多数肿瘤组织细胞中,与肿瘤的发生、发展及退化有密切的关系[13]。大多数抗肿瘤药物都能诱导敏感肿瘤细胞发生凋亡,并且其抗肿瘤效能与肿瘤细胞在药物诱导下发生细胞凋亡的活性有关。因此,诱导瘤细胞凋亡已成为肿瘤治疗的一个新热点,评价疗效的一项新指标[14]。本试验中MTT结果显示大豆皂苷 A和 B均对结肠癌细胞的增殖具有明显的抑制作用。其细胞生长抑制随着药物浓度的升高和时间的延长而增加,具有量效和时效关系。倒置显微镜观察及TUNEL检测结果说明,大豆皂苷 A和 B均可诱导结肠癌 HT-29细胞凋亡,这可能是大豆皂苷抑制结肠癌作用的机制之一。试验结果还显示,在本试验所用浓度范围内,大豆皂苷A和B对结肠癌细胞增值的抑制作用不显示明显差异。不同结构大豆皂苷的抗结肠癌作用与其皂醇及糖链结构的关系需进一步的研究。
[1]Konoshi ma T.Anti-tumor-promoting activities or triterpe2 noid glycosides;cancer chemoprevention by saponins[J]. Advances in ExperimentalMedicine and Biology,1996,404: 87-100
[2]RodriguesHG,Diniz YS,Faine LA,et al.Antioxidant effectof saponin:potential action of a soybean flavonoid on glucose tolerance and risk factors for atherosclerosis[J].International Journal of Food Sciences and Nutrition,2005,56(2):79-85
[3]YoshikoshiM,Yoshiki Y,Okubo K,et al.Prevention of hy2 drogen peroxide damage by soybean saponins to mouse fibro2 blasts[J].PlantaMedica,1996,62(3):252-255
[4]Hayashi K,Hayashi H,Hiraoka N,et al.Inhibitory activity of soyasaponin IIon virus replication in vitro[J].Planta Medi2 ca,1997,63(2):102-105
[5]Kinjo J,I magire M,Udayama M,et al.Structure-hepatopro2 tective relationships study of soyasaponins I-I V having so2 yasapogenolB as aglycone[J].Planta Medica,1998,64(3): 233-236
[6]郁利平,江曼涛,赵清池,等.大豆皂甙的抑瘤效应[J].白求恩医科大学学报,1992,18(4):333-335
[7]郁利平,鹿馨,赵清池.大豆皂甙对 P815肿瘤细胞 DNA合成的影响[J].实用肿瘤学杂志,1992,6(1):59-60
[8]SungMK,Kendall CW,Rao AV.Effect of soybean saponins and gypsophila saponin on morphology of colon carcinoma cells in culture[J].Food and Chemical Toxicology,1995,33 (5):357-366
[9]Ki m HY,Yu L,Kim JS,et al.Antiproliferative crude soy sap2 onin extract modulates the expression of IkappaBalpha,pro2 tein kinase C,and cyclooxygenase-2 in human colon cancer cells[J].CancerLetter,2004,210(1):1-6
[10]EllingtonAA,BerhowM,Singletary K W.Induction ofmacro2 autophagy in human colon cancer cells by soybeanB-group triterpenoid saponins[J].Carcinogenesis,2005,26(1):159 -167
[11]Ellington AA,Berhow M,Singletary K W.Inhibition of Akt signaling and enhanced ERK1/2 activity are involved in in2 duction ofmacroautophagy by triterpenoid B-group soyasa2 ponins in colon cancer cells[J].Carcinogenesis,2006,27 (2):298-306
[12]全吉淑,尹学哲,工藤重光.大豆胚轴中大豆皂甙的提取及其对α-葡萄糖苷酶的抑制作用 [J].食品研究与开发,2006,27(10):4-6
[13]Melet A,Song K,Bucur O,et al.Apoptotic pathways in tumor progression and therapy[J].Advances in Experi men2 talMedicine and Biology,2008,615:47-79
[14]Tan TT,White E.Therapeutic targeting of death pathways in cancer:mechanis ms for activating cell death in cancer cells [J].Advances in Experi mental Medicine and Biology, 2008,615:81-104.
Effect of Soya Saponin A and B on Proliferation and Apoptosis of Colon Carcinoma Cell
Sun Quan Li Tian Xu Huixian Quan Jishu
(Medical College Yanbian University,Yanji 133000)
Soya saponins were isolated from soybean hypocotyl with C18 reversed phase column chromatogra2 phy,then their effect on proliferation and apoptosis of colon carcinoma cellwas investigated.MTT assaywas used to examine the proliferation of HT-29 cell,and TUNEL method was used for analysis of cell apoptosis.Results:Soya saponins inhibit the proliferation and induce the apoptosis of colon carcinoma cells in a time-and concentrationdependentmanner.It is suggested that soya saponins could exert an anti-colon cancer effect via inducement of ap2 optosis.
soybean,saponins,colon cancer,apoptosis
TS201.3 文献标识码:A 文章编号:1003-0174(2010)03-0026-04
吉林省科技发展计划(200705428)
2009-04-02
孙权,男,1959年出生,高级实验师,生物化学与分子生物学
全吉淑,女,1968年出生,副教授,分子肿瘤学
