产赤藓糖醇菌株的筛选与鉴定
2010-10-19王泽南张秋子吴红引
刘 鹏,王泽南*,苏 娅,李 莹,张秋子,吴红引
(合肥工业大学生物与食品工程学院,安徽 合肥 230009)
产赤藓糖醇菌株的筛选与鉴定
刘 鹏,王泽南*,苏 娅,李 莹,张秋子,吴红引
(合肥工业大学生物与食品工程学院,安徽 合肥 230009)
利用含有300g/L葡萄糖的高渗培养基从蜂蜜、花粉、土壤等样品中筛选耐高渗酵母菌,经薄层层析和高效液相色谱分析得到两株产赤藓糖醇且不产甘油的酵母菌,通过高碘酸氧化法筛选出其中赤藓糖醇产量较高的一株菌株E54。菌株E54在含葡萄糖200g/L、酵母膏5g/L的发酵培养基中发酵90h,赤藓糖醇产量为41.1g/L,转化率为22.8%。通过形态观察、生理生化实验、5.8S rDNA序列分析并构建系统进化树,初步鉴定E54为Moniliella acetoabutans(丛梗孢酵母)。
赤藓糖醇;筛选;鉴定;丛梗孢属;系统进化树
Abstract:Osmophilic yeasts were isolated from honey, pollen and soil by using the medium containing 30% glucose. Two strains producing erythritol but not producing glycerol were identified by thin layer chromatography (TLC) and high performance liquid chromatography (HPLC). Strain E54 with high ability to produce erythritol was selected by periodic acid oxidation method.The productivity and conversion rate of erythritol were 41.1 g/L and 22.8% after fermentation for 90 h using strain E54 in the medium containing 20% glucose and 0.5% yeast extract. This strain was identified asMoniliella acetoabutansthrough the analyses of morphological, physiological and biochemical characteristics, 5.8S rDNA sequence and the established phylogenetic tree.
Key words:erythritol;screening;identification;Moniliella;phylogenetic tree
赤藓糖醇是一种新型甜味剂,它有着热量值很低、耐受量高、非致龋齿特性[1]、抗氧化活性[2]等优良特性。因此,赤藓糖醇越来越受到人们的关注,其生产能力和市场规模正日益扩大。
赤藓糖醇在工业上主要由微生物发酵而得,国外在产赤藓糖醇菌株的选育方面研究较早[1]。1957年Spencer等[3]发现一些耐高渗酵母可以产甘油、赤藓糖醇和阿拉伯糖醇。1964年Hajny等[4]筛选到一株产赤藓糖醇Torulopsis属酵母。1989年Ishizuka等[5]筛选到菌株Aureoasidiumsp. SN-115。其后筛选到的产赤藓糖醇的菌株有Trichosporon属[6]、Candida属[7]、Moniliella属[8]等。我国对赤藓糖醇的研究起步较晚,公开报道的有南京化工大学的徐虹等[9]筛选到一株耐高渗酵母T-9,江南大学的范光先等[10]筛选出一株球拟酵母OS-194,江苏微生物研究所的吴燕等[11]筛选到一株圆酵母B845,山东农业大学的叶娴等[12]筛选出一株球拟酵母K-23。目前日本、韩国等国对赤藓糖醇的开发利用较多,用于商业的主要是日本Aureobasidiumsp.变异株和韩国的Candida magnoliae[13]。国内筛选的菌株大都还停留在实验室研究阶段,产量较低,因此筛选出赤藓糖醇高产菌株显得极为必要。本研究从花粉、蜂蜜、土壤等样品中筛选赤藓糖醇高产株,并对其进行鉴定,为后续的菌种改良以及赤藓糖醇工业化生产提供科学依据。
1 材料与方法
1.1 材料与试剂
土壤、蜂蜜和花粉采集于合肥周边果园和蜂场。
葡萄糖、赤藓糖醇、联苯胺、高碘酸钠、变色酸、丙酮、氯化亚锡等均为分析纯;琼脂粉、酵母膏等为生化试剂。
1.2 仪器与设备
SW-CJ-1F超净工作台 苏州净化设备有限公司;722E型可见分光光度计 上海光谱仪器有限公司;液相色谱工作站 美国Waters公司;JSM-6700F扫描电子显微镜 日本电子公司。
1.3 方法
1.3.1 培养基和培养方法
富集培养基:葡萄糖300g/L、酵母膏5g/L;平板和斜面培养基:葡萄糖200g/L、酵母膏5g/L、琼脂30g/L;发酵培养基:葡萄糖200g/L、酵母膏5g/L[8]。
富集培养:在装液量为20%、30℃、180r/min的条件下摇床培养3d;平板培养:在恒温培养箱中30℃培养2d;斜面培养:在恒温培养箱中30℃培养2d后冰箱保藏;摇瓶发酵:在装液量为10%、30℃、180r/min的条件下摇床培养90h[14]。
1.3.2 产赤藓糖醇菌株的初筛
将样品稀释后富集培养,用高渗平板筛选出耐高渗酵母。将筛选出来的耐高渗酵母摇瓶培养48h,用薄层层析法[15]初步鉴定发酵液中是否含有赤藓糖醇,再通过高效液相色谱做进一步的确定。
薄层层析展开剂为正丁醇-乙酸-水,体积比4:1:1;显色液A(0.1%高碘酸钠溶液);显色液B(2.8g联苯胺溶于80mL 95%乙醇,70mL蒸馏水,30mL丙酮,1.5mL盐酸,静置12h备用)。
高效液相色谱法:色谱柱为Cosmosil Sugar-D糖柱(4.6mm×250mm,5μm);洗脱剂为乙腈、水(体积比80:20);流速1.0mL/min;柱温30℃;Waters 515泵;检测器为Waters 2420检测器(ELSD,蒸发光检测器);增益值(gain) 100;气压25psi;漂移管温度(tube temp)55℃;喷雾器级别60%。
1.3.3 产赤藓糖醇菌株的复筛
发酵液中赤藓糖醇含量的测定方法为高碘酸氧化法,残糖的测定方法为3,5-二硝基水杨酸法。复筛以赤藓糖醇含量和转化率为依据,筛选出发酵性能较优菌株。
高碘酸氧化法:参见文献[16]。3,5-二硝基水杨酸法:参见文献[17]。

1.3.4 菌株鉴定
细胞形态观察:将试管斜面中的菌落制成菌悬液,经过清洗、固定、脱水、干燥、镀金后,用扫描电镜观察[18]。菌落形态的观察:参见文献[14]。生理生化实验:参见文献[19]。5.8S rDNA序列测定:交由上海生物工程有限公司测定。系统进化树的分析:软件MEGA4.1。
2 结果与分析
2.1 产赤藓糖醇菌株的初筛
2.1.1 发酵液薄层层析结果
赤藓糖醇的Rf值约为0.25,展开斑点为白色,甘油Rf值约为0.35,展开斑点为黄色,两者分离效果和重现性都很好。从样品中筛选出4株产赤藓糖醇菌株E21、E28、E51和E54,其薄层层析结果见表1。

表1 薄层层析结果Table 1 Results of thin layer chromatographic separation of fermentation broths of four selected strains
由于菌株E51和E54在层析板上的赤藓糖醇斑点较大且没有甘油斑点,说明其赤藓糖醇含量较高,且没有副产物甘油。因此选择菌株E51和E54通过高效液相色谱做进一步的确定。
2.1.2 发酵液高效液相图谱
将菌株E51和E54的48h发酵液稀释后通过高效液相色谱做进一步的判定,其高效液相色谱图见图1。
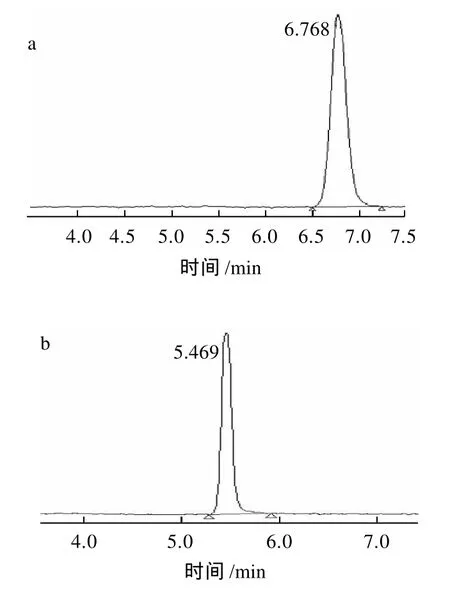

图1 高效液相色谱结果Fig.1 HPLC profiles of erythritol and glycerol standards and fermentation broths of strains E51 and E54
由图1a和b可以看出赤藓糖醇的保留时间约为6.8min,甘油的保留时间约为5.5min。由图1c和d可知菌株E51和E54的发酵液中含有赤藓糖醇,不含甘油。其与薄层层析所得结果一致。因此,选择菌株E51和E54做进一步的筛选。
2.2 产赤藓糖醇菌株的复筛
将菌株E51和E54摇瓶发酵90h后测定发酵液中赤藓糖醇和残糖含量,取平均值,测定结果见表2。

表2 菌株E51和E54发酵结果(n=3)Table 2 Comparative fermentation results obtained using strains E51 and E54 (n=3)
从表2可以看出,菌株E54发酵性能稳定,发酵90h后赤藓糖醇含量达到41.1g/L,转化率达到了22.8%,均比E51要高。国内筛选的原始菌株中产量较高的K-23[12]发酵144h后赤藓糖醇产量为46.8g/L,转化率为23.4%,E54与之相比发酵时间相对较短的情况下,产量处于较高水平。因此选择菌株E54作为赤藓糖醇的生产菌株。
2.3 菌株鉴定
2.3.1 E54细胞形态和菌落形态
图2a显示E54细胞为不规则球形、椭圆形,直径约为4~5μm,出芽生殖,呈串状排列,较老细胞表面散布着一些凸出物。图2b显示E54菌落形态较干,白色不透明,不光滑,表面有皱褶,边缘不规整。根据文献[8]和[19],通过观察发现菌株E54的细胞和菌落形态与Moniliella属、Trichosporon属、以及Candida属较为接近。
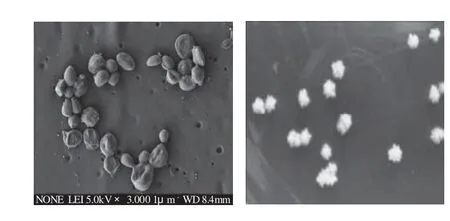
图2 菌株E54的细胞形态和菌落形态Fig.2 Morphology and colony of strain E54
2.3.2 生理生化实验

表3 菌株E54的生理生化特性实验结果与比较Table 3 Comparisons of physiological and biochemical properties of strain E54,Moniliella,TrichosporonandCandida
如表3所示,菌株E54的一些关键生理生化实验结果与Moniliella属一致,而与Trichosporon属有明显的不同,与Candida属无法判断。
2.3.3 5.8S rDNA序列分析及构建系统发育树
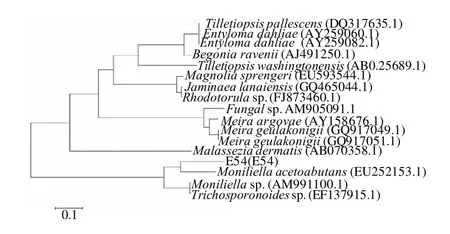
图3 菌株E54的系统发育树Fig.3 Phylogenetic tree of strain E54
克隆所得的E54的5.8S rDNA序列全长为440bp,将结果在GenBank中进行同源系列搜索。根据同源序列搜索结果,下载相似性较高的酵母菌菌种的相关序列进行分析。采用Neighbor-Joining法进行分子系统学分析,构建系统发育树(图3)。结果表明,筛选菌株E54和Moniliella acetoabutans(EU252153.1)的遗传距离最近,且核苷酸序列同源性达到了98%,因此可以认为E54属于Moniliella acetoabutans(丛梗孢酵母)。
3 结 论
经高渗培养基的筛选及薄层层析和高效液相色谱的分析,从花粉中筛选到产赤藓糖醇不产甘油的菌株E51和E54。由高碘酸氧化法复筛得到高产株E54。菌株E54在含葡萄糖200g/L、酵母膏5g/L的发酵培养基中培养90h后,赤藓糖醇产量达到41.1g/L,转化率为22.8%。其在发酵时间相对较短的情况下赤藓糖醇的产量处于较高的水平,是一株较好的生产菌株。
细胞形态、菌落形态观察和生理生化实验结果显示菌株E54与Moniliella属酵母菌一致,5.8S rDNA序列分析及系统发育树显示,菌株E 54和Moniliella acetoabutans(EU252153.1)最为接近,因此可以初步鉴定E54属于Moniliella acetoabutans(丛梗孢酵母)。
[1] 金树人. 糖醇生产技术与应用[M]. 北京:中国轻工业出版社, 2008:87-90.
[2] DEN H J M, BOOTS A W, PERROT A A, et al. Erythritol is a sweet antioxidant[J]. Nutrition, 2010, 26(4):449-458.
[3] SPENCER J F T, ROXBURGH J M, SALLANS H R. Factors influencing the production of polyhydric alcohols by osmophilic yeasts[J].Journal of Agricultural and Food Chemistry, 1957, 5(1):64-67.
[4] HAJNY G J, SMITH J H, GARVER J C. Erythritol production by a yeastlike fungus[J]. Appl Environ Microbiol, 1964, 12(3):240-246.
[5] ISHIZUKA H, WAKO K, TAKAFUMI K, et al. Breeding of a mutant ofAureobasidiumsp. with high erythritol production[J]. Journal of Fermentation and Bioengineering, 1989, 68(5):310-314.
[6] PARK J, SEO B, KIM J, et al. Production of erythritol in fed-batch cultures ofTrichosporonsp.[J]. Journal of Fermentation and Bioengineering, 1998, 86(6):577-580.
[7] YANG S W, PARK J B, HAN N S, et al. Production of erythritol from glucose by an osmophilic mutant ofCandida magnolia[J]. Biotechnology Letters, 1999, 21:887-890.
[8] LIN Shiejea, WEN Chiouyen, LIAU Jianching, et al. Screening and production of erythritol by newly isolated osmophilic yeast-like fungi[J]. Process Biochemistry, 2001, 36:1249-1258.
[9] 徐虹, 周基化, 欧阳平凯. 赤藓糖醇产生菌的筛选[J]. 南京化工大学学报, 1995, 17(增刊1):14-17.
[10] 范光先, 张海平, 诸葛健. 耐高渗酵母产赤藓糖醇的影响因素[J]. 无锡轻工大学学报, 2001, 20(2):133-136.
[11] 吴燕, 杨晓伟, 陆茂林. 赤藓糖醇产生菌B845的形态生理特征[J]. 生物技术, 2002, 12(2):17-20.
[12] 叶娴, 董海洲, 侯汉学, 等. 赤藓糖醇高产菌株的筛选鉴定及发酵特性的初步研究[J]. 生物技术, 2007, 17(5):54-57.
[13] 徐莹, 李景军, 何国庆. 赤藓糖醇研究进展及在食品中的应用[J]. 中国食品添加剂, 2005(3):92-95.
[14] 沈萍, 陈向东. 微生物学实验[M]. 4版. 北京:高等教育出版社, 2008:9-28.
[15] 刘俊梅, 胡耀辉. 薄层层析在多元醇检测中的应用[J]. 食品科技, 2007(6):224-226.
[16] 袁野, 应向贤, 范光先, 等. 高碘酸氧化法直接测定发酵液中赤藓糖醇[J]. 无锡轻工大学学报, 2000, 19(1):72-75.
[17] 杨建雄. 生物化学与分子生物学实验技术教程[M]. 2版. 北京:科学出版社, 2009:30-32.
[18] 郭素枝. 扫描电镜技术及其应用[M]. 厦门:厦门大学出版社, 2006:78-93.
[19] BARNETT J A. 酵母菌的特征与鉴定手册[M]. 青岛:青岛海洋大学出版社, 1991:20-24.
Screening and Identification of Erythritol-producing Strains
LIU Peng,WANG Ze-nan*,SU Ya,LI Ying,ZHANG Qiu-zi,WU Hong-yin
(School of Biotechnology and Food Engineering, Hefei University of Technology, Hefei 230009, China)
Q93.331
A
1002-6630(2010)21-0308-04
2010-07-19
安徽省教育厅重点项目(Kj2010A276)
刘鹏(1987—),男,硕士研究生,研究方向为生物资源综合利用。E-mail:liupeng2244@gmail.com
*通信作者:王泽南(1947—),男,教授,本科,研究方向为农产品加工与贮藏。E-mail:wznan@ah163.com
