二硫键稳定的抗氯霉素单链抗体的构建
2010-10-19李黄金柴伟佳
李黄金,陈 伟,赵 林,柴伟佳,唐 伟
(广东药学院生命科学与生物制药学院,广东 广州 510006)
二硫键稳定的抗氯霉素单链抗体的构建
李黄金,陈 伟,赵 林,柴伟佳,唐 伟
(广东药学院生命科学与生物制药学院,广东 广州 510006)
为构建一种食品残留检测用二硫键稳定的抗氯霉素单链抗体(sdsFvCAP)。以抗氯霉素抗体可变区基因为模板,通过引物突变PCR在轻链和重链的可变区分别引入一个半胱氨酸定点突变,以重叠延伸PCR组装成sdsFvCAP。在大肠杆菌系统强启动子T7驱动下,sdsFvCAP基因不能单独表达,而通过同义突变降低其5'端序列GC含量则可实现高效表达。表达产物主要以包涵体形式存在,经β-环糊精分子伴侣系统复性可获得亲和力与母本抗体相似的sdsFvCAP。所构建的sdsFvCAP具有取代单克隆抗体用于氯霉素残留检测的潜力。
氯霉素;二硫键稳定的单链抗体;高效表达;β-环糊精分子伴侣;复性
Abstract:To construct a disulfide-stablized single chain variable fragment directed against chloramphenicol (sdsFvCAP), both cloned V genes were introduced a cystine code by site-specific mutagenesis, then assembled into sdsFvCAP gene by overlap extension PCR. Under the control of strong promoter T7, the sdsFvCAP gene was failed to be individually expressed inEscherichia coli, but over-expressed as inclusion when GC content in the terminal 5 sequence was decreased by synonymous mutation. The inclusion protein was refolded withβ-cyclodextrin companion system, and showed affinity similar to its parent monoclonal antibody(MAb). The sdsFvCAP prepared in this study could be potentially used instead of conventional antisera or MAb for development of a rapid and affordable immunoassay for the detection of residual CAP in foods.
Key words:chloramphenicol;disulfide-stablized single chain variable fragment;over-expression;β-cyclodextrin companion;renaturation
氯霉素(chloramphenicol,CAP)是一种可引起人类再生障碍性贫血粒状白细胞缺乏症等严重疾病的抗生素,自1994年起便被联合国禁止使用,我国亦自2002年起明确规定动物源性食品中氯霉素残留不得检出[1],但由于廉价高效,目前仍被广泛非法滥用于养殖业,给人民生命健康和我国动物源性食品相关产品的出口贸易带来了较大的挑战。特异性抗体在食品有害残留检测中具有重要意义,高质量的抗体是食品有害残留样品的制备和检测的关键试剂[2]。单克隆抗体(MAb)具有特异性强和亲和力高的优点,但其现有生产技术存在生产成本高、规模难于工业放大和质控等缺点。基因工程小分子抗体是单克隆抗体的理想替代产品,目前已有众多兽药和农药类小分子半抗原的基因工程抗体的报道[3-5]。单链抗体(scFv)是一种以柔性接头连接抗体重链和轻链可变区的小分子基因工程抗体,该类抗体既保留了母本抗体的亲和力又便于基因工程手段生产,故得到了较广泛的研究和应用。但该类抗体的两个可变区之间由于缺乏母本抗体那样的链间二硫键,因此稳定性较差。二硫键稳定的单链抗体(sdsFv)即是通过模拟天然抗体的结构而在单链抗体基础上引入一对二硫键的构建形式[6]。本实验组曾报道了抗氯霉素单克隆抗体可变区基因的克隆[7],本实验在此基础上研究一种二硫键稳定的抗氯霉素单链抗体(sdsFvCAP)的构建,为进一步研制基于基因工程抗体技术的氯霉素残留检测试剂提供参考,同时对其他种类和用途的sdsFv的构建与生产具有重要参考价值。
1 材料与方法
1.1 材料
抗CAP Mab粗制品、含抗CAP的VH(FJ477893)和VL(FJ477894)基因的质粒pMD18-T-VH与 pMD18-T-VL、氯霉素-卵清蛋白偶联物(CAP-OVA)、大肠杆菌DH5α 本实验制备或保存。大肠杆菌BL21(DE3)、表达载体pET21a和pET32a Novagen公司;pMD18-T、Taq酶、限制性内切酶、T4DNA连接酶、DNA lader、TaKaRa MutanBEST Kit 大连宝生物工程有限公司;DNA回收试剂盒 百泰克生物技术有限公司;HisTrap FF柱(1mL)、HiTrap Protein G柱(1mL)、HRP-anti-His6 tag、HRP-goat-anti-mouse IgG、Sephadex G25 GE公司;BCA试剂盒 广州美津生物技术有限公司。
1.2 引物设计与合成
V基因定点突变用引物:VH-m1:5'-TTCAGGGA'(下划线处为 Cys 密码子);VH-m2:5'-GACTGACGAATCCAGCCTACACT-3';VL-m1:';VL-m2:5'-GTCGGAGGAACATGTGAACCTT-3'。sdsFvCAP组装用引物:A(VH5'):CAGCTGAAGGAGTC-3'(下划线处为NdeⅠ识别位点);B(VH3'-linker):5'-GCCACCACCGCCGCTACC ACCGCCGCCGCTACCGCCACCACCGGCTGAGGAG-3';C(linker-VL5'):5'-GTGGCGGTAGCGGCGGCG GTGGTAGCGGCGGTGGTGGCAGCGATGTTTTGATGAC-3';D(VL3'):5TGATGATGATGAGCCCGTTTGATTTCCAGCT-3'(下划线处为HindⅢ识别位点,序列中引入了His6标签的编码序列);E:5CTGAAGGAGTC-3'(下划线处为NcoⅠ识别位点)。所有引物均由上海英俊生物技术有限公司合成。
1.3 V基因定点突变
采用TaKaRa MutanBEST Kit按厂家说明进行。VH突变模板为pMD18-T-VH,引物为VH-m1和VH-m2;VL突变模板为pMD18-T-VL,引物为VL-m1和VL-m2。
1.4 sdsFvCAP基因组装与克隆
以上述突变VH和VLPCR产物为模板,以引物A与B扩增VH-linker,以引物C与D扩增linker-VL。PCR反应参数为94℃ 5min;94℃ 30s,55℃ 30s,72℃ 30s,共25个循环;72℃ 7min。扩增产物以1g/100mL琼脂糖凝胶电泳分离后用DNA回收试剂盒按照厂家说明书进行目的片段回收。回收片段经适当稀释后进行下述二步扩增反应:第一步,VH-linker和linker-VL进行重叠延伸,反应条件为94℃ 5min;94℃ 1min,72℃ 1.5min,共5个循环;第二步,以引物A和D或E和D配对进行常规PCR扩增,反应条件为94℃ 5min,94℃ 30s,60℃30s,72℃ 1.5min,共25个循环,72℃ 7min。A~D引物对扩增产物以NdeⅠ和HindⅢ双酶切后按常规方法[8]克隆于表达载体pET21a的相同位点,得表达载体pET21asdsFvCAP;E~D引物对扩增产物以NcoⅠ和HindⅢ双酶切后克隆于pET32a的相同位点,得融合表达载体pET32a-sdsFvCAP。所有表达载体的构建均以大肠杆菌DH5α为宿主菌,所获表达载体委托深圳华大基因有限公司进行目的基因表达盒序列分析。经序列分析确证后的表达载体质粒转化表达宿主菌大肠杆菌BL21(DE3),得sdsFvCAP工程菌。
1.5 sdsFvCAP基因表达诱导
sdsFvCAP工程菌接种于含50μg/mL氨苄青霉素的LB培养基,37℃振荡培养过夜,按体积分数1%转接新鲜LB培养基,继续培养2.5h,加入IPTG至终浓度1mmol/L进行表达诱导,共诱导4h,6000r/min离心5min收集菌体。
1.6 sdsFvCAP包涵体蛋白分离纯化
经表达诱导所获菌体按10 g/100 mL悬浮于含500mmol/L NaCl的20mmol/L磷酸钠缓冲液(pH7.5),于冰浴中以300W输出功率间歇式超声破碎10min,12000r/min离心10min。所获沉淀分别用含体积分数2% Triton X100、500mmol/L NaCl和不同浓度尿素的20mmol/L Tris-HCl缓冲液(pH8.0)洗涤,最后所获离心沉淀按湿质量的1g/100mL悬浮于变性缓冲液(含8mol/L尿素、1%β-巯基乙醇和500mmol/L NaCl的20mmol/L Tris-HCl缓冲液,pH8.0),37℃水浴3h,12000r/min离心10min,所获上清以HisTrap FF柱参照厂家说明进一步纯化,其中平衡缓冲液为含20mmol/L咪唑的变性缓冲液,洗脱缓冲液为含300mmol/L咪唑的变性缓冲液。
1.7 sdsFvCAP包涵体蛋白的复性
变性的目的蛋白参照β-环糊精人工伴侣系统[9]以含18mmol/Lβ-环糊精的20mmol/L Tris-HCl缓冲液(pH8.0)进行稀释复性,稀释后的蛋白质溶液中SDS的终浓度控制为2mmol/L,β-环糊精的终浓度为8mmol/L。稀释液在室温下磁力搅拌过夜。以0.45μm纤维素膜过滤法去除可见沉淀,以Sephadex G25柱按30%上样体积将上述复性产物的缓冲液置换为20mmol/L磷酸钠缓冲液(pH7.5)。
1.8 蛋白质SDS-PAGE与凝胶扫描分析
参照常规方法进行各种样品的SDS-PAGE。菌体培养物或纯化过程中的蛋白样品以两倍上样缓冲液煮沸5min,还原电泳上样缓冲液不含β-巯基乙醇。电泳所获凝胶以“天能牌”凝胶密度扫描仪按厂家说明进行拍照和表达水平或蛋白质纯度分析。
1.9 蛋白质浓度测定
采用BCA试剂盒参照厂家说明进行,以小牛血清白蛋白为标准品。
1.10 抗体亲和力常数测定
参照Batty等[10]非竞争性ELISA法进行,以sdsFvCAP样品和母本单抗4D10平行分析,酶标二抗分别为HRP-anti-His6tag和HRP-goat-anti-mouse IgG。为使母本单抗与待测sdsFvCAP样品纯度基本一致,将抗CAP Mab粗制品(经辛酸硫酸铵法制备)以HiTrap Protein G柱按照厂家说明书进行纯化,其中柱平衡缓冲液为20mmol/L磷酸钠缓冲液(pH7.4),洗脱缓冲液为100mmol/L的甘氨酸-HCl(pH2.7),目的峰样收集于预置中和缓冲液1mol/L Tris-HCl(pH9.0)。亲和力常数测定时以1、2μg/mL和4μg/mL 3个不同质量浓度的CAP-OVA(抗原)包被酶标板,供试抗体经浓度测定后倍比稀释。以抗体的浓度(mol/L)为横坐标、以OD450nm值为纵坐标作图,找出其ODmax值,并求出OD450nm=1/2ODmax时相对应的抗体浓度[Ab]'1/2,按公式Ka=(n- 1)/[2(n[Ab]'1/2-[Ab]1/2)]分别求出两种抗原浓度之间的Ka值,其中n为抗原高低浓度之比,[Ab]'1/2为较低浓度抗原对应的[Ab]1/2。所得3个Ka值的算术平均值即为抗体的亲和常数,单位为浓度的倒数,即L/mol。
2 结果与分析
2.1 V基因突变与组装
通过定点突变技术在抗氯霉素抗体VH和VL基因中引入半胱氨酸密码子,突变V基因经测序确证后采用重叠延伸PCR法组装成VH-linker-VL型sdsFvCAP,其中的linker序列为(Gly4Ser)3。突变的氨基酸残基位点如图1所示,VH的突变位点为第2框架区的第49位氨基酸,与Kabat数据库VH的保守序列第44位氨基酸残基相对应;VL的突变位点为第4框架区的第120位氨基酸,与VL的保守序列第100位氨基酸残基相对应[11]。

图1 抗氯霉素抗体V区半胱氨酸突变位点Fig.1 Cysteine site introduced in V region of antibody against chloramphenicol
sdsFvCAP基因组装结果如图2所示,经重叠延伸PCR所得sdsFvCAP基因片段与理论大小一致,大小约为790bp,经序列分析与设计序列一致,定名为sdsFvCAP-1(GenBank:GU258050)。

图2 重叠延伸PCR组装sdsFvCAP-1Fig.2 Overlap extension PCR for sdsFvCAP-1
2.2 sdsFvCAP-1基因克隆与表达
上述s d s FvCAP-1基因组装产物克隆于表达载体pET21a和pET32a,以便在宿主菌大肠杆菌BL21(DE3)中进行独立表达或融合表达。表达诱导结果如图3所示,结果表明,在强启动子T7驱动下,sdsFvCAP-1基因不能有效单独表达,但当其5'端融合于硫氧环蛋白(Trx)基因之后时即可高效表达,表达产物大小约为45kD,与理论值一致。

图3 sdsFvCAP-1基因在大肠杆菌BL21(DE3)中表达Fig.3 Expression of sdsFvCAP-1gene inEscherichia coliBL21(DE3)
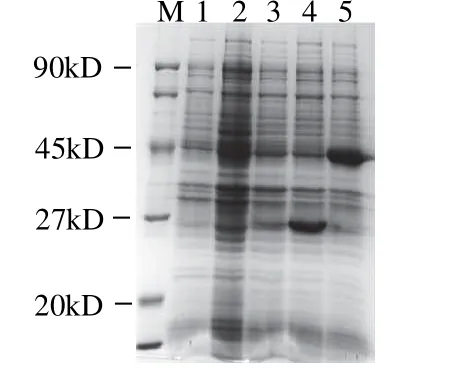
图4 sdsFvCAP-2基因在大肠杆菌BL21(DE3)中表达Fig.4 Expression of sdsFvCAP-2gene inEscherichia coliBL21(DE3)
通过PCR引物对sdsFvCAP-1基因5'端进行同义突变,以便优化目的基因。将30bp序列内所有密码子中的第3位碱基G或C全部置换成A或T,得到同义突变型基因sdsFvCAP-2(GenBank:GU258050)。所获sdsFvCAP-2基因5'端30bp序列内的GC含量由60%降至36%,克隆于表达载体pET21a后独立表达时即可高效表达(图4),表达产物大小约为28kD,与理论值一致,表达水平与融合表达相似,达到30%以上。
2.3 sdsFvCAP-2基因表达产物分离纯化与分析

图5 sdsFvCAP-2基因表达产物分离纯化Fig.5 Purification of product of scFvCAP-2gene expressed inEscherichia coliBL21(DE3)
如图5所示,sdsFvCAP-2基因表达产物主要以包涵体蛋白存在,因为目的大小的蛋白主要出现在菌体超声破碎沉淀中。包涵体经含2mol/L尿素的缓冲溶液简单洗涤后纯度达到90%以上,但所获包涵体蛋白经变性后以HisTrap预装柱进行基于His标签的亲和层析纯化并未见纯度显著提高(结果未给出)。包涵体蛋白可完全被8mol/L尿素溶液裂解,变性蛋白采用常规的稀释复性法复性时绝大部分目的蛋白被聚沉(结果未给出),但采用β-环糊精分子伴侣系统复性未见显著沉淀。所获复性溶液与纯度相近(90%)的母本抗体所进行的平行分析结果表明,sdsFvCAP对氯霉素的亲和力与母本抗体4D10的相似,二者的亲和力常数分别为7.0×10-9L/mol和4.5×10-9L/mol。
3 讨 论
单链抗体(scFv)是目前得到广泛应用的基因工程抗体类型,该类抗体是以(Gly4Ser)3肽将VH和VL片段连接起来而形成的单链小分子抗体。众多的研究结果表明,scFv类小分子抗体拥有与母本单抗相似、甚至更高的亲和力[12-13]。二硫键稳定的单链抗体(sdsFv)是为了提高scFv的稳定而在VH和VL间引入一对二硫键的改良型。目前在sdsFv中的二硫键位置主要是VH44和VL100,分别位于VH的FR2区和VL的FR4,均不是抗原识别位点,所以此处引入二硫键对抗体的亲和力影响不大[14]。通过以KABAT数据库比对单抗V区氨基酸保守序列进行推断,得出先前克隆的抗氯霉素抗体V基因的突变位点为VH49和VL120,并以此为基础构建sdsFvCAP。
与scFv类抗体一样,sdsFv也有VH-linker-VL和VL-linker-VH两种构建形式。有研究表明,以前种形式构建的sdsFv亲和力高于后者形式的,但表达水平远低于后者的[15]。在本研究中所构建的sdsFvCAP-1基因不能独立表达,但当融合于Trx的3'端时可高效表达,表明该基因的5'端序列影响转录或翻译。当通过同义突变将该基因的5'端30bp内的GC含量从60%降低到30%时即实现了高效表达,表明5'端序列GC含量过高是sdsFvCAP-1基因低表达的关键原因,至于是否为所有VH-linker-VL类构建的低表达原因尚需进一步研究。
大肠杆菌高效表达产物一般为不溶的包涵体蛋白,包涵体蛋白的复性是关键工艺之一。sdsFvCAP-2基因表达产物也为包涵体蛋白,当我们对该产物变性后采用常规的稀释复性法进行复性操作时发现绝大部分目的蛋白被聚沉了,这可能与在VH-linker-VL间引入了二硫键有关。当采用β-环糊精分子伴侣系统[9]进行复性时即解决了沉淀问题,所获复性产物的亲和力与母本抗体的基本一致,表明sdsFvCAP蛋白得到了较好的复性。本研究成功构建了二硫键稳定的抗氯霉素单链抗体,为进一步研制氯霉素残留检测用试剂提供参考。
[1] 王伊琴, 包勇敢, 胡烈山, 等. ELISA在检测动物组织氯霉素残留中的应用[J]. 中国农业通报, 2006, 22(4):26-29.
[2] 周宏琛, 闫秋成, 田晓林, 等. 动物源性食品安全快速检测与酶联免疫吸附方法的应用[J]. 肉品卫生, 2005, 25(11):29-32.
[3] YAU K Y, LEE H, HALL J C, et al. Emerging trends in the synthesis and improvement of hapten-specific recombinant antibodies[J]. Biotechnology Advances, 2003, 21(7):599-637.
[4] KRAMER K, HOCK B. Recombinant antibodies for environmental analysis[J]. Anal Bioanal Chem, 2003, 377(3):417-426.
[5] HOOGENBOOM H R. Selecting and screening recombinant antibody libraries[J]. Nature, 2005, 23(9):1105-1116.
[6] NISHI K, ISHIUCHI M, MORIMUNE K, et al. Molecular and immunochemical characteristics of monoclonal and recombinant antibodies selective for the triazine herbicide simetryn and application to environment analysis[J]. J Agric Food Chem, 2005, 53(13):5096-5104.
[7] 李黄金, 赵林, 陈伟, 等. 抗氯霉素抗体可变区基因的克隆与序列分析[J]. 现代预防医学, 2009, 36(24):4655-4658.
[8] SAMBROOK J, FRITSCH E F, MANIATIS T. Molecular cloning:A laboratory manual[M]. 2nd ed. New York:Cold Spring Harbor Laboratory Press, 1989:10-52.
[9] DAVID R, SAMEL H G. Artificial chaperone-assisted refolding of carbonic anhydrase B[J]. Journal of Biological Chemistry, 1996, 271(7):3478-3487.
[10] BATTY J D, BEATTY B G, WLAHOS W G. Measurement of monoclonal antibody affinity by non-competive enzyme immunoassay[J]. J Immunol Methods, 1987, 100(1/2):173-179.
[11] 沈倍奋, 陈志南, 刘民培. 重组抗体[M]. 北京:科学出版社, 2005:270-292.
[12] PAN Ke, WANG Hong, ZHANG Hongbin, et al. Production and characterization of single chain Fv directed againstβ2-agonist clenbuterol[J]. J Agric Food Chem, 2006, 54:6654-6659.
[13] LAUER B, OTTHLEBEN I, JACOBSEB H J, et al. Produnction of a single chain variable fragment antibody against fumonisin B[J]. J Agric Food Chem, 2005, 53(4):899-904.
[14] WHITELEGG N, REES A R. Antibody variable regions:toward a unified modeling method[J]. Methods Mol Biol, 2004, 248:51-91.
[15] ZHENG Lei, GODDARD J P, BAUMANN U, et al. Expression improvement and mechanistic study of the retro-Diels-Alderase catalytic antibody 10F11 by site-directed mutagenesis[J]. Journal of Molecular Biology, 2004, 341(3):807-814.
Construction of Disulfide-Stablized Single Chain Variable Fragment Directed against Chloramphenicol
LI Huang-jin,CHEN Wei,ZHAO Lin,CHAI Wei-jia,TANG Wei
(College of Life Science and Biopharmaceuticals, Guangdong Pharmaceuticals University, Guangzhou 510006, China )
Q81
A
1002-6630(2010)21-0271-04
2010-03-16
广东省科技攻关计划项目(2007A020300007-8);广东药学院科研启动基金项目(2006SMK06)
李黄金(1964—),男,副教授,博士,主要从事基因工程药物与抗体研究。E-mail:lihuangjin@sohu.com
