一株牛蒡根际纤维素降解芽孢菌的分离鉴定和发酵分析
2010-10-19侯进慧郑宝刚曹玉朋
侯进慧,蔡 侃,郑宝刚,曹玉朋,叶 骏
(徐州工程学院食品(生物)工程学院,江苏 徐州 221008)
一株牛蒡根际纤维素降解芽孢菌的分离鉴定和发酵分析
侯进慧,蔡 侃,郑宝刚,曹玉朋,叶 骏
(徐州工程学院食品(生物)工程学院,江苏 徐州 221008)
从牛蒡根际分离到一株纤维素降解菌株NP10。该菌是芽孢杆菌,其16S rDNA的Genbank序列号是FJ908093。分批发酵法对NP10进行的分析显示,该菌是一株碱性纤维素降解菌。其滤纸酶(FPA)酶活力在32℃、pH8发酵48h达到最大为18.2U/mL,其羧甲基纤维素酶(CMCase)活力在32℃、pH7发酵36h达到最大,为8.1U/mL。
牛蒡;根际微生物;纤维素降解菌;芽孢杆菌
Abstract:In this study, a cellulose-degrading bacterium, NP10, was isolated from burdock (Arctium lappaL.) rhizosphere. NP10 was identified to belong to the family ofBacillussp. and its 16S rDNA Genbank accession number was FJ908093. Meanwhile,NP10 was identified as an alkaline cellulose-degrading strain through batch fermentation. A maximum filter paper activity of 18.2 U/mL was obtained after 48 h fermentation under the conditions of 32 ℃ and initial pH 8, and the optimal fermentation temperature and duration as well as initial pH were 32 ℃, 36 h and 7, respectively, for achieving a maximum carboxymethyl cellulose activity of 8.1 U/mL.
Key words:burdock;rhizosphere;cellulose-degrading strain;Bacillus
牛蒡(Arctium lappaL.)是两年生草本植物,在分类上属于菊科牛蒡属。牛蒡的肉质根肥大,是一种可食用且营养价值较高的农产品,由于其具有抗菌、抑制肿瘤的作用,有着“东洋参”的美誉。江苏省徐州市丰县是我国牛蒡的主要产区,牛蒡种植面积达到全国总面积的40%以上[1],其牛蒡产品出口到日本、韩国等地区,经济效益较高。人们对牛蒡的研究很多都着眼于营养、食用和药理等方面,而与牛蒡产量息息相关的微生态系统特别是根际土壤微生物的研究却未见报道[2-4]。根际土壤微生物数目众多,种类也因植株而有较大差别,对其分析不仅可了解根际微生物与植株生长的关系,而且可以开发出新型菌种资源。
纤维素是自然界中分布广泛且产量最丰富的一种碳水化合物资源,但是由于降解困难,导致纤维素资源的利用率非常的低。比如秸秆和皮壳等原料大部分都被焚烧掉,这样做既危害生态平衡,又加重环境污染。纤维素分子可被纤维素酶降解。纤维素酶是一个酶系,能降解β-1,4-葡萄糖苷键。纤维素酶的研究是纤维素资源综合利用的基础。同时,纤维素酶也可以应用于牛蒡等农产品资源的开发利用。植物的根茎有着大量的纤维物质,而纤维物质的降解,对于提取植物抑菌、抗癌、抗衰老等有效成分有着重要的意义。因此,开发新型纤维素酶对于解决食品短缺、环境污染和能源危机等问题都有着一定的现实意义。
在纤维素降解研究中,人们对于真菌纤维素酶的研究较多,而对细菌纤维素酶的报道较少[5]。因此,需要通过生物工程方法加大对细菌纤维素酶的研究,以开发出特性各异的纤维素酶。本实验室在对牛蒡根际微生物的分析中,筛选到一株具有较高纤维素降解活性的菌株NP10,对其进行初步鉴定和酶学分析。
1 材料与方法
1.1 菌种
在两年中,从徐州丰县牛蒡产区的不同生长点随机取样,采集多株牛蒡,并与根际土壤一同带回实验室,完成菌株分离工作。
1.2 试剂
羧甲基纤维素、蛋白胨、酵母膏等分析纯 国药集团化学试剂有限公司;用于PCR反应和电泳检测的分子生物学试剂分别购自上海生工生物工程技术服务有限公司和天根生化科技(北京)有限公司。
1.3 培养基
用于菌株分离的初筛液体培养基(g/L):蛋白胨10、酵母粉5、NaCl 10、灭菌备用。固体培养基还需加琼脂粉12g/L,高压灭菌备用。产纤维素酶菌株筛选培养基(g):羧甲基纤维素10、蛋白胨10、酵母膏5、KH2PO41、MgSO40.2、NaCl 10、葡萄糖2、琼脂12,去离子水定溶至1L,灭菌备用。发酵培养基(g):羧甲基纤维素10、蛋白胨10、酵母膏1、去离子水定溶至1L,灭菌备用。
1.4 菌株分离与纯化
分别将5g牛蒡根际土壤样品加入50mL LB培养基中,在250mL锥形瓶中,以160r/min转速于25℃培养24h。取富集后的培养液进行梯度稀释,涂布于LB培养基,培养长出菌落后,再将菌落转接到产纤维素酶菌株筛选培养基,于培养温箱中培养2~4d,然后将质量浓度为0.5g/100mL的刚果红倒入培养基中染色5min,倒掉刚果红后,使用质量浓度为5g/100mL的NaCl溶液浸泡脱色1h[6]。若菌株周围有透明水解圈出现,则说明该菌株产纤维素酶。纤维素酶可以将培养基中的羧甲基纤维素水解为小分子质量的低聚糖、二糖或单糖,刚果红与羧甲基纤维素结合后显红色,而与小分子质量糖类结合不显红色,因此产纤维素酶菌株周围出现透明水解圈。对初筛到的菌株进行划单菌落复筛。对产纤维素酶菌株进行培养,测量透明水解圈与菌落直径的比值初步确定产纤维素酶活性高的菌株。
1.5 菌落形态观察和生理生化特征分析
在固体培养基上观察菌落特征,对细菌进行革兰氏染色和芽孢染色观察,并进行菌落生理生化特征分析[7-8]。
1.6 基因组DNA提取和16S rDNA序列分析
提取菌株NP10基因组DNA[9],作为PCR反应模板。使用细菌通用引物[10]:F:5'-AGAGTTTGATCCT GGCTCAG-3',R:5'-GGTTACCTTGTTACGACTT-3',扩增获得菌株16S rDNA序列。PCR反应体系(50μL):10×PCR反应缓冲液5μL,dNTP 4μL,上、下游引物各1μL,模板DNA 1μL,TaqDNA 聚合酶0.5 μL,加无菌超纯水补足体积。反应程序是:95℃预变性5min;95℃变性30s,54℃退火60s,72℃延伸90s,30个循环;72℃延伸10min。将获得的16S rDNA 片断送上海生工生物工程技术服务有限公司测序。用BLAST程序在GenBank基因库中将获得的16S rDNA序列进行序列比对,分析菌株分类地位。
1.7 纤维素酶活性发酵分析
采用分批发酵法培养菌株NP10,将种子培养液按2%接种量转接至含有50mL发酵培养基的250mL 锥形瓶中,进行发酵培养。发酵培养一定时间后,取出50mL发酵液,4000r/min离心10min,取上清作为粗酶液测定其酶活力。分析该菌产滤纸酶(FPA)、羧甲基纤维素酶(CMCase)的最适发酵pH值、温度和时间[11-12]。
2 结果与分析
2.1 产纤维素酶菌株的筛选

图1 菌株NP10产生的透明水解圈Fig.1 Transparent hydrolysis circle of NP10
如图1所示,通过刚果红染色法从牛蒡根际筛选到多株产纤维素酶菌株,其中菌株NP10产纤维素酶活性较高。
2.2 菌株NP10的鉴定

表1 菌株NP10生理生化特性分析结果Table 1 Physical and biochemical analyses of strain NP10
菌株NP10的菌落呈圆形、浅黄色、粗糙、不透明、边缘有皱褶。革兰氏染色呈阳性,芽孢染色观察可见有芽孢形成。菌株NP10的生理生化分析结果见表1。实验获得1419bp的16S rDNA序列,分析显示菌株NP10与Genbank中的Bacillus subtilissubsp. subtilis str.168序列相似性最高,达到100%,其Genbank序列号是FJ908093。菌株NP10与芽孢杆菌菌株的比对结果见图2。综合菌落形态观察、生理生化分析和16S rDNA序列特征等结果,确定菌株NP10是Bacillussp.。

图2 菌株NP10的16S rDNA序列分析结果Fig.2 Sequence analysis of NP10
2.3 pH值对菌株NP10产酶的影响

图3 pH值对菌株NP10产酶的影响Fig.3 Effect of pH on enzyme activity produced by NP10 fermentation
通过改变培养基的pH值,分析菌株NP10的产酶情况。如图3所示,在培养基pH值为7时,CMCase活性达到最大,在pH值为6和8时降到50%以下,在pH值小于5或大于9时则几乎检测不到酶活力。FPA活力在培养基pH8时达到最大,在pH5~10之间都有一定的活性。
2.4 温度对菌株NP10产酶的影响
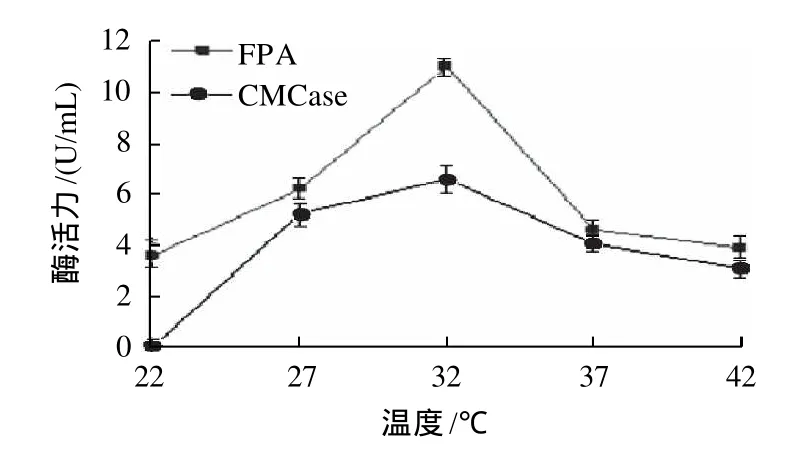
图4 温度对菌株NP10产酶的影响Fig.4 Effect of temperature on enzyme activity produced by NP10 fermentation
通过改变分批发酵过程中的培养温度,分析菌株NP10产酶情况。如图4所示,在发酵温度为32℃时,CMCase和FPA的活力均达到最大。在27℃到37℃之间时,FPA活力变化较大,而CMCase活力在这个温度范围内活力都比较高,变化较小。
2.5 培养时间对菌株NP10产酶的影响

图5 培养时间对菌株NP10产酶的影响Fig.5 Effect of cultivation time on enzyme activity produced by NP10 fermentation
通过在分批发酵过程中定时分析CMCase和FPA的活性,研究两种酶的活性变化。如图5所示,NP10在32℃、pH8时,分批发酵48h左右其FPA活力达到最大,是18.2U/mL;在32℃、pH7时,分批发酵36h其CMCase活力达到最大,为8.1U/mL。
3 讨 论
本实验在对牛蒡根际可培养微生物分析中发现了一株产纤维素酶活性较高的细菌,对其进行了鉴定和发酵分析。实验获得了菌株NP10长度1419bp的序列,结合菌落特征和生理生化分析结果,初步鉴定此菌株是Bacillussp.。对NP10进行的发酵分析显示,该菌是一株碱性纤维素酶产生菌。在32℃ pH8时,分批发酵48h,其FPA活性达到最大值18.2U/mL;在32℃pH7时,分批发酵36h,其CMCase活力达到最大值8.1U/mL。
在纤维素酶活性分析中,目前常用的检测方法是FPA和CMCase活性测定法。其中,FPA活性测定的底物是滤纸,其活性分析的是3类纤维素酶协同作用的效果,可以显示出发酵液总的酶活力。而CMCase活性测定法主要说明的是内切β-葡萄糖苷酶的活力,对于纤维素降解应用有重要的价值。与文献相比,本实验菌株NP10的CMCase活性较高[13-14]。有研究者分析一株产碱性纤维素酶的假诺卡氏菌属(Prauseria)放线菌,液体发酵显示其CMCase酶活力达7.64U/mL,在经过紫外诱变后活力达到17.59U/mL[14]。课题组将对菌株NP10进行诱变育种,提高其CMCase酶活力。
[1] 高明侠, 苗敬芝, 曹泽虹, 等. 双酶法提取牛蒡多糖的研究[J]. 食品科学, 2008, 29(9):260-263.
[2] MARUTA Y, KAWABATA J, NIKI R. Antioxidative caffeoylquinic acid derivatives in the roots of burdock (Arctium lappaL.)[J]. J Agric Food Chem, 1995, 43(10):2592-2595.
[3] KNIPPING K, ELISABETH C E, WIJERING S C, et al.In vitroandin vivoanti-allergic effects ofArctium lappaL.[J]. Exp Biol Med, 2008,233:1469-1477.
[4] KARDOSOVA A, EBRINGEROVA A, ALFOLDI J, et al. A biologically active fructan from the roots ofArctium lappaL. var. Herkules[J]. Int J Biol Macromol, 2003, 33:135-140.
[5] 徐建. 中性纤维素酶菌株的选育及强分解纤维素细菌1.1002分类地位的确立[D]. 沈阳:沈阳农业大学, 2000.
[6] 齐云, 陈飞, 袁月祥, 等. 一株能分解纤维素的高温耐碱放线菌[J].应用与环境生物学报, 2003, 9(3):322-325.
[7] 布坎南R E, 吉本斯N E. 伯杰细菌鉴定手册[M]. 北京:科学出版社,1984.
[8] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社, 2001.
[9] SYN C K C, SWARUP S. A scalable protocol for the isolation of largesized genomic DNA within an hour from several bacteria[J]. Analytical Biochemistry, 2000, 278:86-90.
[10] 焦振泉, 刘秀梅, 孟昭赫. 16S rRNA序列同源性分析与细菌系统分类鉴定[J]. 国外医学:卫生学分册, 1998, 25(1):12-16.
[11] BHAT M K, BHAT S. Cellulose degrading enzymes and their potential industrial applications[J]. Biotechnology Advance, 1997, 15:583-620.
[12] 陈电容. 生物化学与生化药品试验[M]. 北京:化学工业出版社, 2007:68-69.
[13] 魏亚琴, 李红玉. 纤维素酶高产菌选育研究进展及未来趋势[J]. 兰州大学学报:自然科学版, 2008, 44(7):107-115.
[14] 侯晓娟. 碱性纤维素酶产生菌的分离、选育、发酵产酶条件及酶学性质研究[D]. 西安:西北大学, 2008.
Isolation, Identification and Fermentation Analysis of a Cellulose-degrading Bacterium fromArctium lappaL. Rhizosphere
HOU Jin-hui,CAI Kan,ZHENG Bao-gang,CAO Yu-peng,YE Jun
(Food Engineering (Bioengineering) Department, Xuzhou Institute of Technology, Xuzhou 221008, China)
TS201.3
A
1002-6630(2010)21-0312-04
2010-07-01
徐州市科技计划项目(XZZD0924);徐州工程学院引进人才科研启动项目;徐州工程学院青年重点科研项目(XKY2008110);江苏省大学生实践创新计划项目(2010-971)
侯进慧(1980—),男,讲师,博士,研究方向为食品生物技术。E-mail:houjinhui0@126.com
