燕麦乙醇提取物分级萃取组分对血管平滑肌细胞增殖的抑制作用
2010-10-19籍保平杨佩颖蔡圣宝
黄 晨,籍保平*,杨佩颖,周 峰,吴 薇,蔡圣宝
(中国农业大学食品科学与营养工程学院,北京 100083)
燕麦乙醇提取物分级萃取组分对血管平滑肌细胞增殖的抑制作用
黄 晨,籍保平*,杨佩颖,周 峰,吴 薇,蔡圣宝
(中国农业大学食品科学与营养工程学院,北京 100083)
选用不同极性的溶剂对燕麦乙醇提取物进行分级萃取,并对得到的4种不同萃取组分进行体外DPPH自由基清除能力、抑制血管平滑肌细胞(VSMC)增殖能力及促进VSMC释放NO能力进行评价。结果发现:4种组分中,乙酸乙酯萃取组分具有最强的DPPH自由基清除能力,其EC50值为(2.5±0.4)mg/mL;通过抑制VSMC增殖的实验研究发现,乙酸乙酯萃取组分能显著抑制VSMC增殖,提高VSMC产NO能力。选用HPLC对乙酸乙酯萃取组分进行初步分析发现其主要含有3种蒽酰胺组分,分别为Bc、Bp和Bf。
燕麦乙醇提取物;血管平滑肌;增殖抑制作用;一氧化氮
Abstract:The ethanol extract from oat was fractionated with different polarity solvents (n-hexane, ethyl acetate, 1-butanol and water), and the four fractions obtained were assessed for their abilities to scavenge DPPH free radicals, inhibit the proliferation of vascular smooth muscle cells (VSMC) and promote the release of NO from VSMCin vitro. Among these four fractions,the ethyl acetate soluble fraction had the most prominent DPPH free radical scavenging ability, with an EC50 of (2.5±0.4)mg/mL. Meanwhile, this fraction could remarkably inhibit the proliferation of VSMC and elevate the NO producing ability. The preliminary HPLC analysis indicated that this fraction mainly contained three kinds of avenanthramide, Bc, Bp and Bf.
Key words:ethanol extract from oat;vascular smooth muscle cell;inhibition of proliferation;NO
动脉粥样硬化(atherosclerosis,AS)是一种慢性炎症疾病,由多种危险因素诱发,伴随有动脉内膜和内膜下脂质(胆固醇、胆固醇酯、磷脂等)的沉积,同时伴有平滑肌细胞(VSMC)和纤维成分的增殖,逐渐发展形成局部性斑块,动脉管壁因而增厚变硬,斑块内部组织坏死崩解与沉积的脂质结合,形成“粥样”物质。AS能造成通往心脏和大脑的动脉血管变狭窄,甚至堵塞,其发展的最后结果是冠心病和脑血管意外[1]。体外实验显示,氧化型低密度脂蛋白(ox-LDL)通过刺激VSMC内神经鞘磷脂酶活性以及促进VSMC释放成纤维细胞生成因子等发生作用能促进VSMC和巨噬细胞增殖,VSMC增殖是AS病变的最主要特征之一[2]。目前国内外已经发现多种抗氧化剂可以在动物模型中抑制泡沫细胞的形成,从而起到抗AS的作用,如N-乙酰半胱氨酸等,其作用机理主要是通过清除活性氧(ROS),抑制LDL氧化,从而抑制炎症基因表达和VSMC增殖,起到血管细胞保护作用[3]。
燕麦具有较全面的营养价值,抗氧化性是燕麦较为突出的一项生理功能。早在20世纪30年代就有学者发现燕麦具有抗氧化性,并提出将燕麦作为一种抗氧化剂的来源。近年来,燕麦的抗氧化活性已成为西方发达国家研究的热点之一,并对燕麦抗氧化成分组成进行了一系列的研究。结果发现,燕麦中含有多种抗氧化物质,包括VE,酚类等物质,而酚类物质是其中含量最丰富的抗氧化成分,此外燕麦中还含有少量类黄酮和甾体[4]。本研究选用不同极性的溶剂对燕麦醇提物进行分级萃取,得到4种不同的萃取组分,并对这4种组分的体外清除DPPH自由基能力和抑制VSMC增殖作用进行研究,为燕麦功能产品的开发提供参考。
1 材料与方法
1.1 材料与试剂
G4品种燕麦 中国农业科学院作物品种资源研究所;兔胸主动脉平滑肌细胞 中国协和医科大学细胞中心。
DMEM高糖培养基、胎牛血清(FBS) 美国Gibco公司;DPPH自由基(二苯代苦味肼基自由基,2,2-diphenyl-1-picrylhydrazyl) Sigma公司;NO测定试剂盒 南京建成生物工程研究所;ox-LDL 中国协和医科大学生化教研室;蒽酰胺标准品(Bc、Bp、Bf) 美国农业部谷物研究中心专家Mitchell Wise博士惠赠;乙腈(色谱纯) 美国Mallinckrodt Baker 公司;甲醇(色谱纯)北京化学试剂公司。
1.2 仪器与设备
XDOS-1B倒置显微镜 重庆光电有限公司;MCO-15AC培养箱、S2ML420/2420U全自动杀菌釜 日本Sanyo公司;Mltiskan MK3自动酶标仪 美国Thermo公司;LC-10ATvp HPLC泵、SPD-M10Avp二极管阵列检测器、DGU-12A HPLC脱气机、Shim-Pack VP-ODSC18分析柱(250mm×4.6mm,5μm)、Shim-Pack GVP-ODS C18分析柱保护柱(10mm×4.6mm,5μm) 日本岛津公司。
1.3 方法
1.3.1 燕麦乙醇提取物不同组分萃取
干燥燕麦打粉后称取100g燕麦粉,先用1L 80%无水乙醇30℃超声提取30min,然后置于60℃、150r/min恒温水浴器中水浴振荡2h,冷却到室温,1200×g离心15min,取上清,残渣重复提取一次,合并上清,45℃真空浓缩至膏状,冷冻干燥得到燕麦乙醇提取物。称取适量燕麦乙醇提取物,先用少量甲醇分散,然后加蒸馏水溶解,将溶液置于分液漏斗中,加入正己烷,充分振摇萃取,静置,待溶液完全分层后,取出上层的正己烷萃取液,下层再用同法萃取两次,将3次的正己烷萃取液合并,用无水硫酸钠干燥后,减压回收正己烷,得到燕麦乙醇提取物的正己烷部分。正己烷萃取后的水溶液按照上述同样的方法用乙酸乙酯、正丁醇依次萃取,依次得到了乙酸乙酯浸膏、正丁醇浸膏。将正己烷、乙酸乙酯和正丁醇萃取物真空干燥,水萃取物冷冻干燥分别得到4种固体粉末。
1.3.2 燕麦乙醇提取物分级萃取组分清除DPPH自由基能力测定
燕麦乙醇提取物各分级萃取物DPPH自由基能力清除测定根据Kondo等[5]使用的方法完成。用无水乙醇配制浓度为0.06mmol/L的DPPH溶液,吸取该溶液4mL于试管中,加入0.2mL无水乙醇,作为空白,于波长517nm处测其初始吸光度(A0);另取4mL DPPH溶液,加入0.2mL样品溶液,避光放置1h后于波长517nm处测定其吸光度(A1)。用吸光度的大小表示DPPH溶液浓度的高低。根据测得的吸光度A0、A1及DPPH溶液的初始浓度即可计算样品的EC50值(即将DPPH溶液浓度减至50%时所需的样品浓度)。EC50值大小与DPPH自由基清除能力成反比。每个样品测定时作3次平行。
1.3.3 VSMC增殖模型建立
取12代的VSMC,用0.25%胰蛋白酶消化制成细胞悬液,计数并接种于96孔板中,加入含20%胎牛血清的完全DMEM培养基,使每孔最终体积为200μL,培养24h使细胞贴壁后加入不同浓度的ox-LDL培养24h,然后利用MTT法测定VSMC的增殖吸光度,并用NO试剂盒测定上清液中NO含量。
1.3.4 燕麦乙醇提取物分级萃取物对VSMC增殖抑制作用
1.3.4.1 细胞增殖能力测定
弃去培养液,每孔加入20μL 5mg/mL MTT溶液,37℃继续培养4h后终止培养,吸弃培养上清液,每孔加150μL DMSO,振荡10min;在490nm波长处进行比色,在酶标仪上测定各孔吸光度。吸光度与细胞活性成正比,吸光度越大表示细胞活性越强。
1.3.4.2 NO的测定
细胞培养24h后,收集培养液离心,测上清液NO含量,按试剂盒方法进行操作。
1.3.5 乙酸乙酯萃取组分的HPLC分析
HPLC条件:VP-ODS C18柱 (250mm ×4.6mm,5μm);柱温30℃;检测器为二极管阵列检测器(SPDM10 Avp)。液相条件:流动相为两相,A相为100%乙腈,B相为含有0.1%甲酸的蒸馏水,流速控制在1mL/min。梯度洗脱为:0~5min乙腈的体积分数保持为18%,5~50min乙腈的体积分数变化为18%~35%;50~51min乙腈体积分数变化为35%~60%;51~65min乙腈体积分数保持为60%;65~66min乙腈体积分数变化为60%~18%。进样量每次20μL。检测波长为330nm。
1.4 统计分析
采用SPSS13.0统计软件对数据进行处理,实验结果以平均值±标准差(±s)表示,采用组间t检验,P<0.05具有显著性差异,P<0.01具有极显著性差异。
2 结果与分析
2.1 燕麦乙醇提取物分级萃取物的质量和质量分数
按照极性由小到大的顺序,选取正己烷、乙酸乙酯、正丁醇和水对燕麦乙醇提取物进行分级萃取,得到燕麦乙醇提取物的4种不同萃取物,其占乙醇提取物的质量分数见表1,其中极性最低的正己烷萃取物质量分数最高,达到了乙醇提取物质量的44.57%,其次是水部分,为6.56%,乙酸乙酯和正丁醇部分萃取质量分数最低,分别为乙醇提取物质量的3.86%和2.66%。

表1 燕麦乙醇提取物分级萃取物的质量和质量分数Table 1 Masses and percentages of different polarity fractions in ethanol extract from oat
2.2 燕麦分级萃取物的DPPH自由基能力清除测定

表2 燕麦乙醇提取物分级萃取物清除DPPH自由基EC50值Table 2 EC50values of different polarity fractions of ethanol extract from oat for scavenging DPPH free radicals
由表2可知,乙酸乙酯萃取物的EC50值最小(P<0.01),也就是说其清除DPPH自由基的能力最强,其次是正丁醇萃取物,正己烷萃取物和水萃取物EC50值最大,说明它们的DPPH自由基清除能力远远低于乙酸乙酯萃取物和正丁醇萃取物。
2.3 ox-LDL诱导VSMC增殖模型的建立
ox-LDL是AS发展和形成的关键因素,它由LDL氧化修饰形成,能够损伤内皮细胞,导致泡沫细胞形成,还能促进血管VSMC和巨噬细胞的增殖[6],因此用ox-LDL诱导可以较好的模拟体内AS形成病理过程,在很多研究中广泛用于VSMC增殖模型的建立[7]。从图1可以看出,VSMC经过ox-LDL诱导培养24h后,各质量浓度ox-LDL下细胞均发生了显著的增殖,MTT所得的吸光度较正常对照组有显著的差异,尤其在ox-LDL质量浓度达到30μg/mL的时候,细胞增殖最为明显(P<0.01),之后细胞增殖呈现下降趋势。有研究表明,NO能通过阻止VSMC细胞周期的运行、抑制VSMC 的有丝分裂来抑制VSMC的增殖[8-9]。随着VSMC的增殖,NO生成量相应减少,其对VSMC增殖的抑制作用下降,形成恶性循环。当ox-LDL质量浓度超过20μg/mL时,NO的释放量发生显著的降低,当ox-LDL质量浓度为30μg/mL时,NO释放量是所有组中最低的(P<0.01)。
从以上实验结果可以得出,30μg/mLox-LDL与VSMC共同孵育培养24h后,VSMC增殖最明显,NO的生产量最低,因此,可以选用30μg/mL作为造模质量浓度。

图1 ox-LDL处理VSMC后MTT和NO值变化Fig.1 Effect of treatment with different concentrations of ox-LDL on MTT value and NO release
2.4 燕麦乙醇提取物分级萃取物对VSMC细胞增殖的抑制作用
2.4.1 细胞增殖能力测定

图2 燕麦乙醇提取物分级萃取物对VSMC增殖的抑制作用Fig.2 Comparative inhibitory effects of different polarity fractions of ethanol extract from oat on VSMC proliferation
各样品对兔胸VSMC增殖抑制作用的影响如图2所示。与模型对照组相比,燕麦乙醇提取物正己烷萃取部分和水萃取部分各组对VSMC的增殖均没有显著的抑制作用(P>0.05);高质量浓度和低质量浓度的正丁醇萃取部分(CH、CL)对VSMC的增殖有较显著的抑制作用(P<0.05);而不同质量浓度乙酸乙酯萃取物 (YH、YM、YL)对VSMC的增殖具有极其显著的抑制作用(P<0.01),由此可知乙酸乙酯萃取物抑制ox-LDL诱导的VSMC增殖作用最好。
2.4.2 燕麦乙醇提取物分级萃取物对VSMC产NO能力影响

图3 燕麦乙醇提取物分级萃取物对VSMC产NO能力影响Fig.3 Comparative inhibitory effects of different polarity fractions of ethanol extract from oat on NO release
图3显示了各萃取物部分对兔胸VSMC产NO能力的影响。造模浓度ox-LDL孵育24h后,与正常对照组(K)比较,模型对照组(M)VSMC释放NO的含量显著减少(P<0.01),燕麦乙醇提取物正己烷萃取部分(WH、WM、WL)和水萃取组分(SH、SM、SL)各组对ox-LDL诱导的VSMC产NO能力均没有显著的影响 (P>0.05)。正丁醇萃取部分的中质量浓度组(CM)和乙酸乙酯萃取部分低质量浓度组(YL)对VSMC产NO能力有较显著的增强作用(P<0.05);乙酸乙酯萃取物高质量浓度和中质量浓度组(YH、YM)对VSMC的产NO能力有极显著的增强作用(P<0.01),综上可知,乙酸乙酯萃取物能最大程度的促进NO的产生,对VSMC增殖具有显著的抑制作用。
2.5 乙酸乙酯萃取组分的HPLC分析
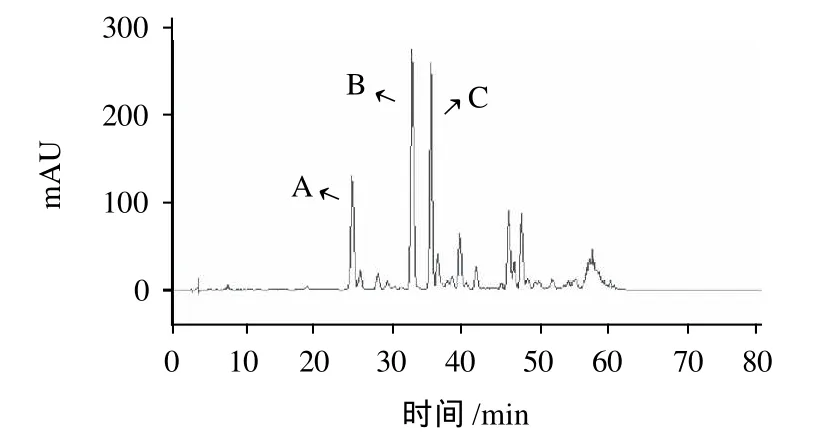
图4 燕麦乙酸乙酯萃取物的HPLC色谱图Fig.4 HPLC profile of ethyl acetate soluble fraction of ethanol extract from oat
研究发现燕麦乙醇提取物的乙酸乙酯萃取组分具有最好的抑制VSMC增殖功效,因此用HPLC对乙酸乙酯萃取组分进行了初步的成分分析,结果如图4所示,在色谱图中出现了3个较大的检测峰A、B、C,是乙酸乙酯萃取组分的主要成分,它们的保留时间与燕麦蒽酰胺标准品Bc、Bp和Bf一致(图5),分别为24.1、32.6、35.0min,因此可以初步推断峰A是蒽酰胺Bc、峰B是Bp、峰C是Bf。

图5 燕麦蒽酰胺标准品Bc、Bp和Bf 的HPLC色谱图Fig.5 HPLC profile of mixed Bc, Bp and Bf standards
3 讨 论
AS发展过程中的一个重要病理特征就是VSMC的增殖。正常情况下,动脉壁中层的VSMC处于分化状态,没有增殖和迁移的能力,但当在多种刺激因素作用下,VSMC可由分化状态转变为去分化状态,可以从中膜迁移至内膜进行大量增殖[9]。而抑制VSMC增殖是治疗AS等血管增殖性疾病的重要途径。
本研究采用ox-LDL诱导VSMC增殖。ox-LDL的生成是AS发展和形成的关键因素,它由LDL氧化修饰形成,能够损伤内皮细胞,导致泡沫细胞形成,还能促进血管VSMC和巨噬细胞增殖[5],因此用ox-LDL诱导较好地模拟了体内AS形成病理过程,在很多研究中广泛用于VSMC增殖模型的建立[10]。本研究选用不同质量浓度的ox-LDL培养VSMC 24h后发现,当ox-LDL质量浓度为30μg/mL时,与正常对照组相比,VSMC出现极显著增殖,而VSMC产NO的能力却极显著下降,从而说明,当ox-LDL质量浓度为30μg/mL时能成功诱导造成VSMC增殖模型。
4种燕麦乙醇提取物的分级萃取物干预对兔胸VSMC增殖的影响不同,其中正己烷萃取部分高中低3个质量浓度组(WH、WM、WL)和水溶性组分(SH、SM、SL)对VSMC的增殖均没有显著抑制作用(P>0.05)。高质量浓度和低质量浓度的正丁醇萃取部分(CH、CL)对VSMC的增殖有较显著抑制作用(P<0.05);而不同质量浓度乙酸乙酯萃取物组分(YH、YM、YL)对VSMC的增殖均具有极其显著抑制作用(P<0.01)。这可能与不同组分清除DPPH自由基能力不同有关,通过体外清除DPPH自由基实验发现,正己烷和水组分清除DPPH自由基能力较弱,而乙酸乙酯萃取组分具有很强的清除DPPH自由基能力,正丁醇萃取组分也具有一定的清除DPPH自由基能力。大量研究证明,VSMC的增殖对氧化还原作用非常敏感,许多抗氧化成分都能够抑制VSMC的过度增殖,特别是酚类抗氧化成分,如绿茶多酚[6]、槲皮素[11]等。因此乙酸乙酯萃取组分和正丁醇萃取组分是否是通过抗氧化作用调节细胞生长周期和增殖能力而起作用,还有待于进一步研究。
在AS形成发展的同时伴随NO合成功能受损。NO是一种具有多种确定生物学作用的活性分子,它除具备可调节血管张力,抑制血小板向血管损伤部位的黏附和聚集,抑制白细胞与内皮下基质的黏附等有益作用外,还能抑制VSMC的增殖,其机制与NO能阻止VSMC细胞周期的运行、抑制VSMC 的有丝分裂及脱氧核糖核酸(DNA)的合成有关[8-9]。本研究发现乙酸乙酯和正丁醇萃取组分均能提高VSMC的NO生成量,乙酸乙酯组分的NO含量高于正丁醇组分。以往的许多研究表明酚类成分具有较强的VSMC增殖抑制力[11]。燕麦中含有丰富的酚类物质[12]。美国塔夫斯大学营养研究中心用细胞培养评价手段,对燕麦酚类物质抗AS能力进行了研究,发现燕麦酚类及蒽酰胺能够抑制VSMC增生,修复内皮细胞和VSMC合成NO能力,增强NO合酶(eNOS)活性,降低单层内皮细胞黏附能力,具有潜在的抗AS功能[13-14]。它们的研究结果与燕麦醇提物乙酸乙酯萃取组分的研究结果具有一致性。
本研究发现燕麦醇提物乙酸乙酯萃取组分在清除DPPH自由基,抑制VSMC增殖及促进VSMC合成NO能力方面均具有显著的效果。通过HPLC分析乙酸乙酯萃取物组分和蒽酰胺标准品的保留时间,推断乙酸乙酯萃取组分的3个主要检测峰分别是蒽酰胺Bc、Bp和Bf。近年来,Peterson等[15]研究发现燕麦中的蒽酰胺Bc、Bp和Bf具有显著的抗氧化效果,尤其是蒽酰胺Bc,其抗氧化效果最为显著,因此乙酸乙酯萃取组分显著的抑制VSMC增殖作用可能与蒽酰胺Bc、Bp和Bf有关,这有待于进一步研究验证。
[1] 陈修. 心脑血管药理学[M]. 北京:人民卫生出版社, 2002:115-118.
[2] JAIN K S, KATHIRAVAN M K, SOMANI R S, et al. The biology and chemistry of hyperlipidemia[J]. Bioorganic and Medicinal Chemistry,2007, 15(14):4674-4699.
[3] COMINACINI L, ULISSE G, PASINI A F, et al. Antioxidants inhibit the expression of intercellular cell adhension molecula-1 and vascular cell adhension molecule-1 induced by oxidized LDL on human umbilical endothelial cells[J]. Free Radical Biology and Medicine, 1997, 22(1/2):117-127.
[4] PETERSON D M. Oat antioxidants[J]. Journal of Cereal Science, 2001,33:115-129.
[5] KONDO S, TSUDA K, MUTO N, et al. Antioxidative activity of apple skin or flesh extracts associated with fruit development on selected apple cultivars[J]. Scientia Horticulturae, 2002, 96:177-185.
[6] STEINBERG D. Low density lipoprotein oxidation its pathobiological significance[J]. Journal of Biological Chemistry, 1997, 272(34):20963-20966.
[7] LOCHER R, EMMANUELE L, SUTER P M, et al. Green tea polyphenols inhibit human vascular smooth muscle cell proliferation stimulated by native low-density lipoprotein[J]. European Journal of Pharmacology,2002, 434:1-7.
[8] 邓次妮, 沈潞华. 一氧化氮合酶/一氧化氮系统与心血管疾病[J]. 心血管病学进展, 2007, 28(4):603-605.
[9] BUNDY R E, MARCZIN N, BIRKS E F, et al. Transplant atherosclerosis:role of phenotypic modulation of vascular smooth muscle by nitric oxide[J]. General Pharmacology, 2000, 34:73-78.
[10] OWENS G K. Regulation of differentiation of vascular smooth muscle[J]. Physiological Reviews, 1995, 75(7):487-517.
[11] MOON S K, CHO G O, JUNG S Y, et al. Quercetin exerts multiple inhibitory effects on vascular smooth muscle cells:role of ERK1/2, cellcycle regulation, and matrix metalloproteinase-9[J]. Biochemical and Biophysical Research Communications, 2003, 301:1069-1078.
[12] SOSULSKI F, KRYGIER K, HOGGE L. Free, esterified, and insolublebound phenolic acids. 3. composition of phenolic acids in cereal and potato flours[J]. Journal of Agricultural and Food Chemistry, 1982, 30(2):337-340.
[13] NIE L, WISE M L, PETERSON D M, et al. Avenanthramide, a polyphenol from oats, inhibits vascular smooth muscle cell proliferation and enhances nitric oxide production[J]. Atherosclerosis, 2006, 186:260-266.
[14] LIU Liping, ZUBIC L, COLLINS F W, et al. The antiatherogenic potential of oat phenolic compounds[J]. Atherosclerosis, 2004, 17:39-49.
[15] PETERSON D M, HAHN M J, EMMONS C L. Oat avenanthramides exhibit antioxidant activitiesin vitro[J]. Food Chemistry, 2002, 79:473-478.
Inhibitory Effect of Different Polarity Fractions of Ethanol Extract from Oat on Vascular Smooth Muscle Cell Proliferation
HUANG Chen,JI Bao-ping*,YANG Pei-ying,ZHOU Feng,WU Wei,CAI Sheng-bao
(College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China)
TS210.1
A
1002-6630(2010)21-0335-05
2010-04-15
“十一五”国家科技支撑计划项目(2006BAD05A06-Z01)
黄晨(1984—),男,硕士研究生,主要从事功能食品研究。E-mail:huangchen19840925@yahoo.com.cn
*通信作者:籍保平(1958 —),男,教授,硕士,主要从事功能食品研究。E-mail:jbp@cau.edu.cn
