SOCS3基因重组腺病毒的构建及其在猪脂肪细胞中的表达
2010-10-16杨双娟徐成权吴江维杨公社
杨双娟,徐成权,吴江维,杨公社
西北农林科技大学 动物脂肪沉积与肌肉发育实验室,杨凌 712100
SOCS3基因重组腺病毒的构建及其在猪脂肪细胞中的表达
杨双娟,徐成权,吴江维,杨公社
西北农林科技大学 动物脂肪沉积与肌肉发育实验室,杨凌 712100
本研究旨在构建细胞因子信号转导抑制因子3(Suppressor of cytokine signaling 3,SOCS3)的重组腺病毒表达载体,获得有感染性的病毒颗粒。以 pcDNA3-SOCS3质粒为模板扩增SOCS3基因,将其亚克隆至腺病毒穿梭载体pAdTrack-CMV,经测序验证后,重组的穿梭质粒用PmeI酶切线性化后转化到BJ5183感受态细菌中与其内的骨架载体pAdEasy-1进行同源重组,获得的重组质粒pAd-SOCS3,经PacI线性化后转染至HEK293细胞中进行包装和扩增,纯化后用 TCID50法测定病毒滴度。以重组的病毒感染原代培养的猪脂肪细胞后,荧光显微镜下观察报告基因GFP的表达,RT-PCR和Western blotting检测细胞内SOCS3mRNA和蛋白的表达。重组腺病毒载体pAd-SOCS3经酶切及PCR鉴定正确,病毒滴度为1.2×109PFU/mL;感染原代培养的猪脂肪细胞后,荧光显微镜观察可见报告基因GFP的表达;RT-PCR和Western blotting检测到细胞中SOCS3mRNA和蛋白的表达显著提高。本研究成功构建了SOCS3基因的重组腺病毒,感染原代培养的猪脂肪细胞可稳定表达SOCS3蛋白,为深入研究SOCS3的功能奠定了基础。
SOCS3,重组腺病毒,猪脂肪细胞
Abstract:In order to construct recombinant adenovirus vector expressing Suppressor of cytokine signaling 3(SOCS3)and obtain infectious adenoviral particles,SOCS3gene was amplified from plasmid pcDNA3-SOCS3and subcloned into the adenovirus shuttle plasmid pAdTrack-CMV.After sequence confirmation, the recombinant shuttle plasmid pAdTrack-CMV-SOCS3was linearized byPmeI, and then transformed into BJ5183 competent cell, the recombinant plasmid pAd-SOCS3was obtained by homologous recombination between pAdTrack-CMV-SOCS3and the adenoviral backbone plasmid pAdEasy-1 in BJ5183.The pAd-SOCS3was linearized byPacI and transfected into HEK293 cells via liposome.The recombinant adenovirus was packaged and amplified in HEK293 cells.After purifying, virus titer was determined by tissue culture infectious dose 50(TCID50).Using the recombinant adenoviruses to infect porcine primary adipocytes, the expression of green fluorescent protein(GFP)was observed by fluorescent microscopy, andSOCS3gene was identified by RT-PCR and Western blotting.Restriction enzyme and PCR analysis demonstrated that the recombinant adenovirus vector was constructed correctly, and the virus titer reached 1.2×109PFU/mL.The result of RT-PCRand Western blotting showed thatSOCS3mRNA and protein expression was remarkably increased in porcine primary adipocytes infected with recombinant adenovirus.In conclusion, this study successfully constructed the recombinant adenovirus containingSOCS3gene, and can be helpful for further research on the function ofSOCS3.
Keywords:SOCS3, recombinant adenovirus, porcine primary adipocytes
SOCS3(Suppressor of cytokine signaling 3)是1997年发现的细胞因子信号转导抑制因子(Suppressor of cytokine signaling,SOCS)家族成员之一,最初被认为是JAK/STAT信号通路的负反馈调节因子[1-3]。后来许多研究已证实SOCS3主要参与负调控生长激素(GH)、白细胞介素-1(IL-1)、IL-2、IL-6、肿瘤坏死因子-α(TNF-α)、干扰素-γ(IFN-γ)和瘦素(Leptin)等细胞因子的信号转导[4-7]。近年来,随着对 SOCS3研究的深入,人们发现 SOCS3参与并抑制了胰岛素信号的转导,在胰岛素抵抗中发挥重要作用[8-10]。胰岛素抵抗不仅是许多临床疾病的共同基础,而且还是诱发高血压、Ⅱ型糖尿病、肥胖症、脂代谢紊乱等综合征的核心原因。目前,胰岛素抵抗已成为全世界生命科学的研究热点和难点。因此,明确SOCS3在胰岛素信号通路中的分子机理,可为治疗胰岛素抵抗提供新的研究靶点。
猪在心血管解剖结构和功能、脂蛋白分布和大小、肥胖倾向性及种类习性方面,其表现型与人类很相似,而且,它与人类在遗传学上也具有高度的相似性,特别是遗传决定的代谢相似性[11]。这使得猪成为了研究人类肥胖、糖尿病及其并发症等疾病的最佳模式动物,在未来的医学研究中发挥不可忽视的作用。本研究利用含双启动子的腺病毒表达系统构建了SOCS3基因的重组腺病毒载体,转染原代培养的猪脂肪细胞后获得了 SOCS3基因的稳定表达,为进一步研究SOCS3在猪脂肪细胞胰岛素信号通路中的功能奠定了基础。
1 材料与方法
1.1 材料
1.1.1 实验动物、细胞株、菌种与载体
实验动物为 3日龄健康长白仔猪(3头),体重1.5~2.5 kg,取样前用0.5%的新洁尔灭清洗0.5 h,电击处死。Escherichia coli DH5α感受态细菌购自天根生化科技有限公司。HEK293细胞株、BJ5183感受态细菌、pcDNA3-SOCS3质粒、腺病毒穿梭载体pAdTrack-CMV及骨架载体pAdEasy-1均为本实验室保存。
1.1.2 工具酶和其他试剂
内切酶Kpn I、Xho I、T4 DNA连接酶、Taq聚合酶、DNA Marker及RNA提取试剂(Trizol)均购自TaKaRa公司;限制性内切酶Pme I与Pac I购自美国New England Biolabs公司;质粒抽提和DNA片段凝胶快速回收试剂盒购自 BioFlux公司;LipofectamineTM2000购自Invitrogen公司;DMEM(低糖)、F12干粉,Ⅰ型胶原酶与胎牛血清购自Gibco公司;牛血清白蛋白购自Amersco公司;胰蛋白酶、HEPES、DMSO购自Merck公司;RevertAidTMFirst Strand cDNA Synthesis Kit购自 Fermentas公司;SOCS3鼠源性单克隆抗体购自美国Millipore公司;羊抗鼠二抗购自Santa Cruz公司;蛋白Marker购自南京金斯瑞生物科技公司;其余试剂均为进口或国产分析纯;引物合成及DNA测序由上海生工生物技术有限公司完成。
1.2 方法
1.2.1 质粒pcDNA3-SOCS3扩增SOCS3基因
根据质粒pcDNA3-SOCS3上的人SOCS3基因序列设计合成一对引物,上游引物SOCS3-F:5′-CGG GGTACCGAGCTCGGATCCACTAG-3′;下游引物SOCS3-R:5′-CCGCTCGAGTTAAAGCGGGGCATC GTAC-3′。在上下游引物的 5′端分别引入内切酶Kpn I与Xho I的识别序列(即下划线部分),并加入保护碱基。
以质粒pcDNA3-SOCS3为模板,由上下游引物经PCR反应得到人SOCS3基因片段,电泳后回收目的片段。反应参数:5℃预变性5 min;94℃变性1 min,56℃退火1 min,72℃延伸1 min,循环30次;72℃再延伸10 min。预期PCR产物长度应为750 bp。
1.2.2 重组病毒穿梭质粒pAdTrack-CMV-SOCS3的构建与鉴定
将回收的 SOCS3基因片段和腺病毒穿梭质粒pAdTrack-CMV用内切酶Kpn I、Xho I进行双酶切后,电泳并回收片段。回收产物(SOCS3片段和切开的 pAdTrack-CMV)在 T4 DNA连接酶作用下于16℃连接过夜。连接产物氯化钙法转化E.coli DH5α感受态细菌,转化的菌液均匀涂布于含100 mg/L卡那霉素的 LB平板上进行筛选,挑取单克隆摇菌,提取质粒,经Kpn I、Xho I双酶切和PCR鉴定后,将获得的阳性克隆质粒(命名为 pAdTrack-CMVSOCS3)进行测序。利用NCBI的BLAST比对将测序结果与GenBank中公布的人SOCS3基因序列进行同源性比较分析。
1.2.3 重组病毒质粒pAd-SOCS3的构建与鉴定
先将腺病毒骨架载体pAdEasy-1转化到BJ5183细菌中,转化的菌液均匀涂布于含100 mg/L氨苄青霉素的 LB平板上进行筛选,挑取单克隆摇菌,制备成含有 pAdEasy-1的BJ5183感受态细菌。再将重组的质粒pAdTrack-CMV-SOCS3用Pme I 酶切线性化后转化到含有pAdEasy-1的BJ5183感受态细菌中,与其内的 pAdEasy-1进行同源重组,并于含100 mg/L卡那霉素的LB平板上进行筛选,挑取单克隆摇菌,抽提质粒,进行Pac I 酶切和PCR鉴定,并将正确的重组质粒命名为pAd-SOCS3。
1.2.4 重组病毒的包装、扩增及纯化
将pAd-SOCS3转化至E.coli DH5α感受态细菌中,大量扩繁后提取质粒,经Pac I酶切、乙醇沉淀后收集 pAd-SOCS3质粒,将线性化的 pAd-SOCS3用LipofectaminTM2000转染至HEK293细胞中进行包装,观察细胞内报告基因GFP的表达及细胞病变(Cytopathic effect,CPE)情况。转染后7 d收集上清作为病毒原液,然后用病毒原液再次感染HEK293细胞,扩增病毒。感染多次后,将收集的病毒经CsCl密度梯度离心法进行纯化。纯化后的病毒命名为Ad-SOCS3,并于−80℃保存。
1.2.5 重组病毒的滴度测定
采用重复性较高的半数组织培养感染剂量(Tissue culture infectious dose 50,TCID50)法测定重组病毒 Ad-SOCS3的滴度。以 1×104个/孔接种HEK293细胞于96孔板;倍比稀释病毒,分别以不同稀释浓度(10−3~10−10)病毒溶液感染细胞;每个稀释度的病毒溶液以100 μL/孔分别感染10孔细胞,还有 2孔细胞作为阴性对照(不加病毒)。以含 4%胎牛血清的DMEM培养基培养细胞,10 d后观察每一稀释度出现CPE的孔数,并计算CPE阳性比率之和(稀释度为 10−1与 10−2的阳性比率计算在内,其值均为 1)。根据 Karbers公式计算病毒滴度:T=10×101+d(s–0.5)TCID50/mL。其中 d = log10 稀释度=1(对于10倍的稀释度而言);s = 阳性比率之和(从第一个10倍比稀释度算起)。并根据以下公式,换算成 PFU/mL 单位:T = 1×10xTCID50/mL = 1×10x–0.7PFU /mL。
1.2.6 猪脂肪细胞的原代培养
无菌状态下取仔猪颈部、肩胛及背部皮下脂肪,用含双抗的PBS缓冲液浸泡、冲洗2次。分离去除脂肪组织中可见的纤维及血管,剪成约1 mm3的组织块,向剪碎的组织块中加入1 mg/L的Ⅰ型胶原酶消化液,置37℃振荡摇床内温育60~80 min后取出,200目细胞钢筛过滤,滤液以2000 r/min离心5 min,弃上清,沉淀物用无血清培养液重悬,1000 r/min离心10 min,弃上清,沉积的细胞团块用基础培养液制成细胞悬液后以 5.0×104个/cm2密度接种至培养板中,置于37℃、5% CO2培养箱内培养,1 d后换液,之后每2天换液1次。直到细胞出现生长抑制。
1.2.7 感染重组病毒的猪脂肪细胞的形态学及GFP表达的观察
将接种于六孔板中的原代脂肪细胞移去培养液后,每孔加入500 μL新鲜培养基,1孔为对照,其余每孔分别加入 2、5、10、25和 50 μL病毒液,缓慢摇晃培养板后置于培养箱内培养 3 h,再加入1.5 mL培养基培养 72 h,观察每孔细胞是否出现CPE。若感染后3 d细胞完全出现CPE的病毒的感染复数(MOI)值即为10。用60 mm培养皿培养猪脂肪细胞,待细胞铺满时以筛选的最佳MOI量的病毒感染4皿细胞,感染72 h后在显微镜下观察细胞的形态变化及细胞内报告基因GFP的表达情况。
1.2.8 感染重组病毒的猪脂肪细胞中SOCS3 mRNA和蛋白表达的检测
分别以不同MOI(10,20,30)的重组病毒感染原代培养的脂肪细胞,感染48 h后提取细胞总RNA,RT-PCR检测SOCS3基因的表达情况,感染72 h后提取细胞的总蛋白,Western blotting检测SOCS3蛋白的表达情况。RT-PCR检测时,根据GenBank中公布的猪SOCS3基因序列设计一对引物,上游引物SOCS3-F(5′-3′):GTGCGCCATGGTCACCCAC;下游引物 SOCS3-R(5′-3′):GTCCAGGAACTCCCGAAT。
1.3 统计分析
采用SPSS 11.5统计软件One-way ANOVA进行方差分析与显著性检验。实验数据以平均值±标准误表示。
2 结果
2.1 质粒pcDNA3-SOCS3扩增产物的鉴定
以质粒pcDNA3-SOCS3为模板,PCR扩增后的产物为单一条带,大小约为750 bp(图1)。
2.2 重组质粒pAdTrack-CMV-SOCS3的鉴定
构建好的重组质粒 pAdTrack-CMV-SOCS3经Kpn I、Xho I双酶切电泳后可见2个条带,大片段为切开的 pAdTrack-CMV,大小约 9.2 kb,小片段为SOCS3,大小约750 bp(图2A),与预期的结果相一致。以 pAdTrack-CMV-SOCS3为模板,进行 PCR鉴定,结果可见大小约为750 bp的条带(图2B),与图A中的小片段相符。将回收的小片段测序后,片段大小为735 bp,与GenBank中公布的人SOCS3基因序列(GenBank Accession No.NM-003955)进行同源性比较分析,核苷酸序列同源性为99%,其中第183位碱基发生了同义突变,由T→C,对应氨基酸序列同源性为100%,证明pAdTrack-CMV中插入的人SOCS3基因正确。
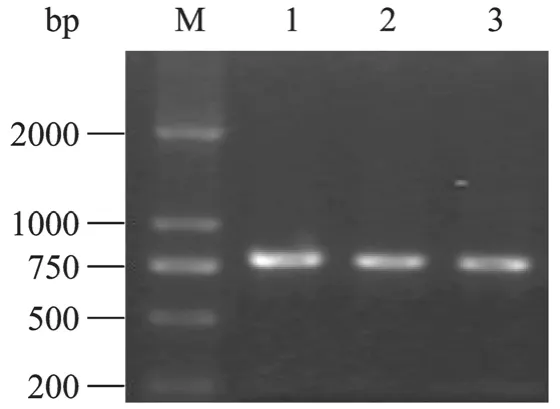
图1 pcDNA3-SOCS3 PCR产物的琼脂糖凝胶电泳分析Fig.1 Agarose gel electrophoresis of pcDNA3-SOCS3PCR product.M: DNA marker; 1−3: PCR product of pcDNA3-SOCS3.
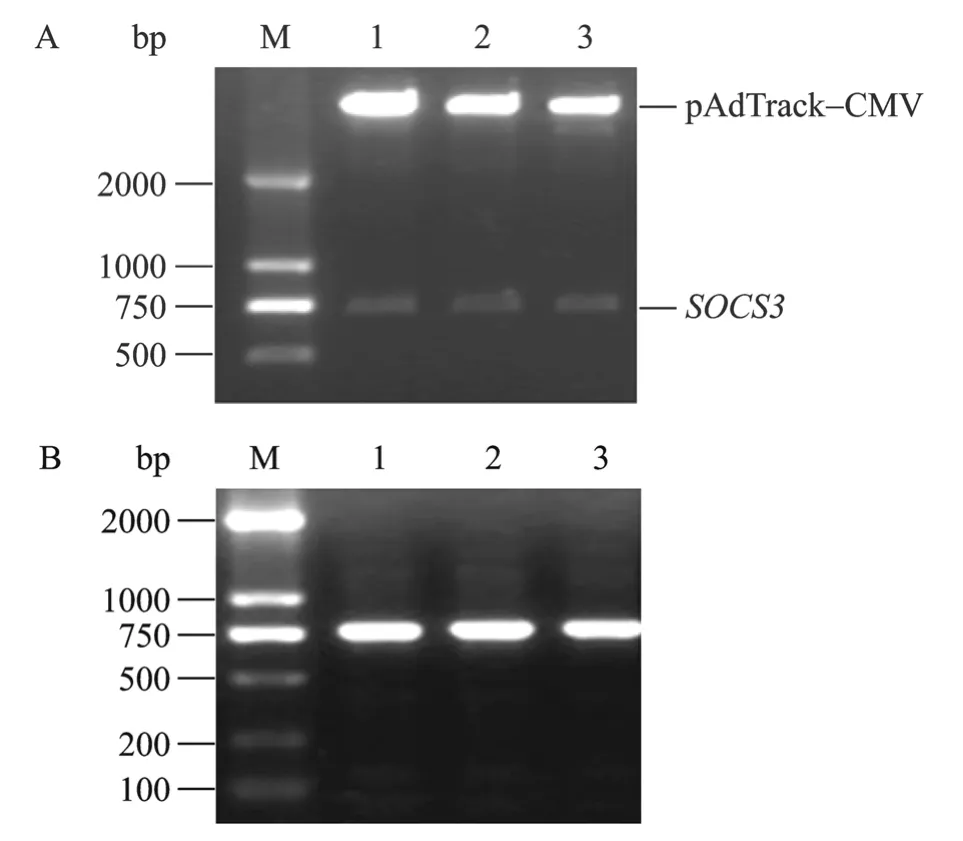
图2 pAdTrack-CMV-SOCS3的鉴定Fig.2 Identification of recombinant pAdTrack-CMV-SOCS3.(A)pAdTrack-CMV-SOCS3was identified by restriction enzyme digestion(KpnI andXhoI).M: DNA marker; 1−3:pAdTrack-CMV(9.2 kb)andSOCS3fragment(735 bp).(B)PCR analysis of recombinant pAdTrack-CMV-SOCS3.M: DNA marker; 1−3: PCR product of pAdTrack-CMV-SOCS3.
2.3 重组质粒pAd-SOCS3的鉴定
线性化的 pAdTrack-CMV-SOCS3与 BJ5183中的pAdEasy-1同源重组后,筛选时挑取的3个单克隆质粒经 Pac I酶切后均释放出一个大小为 4.5 kb的小片段(图3A),分别以这3个质粒为模板,进行PCR鉴定,结果均可得到大小为735 bp左右的片段(图3B),与预期结果相符。证明这3个单克隆都为阳性克隆,均为正确的重组质粒pAd-SOCS3。
2.4 重组病毒的包装、扩增、纯化及病毒滴度测定
pAd-SOCS3转染HEK293细胞48 h后GFP开始表达,此时在荧光显微镜下观察可见零星、散在的荧光(图4B),转染3 d后GFP的表达急剧升高,荧光数量显著增加(图4C)。转染4 d后细胞开始出现典型的 CPE,光镜下可见原本紧密生长的细胞出现肿胀、变圆、皱缩等明显细胞病变(图4D)。转染5 d后由于包装好的腺病毒释放到上清中,并感染周围的细胞,在荧光显微镜下可见荧光大量增加,并聚集在一起(图4E)。随着时间的延长,整个视野荧光数量逐渐增多。转染7 d后,95%以上的细胞出现了 CPE变化(图4F),而未转染 pAd-SOCS3的HEK293细胞生长正常,仍呈梭形或三角形(图4A)。包装好的重组腺病毒Ad-SOCS3经扩增和纯化后,用TCID50法测定病毒滴度,滴度达到1.2×109PFU/mL。
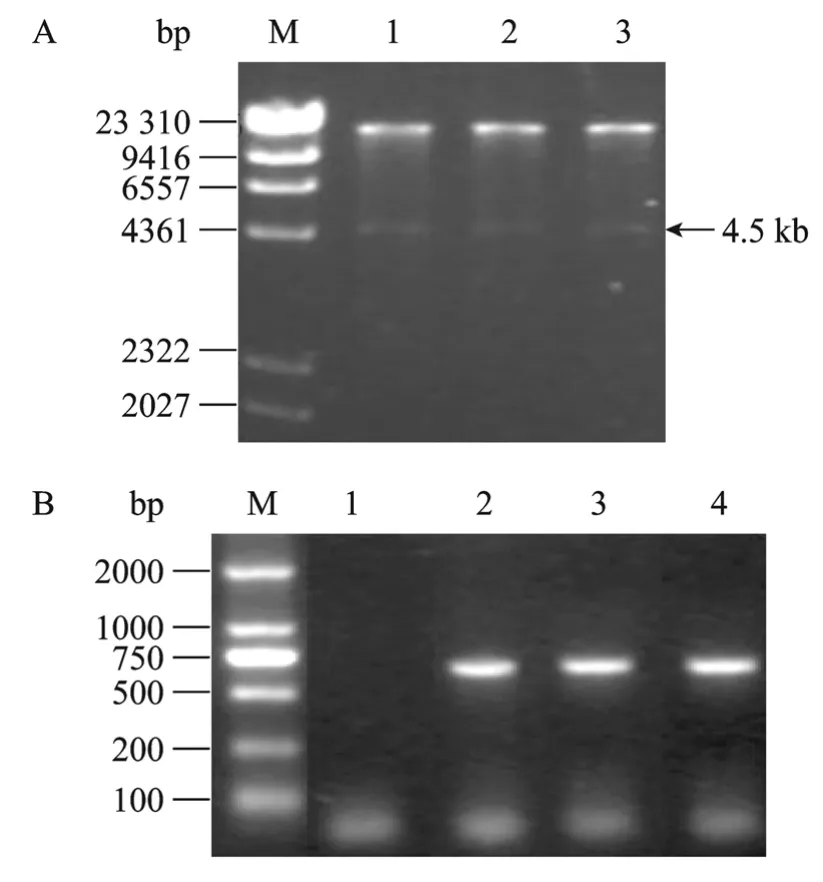
图3 pAd-SOCS3的鉴定Fig.3 Identification of recombinant pAd-SOCS3.(A)pAd-SOCS3digested withPacI.M: λDNA/Hind Ⅲ marker;1−3: three clones of pAd-SOCS3, all of them released a 4.5 kb fragment afterPacI digestion.(B)PCR analysis of recombinant pAd-SOCS3.M: DNA marker; 1: PCR product of empty vector,as control; 2–4: PCR product of three clones of pAd-SOCS3in Fig.3A.
2.5 原代猪脂肪细胞的形态学观察
经胶原酶消化后培养的原代猪脂肪细胞 6 h开始有少量成纤维细胞样细胞散在贴壁,未贴壁细胞为球形。培养24 h,换液除去未贴壁细胞后,贴壁细胞大部分为短梭形或不规则的三角形(图5A)。培养 4 d后,部分细胞开始分化,细胞内出现松散的小脂滴,脂滴大小不一、数量不等,细胞形态也不一致(图5B)。随着培养时间的延长,细胞体积增加,胞内脂滴逐渐增大并融合在一起,8 d左右,整个细胞充满脂滴,折光性较强,细胞核被脂滴挤到了边缘(图5C)。分化的脂肪细胞经油红 O染色后,光镜下可见脂滴被染成红色,而未分化的细胞则没有着色(图5D)。
2.6 感染重组病毒的猪脂肪细胞的形态学及GFP表达的观察
重组病毒感染原代培养的猪脂肪细胞72 h后,置光学显微镜下观察时发现与正常细胞和感染只表达GFP空载病毒的细胞(图6A,B)相比,感染重组病毒后的未分化的脂肪细胞体积减小,整个细胞变瘦拉长,细胞与细胞间的间隙加大,而分化的细胞体积变化不明显,胞内的脂滴大小几乎不变(图6C)。在荧光显微镜下观察时发现约 80%的细胞都能表达GFP,其中未分化的前体脂肪细胞荧光较弱,而分化的细胞荧光较强(图6D)。另外,分化的细胞中脂滴内无GFP的表达,GFP只定位于脂滴周围的胞质中(图6D,箭头所示)。
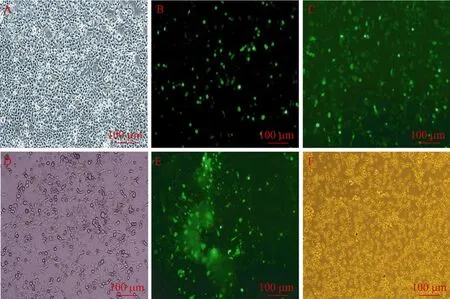
图4 重组腺病毒pAd-SOCS3转染HEK 293细胞的观察Fig.4 Observation of HEK 293 cells transfected by pAd-SOCS3.(A)Normal HEK 293, as control.(B)HEK 293 cells transfected by pAd-SOCS3for 48 h, the GFP began to express.(C)HEK 293 cells transfected by pAd-SOCS3for 3 days, the GFP expression increased rapidly.(D)HEK 293 cells transfected by pAd-SOCS3for 4 days, cells began to appear CPE.(E)HEK 293 cells transfected by pAd-SOCS3for 5 days, the fluorescence of GFP togethered.(F)HEK 293 cells transfected by pAd-SOCS3for 7 days, above 95%cells appeared CPE.
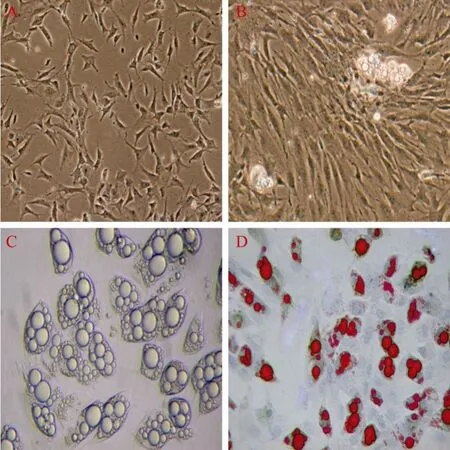
图5 原代培养猪脂肪细胞的形态学观察Fig.5 Morphology observation of porcine primary adipocytes.(A)Adipocytes were culturedin vitrofor 24 h.Showing stretched fibroblast-like or triangle cell phenotypes.(B)Adipocytes were culturedin vitrofor 4 days.Showing small lipid droplet in cytoplasm.(C)Adipocytes were culturedin vitrofor 8 days.Some small lipid droplets fusing in cytoplasm.(D)Differentiated adipocytes stained by Oil Red O.Lipid droplets were stained red by Oil Red O.

图6 重组病毒Ad-SOCS3感染原代脂肪细胞的观察Fig.6 Observation of porcine primary adipocytes infected by Ad-SOCS3.(A)Normal porcine primary adipocytes.(B)Porcine primary adipocytes infected by Ad-GFP, as control.(C)Porcine primary adipocytes infected by Ad-SOCS3for 72 h , the morphous of adipocytes were changed.(D)Porcine primary adipocytes infected by Ad-SOCS3for 72 h, about 80% cells could express GFP.Arrow indicated the GFP localization of differentiated adipocytes.
2.7 感染重组病毒的猪脂肪细胞中SOCS3 mRNA和蛋白表达的检测
以 MOI为 10、20、30的重组病毒感染原代培养的脂肪细胞48 h后提取总RNA,RT-PCR扩增产物经 1%琼脂糖凝胶电泳,紫外凝胶成像仪下照像结果见图7A。利用Dolphin-DOC凝胶成像系统软件测定电泳条带的OD值,以β-actin基因为内参,未感染病毒(MOI=0)的细胞为对照,将SOCS3基因测定得到的OD值与β-actin基因测定的OD值相比,所得数值利用SPSS软件进行One-way ANOVA方差分析与显著性检验。分析结果见图7B。感染 72 h后提取细胞的总蛋白,以β-actin为内参,未感染病毒(MOI=0)的细胞为对照,Western blotting 检测SOCS3蛋白的表达,结果见图7C。由图A、B可知,感染了重组病毒的细胞中SOCS3基因的表达显著高于未感染病毒的细胞(P<0.05)。当 MOI为 10和20时,二者 SOCS3基因的表达差异不显著,而当MOI为30时SOCS3基因的表达显著高于MOI为10和 20的细胞。由 C图可知,基础状态下,SOCS3蛋白的表达量很低,但感染重组病毒后,SOCS3蛋白的表达量显著提高。
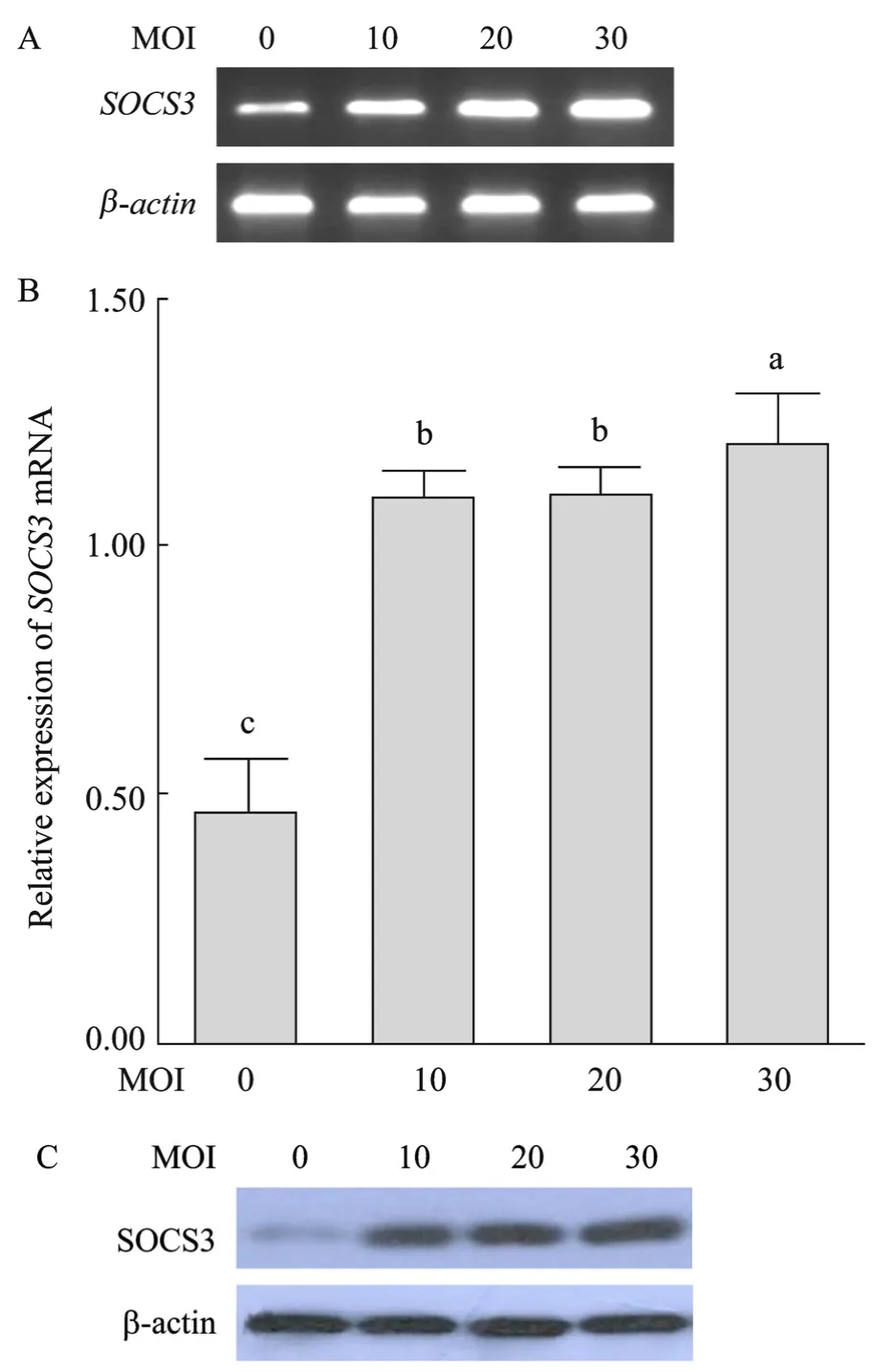
图7 感染Ad-SOCS3的原代脂肪细胞中SOCS3 mRNA和蛋白的表达Fig.7 Expression ofSOCS3mRNA and protein in porcine primary adipocytes infected by Ad-SOCS3.(A)Electrophoresis result ofSOCS3andβ-actinPCR products in porcine primary adipocytes infected by Ad-SOCS3(MOI=0, 10, 20, 30).(B)Quantitation analysis ofSOCS3mRNA relative toβ-actinfrom A.Different letters show significant difference(P< 0.05).(C)Western blotting analysis of SOCS3 and β-actin protein expression in porcine primary adipocytes infected by Ad-SOCS3(β-actinas internal control).
3 讨论
胰岛素抵抗属于机体糖代谢紊乱的慢性病理过程,是诱发高血压、Ⅱ型糖尿病和肥胖症等综合征的核心原因。胰岛素抵抗由许多因素引起,而胰岛素信号传递受阻或减弱是导致胰岛素抵抗的主要原因之一。胰岛素是由胰腺β细胞分泌的激素类物质,其主要通过作用于脂肪、肌肉及肝脏 3大靶组织来影响机体的糖代谢和脂代谢。近年来,国内外的许多研究表明,胰岛素不仅能够诱导SOCS3的表达,而且其诱导产生的SOCS3能够特异性地抑制胰岛素信号通路,在胰岛素抵抗中发挥重要作用[12-13]。因此,明确SOCS3在胰岛素信号通路中的作用及机理能够为从根本上治疗Ⅱ型糖尿病和肥胖症等代谢综合征提供重要的理论依据。
一直以来,关于SOCS3在胰岛素信号通路中的研究主要集中在大鼠、小鼠等动物的肝脏及细胞系上,而在脂肪组织及肌肉组织中的研究较少。近年,猪作为最接近人类的模式动物,已成为研究肥胖和糖尿病的理想模型[11],越来越多地受到研究者的青睐。但到目前为止,有关原代培养的猪脂肪细胞中SOCS3对胰岛素信号通路的作用尚未见报道。本实验室长期开展有关体外培养猪脂肪细胞的发育及代谢方面的工作。最初,本研究小组在研究猪脂肪细胞SOCS3的功能时,用含有SOCS3基因的pcDNA3-SOCS3质粒转染原代培养的猪脂肪细胞,经 G418筛选后发现其转染效率极低,几乎不超过 2%,远远达不到实验的要求,而转染 3T3-L1脂肪细胞系后,转染效率显著提高,能达到 30%~40%。这说明普通质粒的转染对于细胞系是可取的,但对于原代培养的细胞而言,并不是最佳的选择。
通常情况下,SOCS3以低水平存在于未受刺激的细胞内,为了能够在脂肪细胞中获得稳定表达的SOCS3蛋白,进一步研究其在胰岛素信号通路中的作用,本研究选择了构建SOCS3的重组腺病毒表达载体。与其他载体相比,重组腺病毒载体具有靶细胞种类多,导入效率高;可插入大片段外源基因;不整合到宿主基因组中,不会引起插入突变;容易得到高滴度病毒等优点,是目前高效蛋白表达和基因治疗研究的首选载体[14]。本研究采纳的利用AdEasy系统快速获得重组腺病毒的构建方法[15],与传统的重组腺病毒构建方法相比,操作更为简单,重组效率更高,获得的病毒更纯,不仅缩短了载体的构建时间,而且能够实现外源基因在不同类型细胞中的高效表达。另外,不同物种SOCS3基因的保守性极高,人 SOCS3基因与猪 SOCS3基因核苷酸序列的同源性为94%,对应的氨基酸序列的同源性高达97%。基于以上两方面的考虑,本研究将外源的人 SOCS3基因插入到腺病毒穿梭载体pAdTrack-CMV中,构建SOCS3的重组腺病毒表达载体,并用其感染原代培养的猪脂肪细胞,以实现SOCS3基因在脂肪细胞中的稳定表达。
总之,本研究成功构建了SOCS3基因的重组腺病毒Ad-SOCS3,获得了有感染性的病毒颗粒。病毒滴度高达1.2×109PFU/mL,感染原代培养的猪脂肪细胞后,在荧光显微镜下观察可见80%的细胞表达报告基因GFP。RT-PCR和Western blotting分析结果证明在感染重组病毒的脂肪细胞中SOCS3 mRNA和蛋白的表达均显著提高,即实现了SOCS3基因在原代脂肪细胞中的高效、稳定表达。这不仅克服了pcDNA3-SOCS3质粒在脂肪细胞中转染效率低的问题,更为进一步研究SOCS3在猪脂肪细胞中胰岛素信号通路中的作用奠定了基础。
REFERENCES
[1]Starr R, Willson TA, Viney EM,et al.A family of cytokine inducible inhibitors of signalling.Nature, 1997,387: 917−921.
[2]Endo TA, Masuhara M, Yokouchi M,et al.A new proteincontaining an SH2 domain that inhibits JAK kinases.Nature, 1997, 387: 921−924.
[3]Naka T, Narazaki M, Hirata M,et al.Structure and function of a new STAT-induced STAT inhibitor.Nature,1997, 387: 924−929.
[4]Krebs DL, Hilton DJ.SOCS: physiological suppressors of cytokine signaling.J Cell Sci, 2000, 113: 2813−2819.
[5]Krebs DL, Hilton DJ.SOCS proteins: negative regulators of cytokine signaling.Stem Cells, 2001, 19: 378−387.
[6]Alexander WS.Suppressors of cytokine signaling(SOCS)in the immune system.Nat Rev Immunol, 2002, 2:410−416.
[7]Ronn SG, Hansen JA, Lindberg K,et al.The effect of suppressor of cytokine signaling 3 on GH signaling in ß-cells.Mol Endocrinol, 2002, 16(9): 2124−2134
[8]Emanuelli B, Peraldi P, Filloux C,et al.SOCS-3 is an insulin-induced negative regulator of insulin signaling.J Biol Chem, 2000, 275: 15985−15991.
[9]Krebs DL, Hilton DJ.A new role for SOCS in insulin action: suppressor of cytokine signaling.Sci STKE, 2003,169: 6.
[10]Howard JK, Flier JS.Attenuation of leptin and insulin signaling by SOCS proteins.Trends Endocrinol Metab,2006, 17: 365−371.
[11]Yang GS, Zhang HW, Bai L,et al.Pig—a ideal study animal model of obesity and diabeties.Prog Nat Sci, 2008,18(5): 481−487.杨公社, 张浩卫, 白亮, 等.猪—研究肥胖和糖尿病的理想模式动物.自然科学进展, 2008, 18(5): 481−487.
[12]Ronn SG, Billestrup N, Mandrup-Poulsen T.Diabetes and suppressors of cytokine signaling proteins.Diabetes,2007, 56: 541−548.
[13]Zhang HW, Wu JW, Wang B,et al.Regulation of SOCS-3, OB, GLUT4 and PPARγ gene expression by insulin and dexamethasone in porcine primary adipocyte.Chin J Biotech, 2008, 24(8): 1354−1360.张浩卫, 吴江维, 王博, 等.地塞米松和胰岛素调节猪脂肪细胞SOCS-3、OB、GLUT4和PPARγ基因的表达.生物工程学报, 2008, 24(8): 1354−1360.
[14]Vorburger SA, Hunt KK.Adenoviral gene therapy.Oncologist, 2002, 7(1): 46−59.
[15]Luo JY, Deng ZL, Luo XJ,et al.A protocol for rapid generation of recombinant adenoviruses using the AdEasy system.Nat Protoc, 2007, 2: 1236−1247.
Construction of SOCS3 recombinant adenovirus and its expression in porcine primary adipocytes
Shuangjuan Yang, Chengquan Xu, Jiangwei Wu, and Gongshe Yang
Laboratory of Animal Fat Deposition and Muscle Development, Northwest A & F University, Yangling 712100, China
